动物源食品中磺胺类药物残留的免疫分析方法研究进展
2018-11-14王佳陶晓奇
王佳 ,陶晓奇,2*
1(西南大学 食品科学学院,重庆,400715)2(重庆市特色食品工程技术研究中心,重庆,400715)
磺胺类药物(sulfonamides, SAs)是指具有对氨基苯磺酰胺结构的一类药物的总称,具有广谱抗菌活性。它能抑制细菌叶酸代谢,干扰细菌核酸和蛋白质的合成,从而对革兰氏阳性菌、革兰氏阴性菌以及一些原生生物具有抑制作用[1],且使用方便、价格便宜。因此该类药物被广泛应用于动物疾病的预防和治疗。
SAs主要在鸡、鱼、猪肉、牛奶、蜂蜜和鸡蛋等动物性食品中存在部分残留[2]。若长期食用含有该类药物的食物,会导致耐药性菌株的产生,引起过敏、中毒甚至癌变等症状,对人体健康有很大危害[3]。欧盟、美国、加拿大规定动物源食品中SAs总量不得超过100 μg/kg[4],日本规定不得超过20 μg/kg[5]。我国农业部235号公告明确规定:所有动物源性食品中,磺胺类药物总量的最高残留限量(maximum residue limits, MRL)为100 μg/kg,磺胺二甲嘧啶(sulfamethazine, SM2)的MRL为25 μg/kg[6]。
目前,动物性食品中SAs的检测方法有:色谱/质谱法[7-9]、毛细管电泳法[10]、微生物抑制法[11]、免疫分析法[12]、分光光度法[13]等理化方法。本文就近几年SAs的免疫分析方法进行综述,以期为兽药残留的监控提供有益参考。
1 抗原
常见的残留药物均为小分子化合物(一般分子质量小于1 000),缺乏T细胞表位而不能直接刺激动物机体产生抗体,而将小分子药物与大分子载体蛋白连接后可直接刺激动物机体产生针对原小分子药物的特异性抗体。在免疫学上,将这种小分子药物称为半抗原,因其只具备反应原性,不具备免疫原性。将半抗原与载体蛋白连接后形成的大分子物质称为全抗原(结合抗原),因其同时具备反应原性和免疫原性。
1.1 免疫半抗原的设计
免疫半抗原设计的基本原则是半抗原与载体连接后,在全抗原中能最大程度的保持和突出待测物的特征结构,特别是空间结构。其一般结构包括:待测物的特征结构、间隔臂以及末端的活性基团。一些情况下,待测物可直接作为半抗原与载体蛋白相连,其间隔臂为待测物中的非特异性结构;而多数情况下,需自行构建间隔臂,间隔臂的位置应远离待测物的特征结构部分和官能团,其长度取4~6碳为宜。间隔臂末端一般连接氨基或羧基作为活性基团,这样可以简单地运用合成肽的方法通过稳定的酰胺键将半抗原与载体蛋白相连。SAs半抗原设计应保留磺胺母核对氨基苯磺酰胺结构,同时使半抗原空间结构、疏水性、电荷性质与母体分子的相似性最大化[14]。CHEN 等[15]以对乙酰氨基苯磺酰氯为原料,通过取代反应合成了7种不同结构的半抗原,包含五元噻唑环、六元苯环、嘧啶环以及直链烷基结构。将其中4种偶联牛血清白蛋白作为免疫原,7种均偶联卵清蛋白作为包被原,经过多次免疫和血清筛选,制备出高亲和力的广谱特异性抗体。
1.2 全抗原的合成
蛋白质结构复杂,免疫原性好,故一般采用蛋白质作为载体,常用的载体蛋白有牛血清白蛋白(bovine serum albumin, BSA)、鸡卵清蛋白(ovalbumin, OVA)、人血清白蛋白(human serum albumin, HSA)、钥孔血蓝蛋白(keyhole limpet hemocyanin, KLH)等。蛋白质结构中供连接的基团主要为游离氨基、游离羧基和酚基等,连接方式取决于半抗原活性基团种类、溶解度和稳定性。含有氨基和羧基的半抗原,可使用肽合成化学方法在温和的条件下将半抗原和载体共价结合,常用方法有重氮化法,碳二亚胺法和N-羟基琥珀酰亚胺活性酯法(N-hydroxysuccinimide, NHS)[16]等。含有巯基或羟基的半抗原,可使用双官能团试剂,如琥珀酸酐、卤代脂肪酸等进行处理,生成带氨基或羧基的化合物后再进行连接。WANG等[17]使用EDC/NHS将磺胺半抗原与BSA偶联作为免疫原免疫新西兰白兔,成功制备了可用于检测26种磺胺药物的广谱特异性多克隆抗体。HOLGER等[18]使用DCC/NHS将磺胺甲恶唑(sulfamethoxazole, SMX)半抗原偶联KLH作为免疫原免疫新西兰白兔,制备针对SMX的高亲和力和选择性的多克隆抗体,使用该抗体建立直接竞争酶联免疫吸附测定法(enzyme-linked immunosorbent assay, ELISA),检测环境水样中的SMX,其定量范围为0.82~63 μg/L。
2 抗体
抗体是免疫分析中的核心试剂,一般从效价、亲和性和特异性3个方面来评价抗体的性能。抗体的研究历经了多克隆抗体、单克隆抗体和基因工程抗体3个阶段。目前广义的新型抗体主要有基因工程抗体、核酸适配体、分子印迹聚合物和受体等[19]。
2.1 多克隆抗体(polyclonal antibody, PcAb)
多克隆抗体是由多个抗原决定簇刺激机体产生反应,产生的多种单克隆抗体混合在一起构成的抗体,因其制备周期短,成本低等特点,广泛应用于科学研究和临床诊断。WANG 等[17]合成了3种不同免疫原来免疫新西兰白兔,制备SAs族特异性多克隆抗体,使用该抗体对26种磺胺药物进行ELISA分析,其IC50(50%结合时待测物浓度)均低于100 ng/mL。
2.2 单克隆抗体(monoclonal antibody, McAb)
单克隆抗体是由单一的B淋巴细胞分裂增殖而来的细胞克隆分泌的抗体,针对某一特定的抗原决定簇或表位,在免疫特性、理化性质等方面都是高度均一的。基于杂交瘤技术,单克隆抗体具有重现性高和无限供应的优势,因此商业化免疫检测产品多使用单克隆抗体;但其制备周期较长,一般需要6~12个月,成本较高。CHEN等[15]针对磺胺N1位点不同结构,设计了4种不同免疫原,用于免疫Balb/c小鼠,经过多次免疫和血清筛选,结果显示:含嘧啶环的半抗原S5免疫后产生的抗血清结合直链烷基结构半抗原S3异源包被时,对大多数磺胺药物均有抑制,显示出广谱特异性,其IC50最低达0.15 ng/mL。
2.3 基因工程抗体(genetic engineering antibody)
基因工程抗体是将抗体的基因重组并克隆到表达载体中,在适当的宿主中表达并折叠成有功能的一种抗体分子。它增强了天然抗体的特异性等生物学特性,减少了无关和产生副作用的结构,如嵌合抗体、人源化抗体、单链抗体、二硫键稳定抗体、Fab片段、纳米抗体、双特异性抗体等[20]。LI等[21]应用基因工程技术制备了SAs单链抗体,通过间接竞争ELISA得知其仍保留了亲本单克隆抗体的识别特性。基因工程抗体具有相对分子质量低、亲和力高、可塑性强,且形成的抗原抗体复合物稳定等优点。
2.4 核酸适配体(aptamer)
核酸适配体是人工合成的单链寡核苷酸(DNA或RNA),它是从人工构建的寡核苷酸文库中通过体外配体指数级富集系统进化技术(systematic evolution of ligands by exponential enrichment, SELEX)筛选而来的。核酸适配体的功能与抗体相似,但与抗体相比,其分子量小、合成简单、且适用范围更广(能高亲和力和高特异性结合药物、蛋白质、细胞、金属离子等物质)[22]。CHEN等[23]基于胶体金-核酸适配体比色法建立了定量检测磺胺二甲氧嘧啶的方法。其原理是:随机卷曲的单链DNA(磺胺二甲氧嘧啶核酸适配体)碱基和金纳米粒子间存在静电吸引作用,因此较容易吸附到金颗粒表面,从而避免了高浓度盐引起的胶体金聚沉变色的现象;而与待测物结合后,折叠的单链DNA具有了刚性结构,不易吸附到金颗粒表面。该方法可通过观察胶体金颜色变化定性待测物,使用分光光度法比色定量待测物。优化实验后,其检测限为50 μg/L,线性范围为50~1 000 μg/L。具有线性范围宽,操作简便、适合现场检测等优点。
2.5 分子印迹聚合物(molecularly imprinted polymer, MIP)
分子印迹聚合物是一种新型的分子识别材料,其识别机制与抗体-抗原反应类似。它是以模版分子、功能单体、交联剂和引发剂为原料,在光或热触发下合成的具有与模版分子空间结构和功能基团排列相匹配的结合位点的分子识别材料。SONG等[24]合成了可同时识别8种SAs和8种氟喹诺酮类药物(fluoroquinolones, FQs)的MIP,结合固相萃取分离猪肉和鸡肉中的药物,其柱吸附能力和回收均达到较高水准。这种材料具有高度的专一性和稳定性,被认为是较好的生物抗体替代品。
2.6 受体(receptor)
受体学说认为大多数药物与细胞膜上或细胞膜内的某些特定分子结合,才能发生效应,这些特定的分子被称为受体。配体受体相互作用是分子识别的过程,主要包括静电作用、氢键作用、疏水相互作用、范德华力等。梁晓等[25]通过体外扩增来源于肺炎双球菌和大肠杆菌的floP基因序列,表达纯化了来源于肺炎双球菌R6和大肠杆菌ATCC 25922的二氢叶酸合成酶,并基于该受体蛋白建立了可同时检测牛奶中29种磺胺药物的微孔板检测法,其IC50值为2.95~56.22 μg/L,均低于最高残留检测限。
3 免疫分析方法
近几年,动物性食品中磺胺类药物的免疫分析方法有大量报道,主要有酶联免疫吸附测定、荧光免疫分析法、化学发光免疫反应、胶体金免疫层析以及生物传感器等方法,表1为相关文献的简要概括。
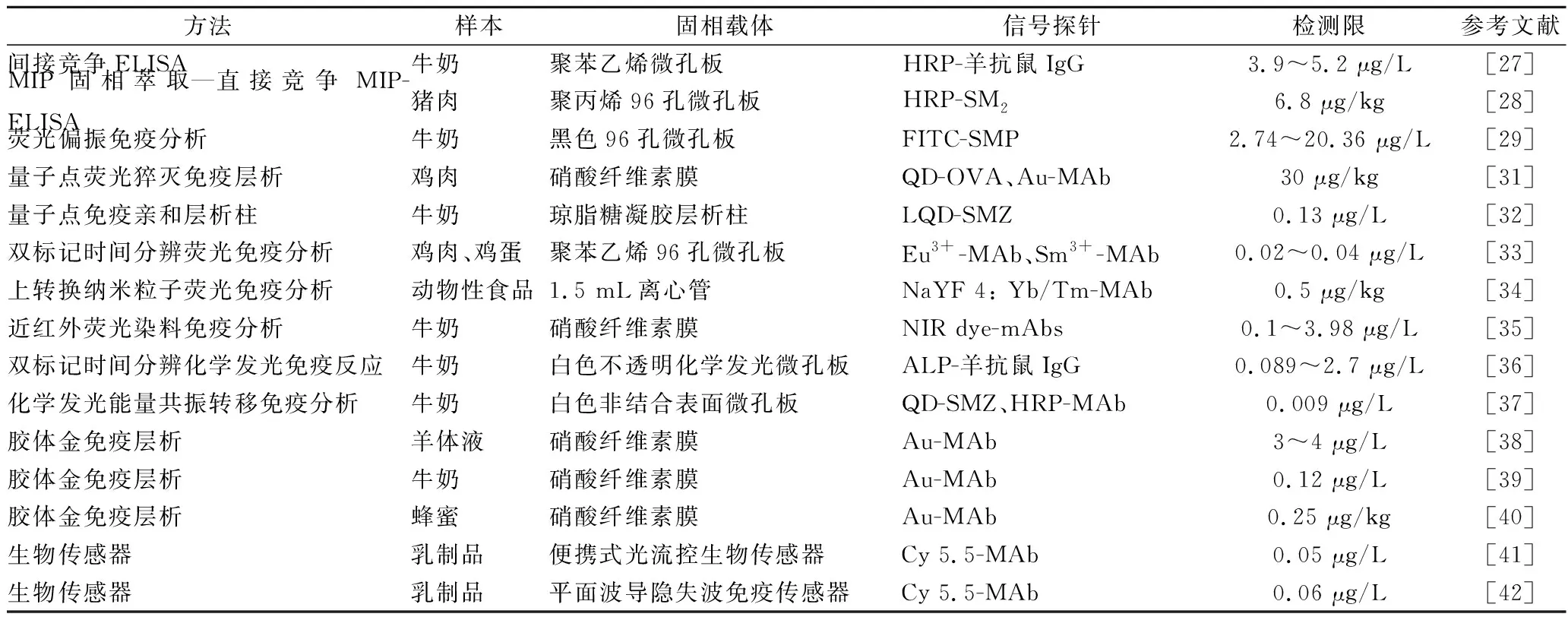
表1 动物性食品中磺胺类药物的免疫分析方法Table 1 Immunoassays for sulfonamides in edible animal foods
3.1 酶联免疫吸附测定(enzyme-linked immunosorbent assay, ELISA)
酶联免疫吸附测定是将酶的高效催化作用和抗原抗体免疫反应相结合,用特定的酶(辣根过氧化物酶或碱性磷酸酶)标记抗原或抗体,根据酶催化底物的显色程度,对待测物进行定性或定量测定[26]。LIANG等[27]优化了ELISA检测SAs多残的各种参数,包括单克隆抗体性能、分析模型、免疫试剂和理化参数(pH、盐浓度、洗涤液和溶剂)。优化后,使用单抗4D11和包被原BS-BSA,在间接竞争ELISA模型下,可同时检测22种SAs,其IC50低于100 μg/L(0.20~88.11 μg/L)。同时,使用优化后的条件检测牛奶中的5种SAs,回收率和变异系数(coefficient of variation, CV)分别为89.0~104.6%、11.9~19.1%。
随着新型抗体的发展,新材料与传统方法的结合使磺胺类药物的检测更加灵敏、高效。PENG 等[28]以SM2为模版分子,使用沉淀聚合法合成了分子印迹聚合物,并以此建立了新型ELISA,采用直接竞争模型,测得标曲线性范围为100~3 200 μg/L,回归系数为0.999,线性关系良好;然后结合分子印迹固相萃取,测定了猪肉中的SM2,其检测限(limit of detection, LOD)和定量限(limit of quantification, LOQ)分别为6.8、20.4 μg/kg。这是首次将MIP-ELISA和分子印迹固相萃取联用来测定真实样本中痕量磺胺药物,具有创新意义。
ELISA从单组份检测发展到多组分检测,具有特异性好、灵敏度高、所需设备少和适合批量检测等优点;但ELISA属于非均相反应,难以实现完全自动化,且检测时间较长。
3.2 荧光免疫分析法(fluorescent immunoassay, FIA)
3.2.1 荧光偏振免疫分析(fluorescence polarization immunoassay, FPIA)
荧光偏振免疫分析结合荧光偏振和免疫竞争,通过检测荧光标记抗原在结合特异性抗体前后的荧光值变化,来定量小分子物质。CHEN等[29]建立了基于重组双特异性单链抗体的荧光偏振免疫分析法,分别以诺氟沙星和SMX为标准,使用不同的有机荧光染料标记异源半抗原作为荧光信号探针与标准品竞争抗体结合位点,同时检测牛奶中的19种FQs和13种SAs,可在最大残留限量水平进行准确有效的检测,检测时间在15 min内。虽然该方法灵敏度低于ELISA,但其创新地在均相反应中使用了双特异性单链抗体,可实现自动化高通量筛选,且操作简便。
3.2.2 量子点免疫分析(quantum dots immunoassay, QDIA)
量子点又称半导体纳米粒子,是零维纳米材料,其尺寸介于1~10 nm。量子点是一种优秀的荧光材料,它具备传统有机染料没有的特性:通过改变量子点的尺寸和组成可实现对量子点发射光谱的调控,从而得到各种颜色的量子点;其激发光谱宽,有利于同步检测;大的斯托克斯位移(Stokes)和窄且对称的发射光谱,可有效避免光谱重叠,从而达到区分不同标记物的目的;具有良好的光稳定性和较长的寿命[30]。自从1998年,Alivisatos和Nie等解决了量子点的生物相容性问题,它已被广泛用于各种与人们息息相关的物质分析检测中。HU等[31]建立了量子点荧光猝灭免疫层析法,同时测定鸡肉中的SAs和FQs残留。将量子点偶联OVA,与包被原混合后包被在硝酸纤维素(nitrocellulose, NC)膜上作为T线,量子点受到激发产生荧光信号,未被待测物竞争结合的金标抗体层析至T线后,与抗原结合,由于量子点和胶体金之间的荧光共振能量转移作用,胶体金吸收了量子点发出的荧光,达到荧光猝灭的效果。该方法采用“点亮”模式,待测物的浓度和荧光强度呈正比,相较于“熄灭”模式,提高了方法的灵敏度。在标准缓冲液中,磺胺喹恶啉(sulfaquinoxaline, SQX)的视觉LOD为3 μg/L;在鸡肉中,SQX的视觉LOD为30 μg/kg。反应时间在10 min内,方便快速,可操作性强。
JIANG等[32]使用脂质体包被量子点标记抗原,在琼脂糖凝胶层中进行免疫亲和层析。可在短时间内对牛奶中的SAs和喹诺酮类药物(quinolones, QNs)进行定性和定量。SAs的定性检测限为1 ng/mL,再使用数码相机拍摄显色照片,通过软件将光强度转化为相对光密度值,可定量待测物含量,同时降低检测限至0.13 μg/L。在牛奶中添加回收率为89%~96%,CV低于11.7%。该方法灵敏度高,但定量方式繁琐,个体操作差异性大,难以实现自动化。
3.2.3 时间分辨荧光免疫分析(time-resolved fluoroimmunoassay, TRFIA)
时间分辨荧光免疫分析采用镧系稀土元素如铕(Eu3+)螯合物标记抗原或抗体,螯合物经激发后可发射特征性的荧光,通过时间延迟和波长分辨进行检测,使强特异性荧光和背景干扰荧光区分开,有效地排除了干扰问题,提高了分析方法的灵敏度。LE等[33]使用镧系螯合物Eu3+和Sm3+分别标记两种特异性抗体,建立了双标记时间分辨荧光免疫分析法测定鸡肉和鸡蛋中的SM2和SQX。该方法检测限分别为0.02(SM2)、0.04(SQX) μg/L,标准曲线动态范围为0.01~100 μg/L,且相关性良好。真实样本添加回收率为74.1~107.6%,CV小于12%。镧系元素螯合物具有激发光波长范围宽,发射光波长范围窄,Stokes位移大,荧光衰变时间长,动态测定范围宽,试剂稳定等优点。
3.2.4 上转换纳米粒子荧光免疫分析(upconversion nanoparticles fluoroimmunoassay, UNFIA)
上转换纳米粒子是一种在近红外光激发下能发出可见光的发光材料,它能利用长波长(较低能量)光子激发得到短波长(较高能量)光子的现象,其实质是反Stokes发光。HU等[34]将 NaYF 4: Yb/Tm 上转换纳米粒子标记抗体结合物作为荧光信号探针,单分散磁性聚苯乙烯微球标记抗原结合物作为免疫信号捕获探针,用于测定动物性食品中的SQX。标准缓冲液中SQX的LOD为0.1 μg/L,样本中为0.5 μg/L。标曲线性范围为0.1~100 μg/L。样本中添加回收率为69.8%~133%,变异为0.24%~25.06%。该方法前处理简单,特别是对于牛奶样本,不需要有机试剂提取,直接稀释即可进行测定,极大地方便了现场、大批量检测。
3.2.5 近红外荧光染料免疫分析(near-infrared fluoroimmunoassay, NIFIA)
与普通多条带侧流免疫层析类似,CHEN等[35]使用近红外荧光染料标记抗体,同时测定牛奶中的四类抗微生物药物残留,分别为β-内酰胺类、四环素类、喹诺酮类和磺胺类药物。磺胺类药物的定性消线值为8 μg/mL,定量线性范围为0.1~3.98 μg/mL,添加回收93.7%~108.2%,CV低于16.3%,比较可靠。
3.3 化学发光免疫反应(chemiluminescence immunoassay, CLIA)
化学发光免疫反应是将化学发光和免疫反应相结合,用化学发光试剂标记抗体或抗原,反应形成抗原-抗体复合物后,在催化剂或氧化剂作用下产生化学发光,通过仪器检测发光强度可对抗原或抗体进行定性或定量检测。TAO等[36]建立了双标记时间分辨化学发光免疫分析法。双标记分别为碱性磷酸酶标记和辣根过氧化物酶标记,利用两种酶的化学发光反应动力学差异,在不同时间点测定结合物的吸光度,可同时测定牛奶中的氟喹诺酮类、β-内酰胺类、磺胺类和氯霉素药物。该方法在一个微孔中整合了四种抗体,分别为碱性磷酸酶标记单链抗体、重组青霉素结合蛋白、单克隆抗体和多克隆抗体,达到了高通量检测小分子污染物的目的。其中磺胺类药物检测限为0.089(磺胺二甲氧嘧啶)~2.7 μg/L(磺胺嘧啶)。
MA等[37]在量子点表面连接磺胺类半抗原,将其半抗原功能化,通过化学发光共振能量转移免疫分析法,在竞争模型下,测定了牛奶中的SM2,检测限为9 pg/mL,分析范围为0.01~50 μg/mL,回收为64.7%~110.7%,CV小于10.6%,反应时间为10 min内。这是一种快速、简单、灵敏、可靠的化学污染物检测方法。
3.4 胶体金免疫层析(colloidal gold immunochromatography, CGIC)
胶体金免疫层析法是以胶体金标记技术为基础,使用金纳米颗粒标记抗体作为示踪物,结合抗原抗体的免疫反应检测样本中的痕量待测物。HAN等[38]使用胶体金作为抗体标记物,建立了多条带免疫层析法,通过比色,在10 min后快速半定量羊体液(血液、尿液、羊奶)中的β-激动剂、磺胺类药物、四环素类药物。其中磺胺嘧啶的比色阈值为3~4 μg/mL,加标样品的添加回收为78.4%~112.6%,相对标准偏差低于11.2%,且试纸条测试结果与仪器确证结果一致。该方法前处理简单,使用方便,快速可靠且成本较低。
WANG等[39]分别使用胶体金和多色乳胶微球作为抗体标记物,采用竞争结合模型,可同时检测牛奶中的12种磺胺类药物、18种喹诺酮类药物和6种四环素类药物。胶体金免疫层析法中,磺胺类药物LOD为0.12 μg/mL,IC50为0.42 μg/mL,检测范围为0.19~0.92 μg/mL。该方法优点:灵敏度高,抗体消耗量小,便于携带,方便现场、高通量检测。
CHEN等[40]通过杂交瘤技术,制备了可识别26种磺胺类药物的族特异性单克隆抗体,其IC50最低可达0.08 μg/mL,将该抗体与金纳米粒子偶联,建立胶体金免疫层析法定性检测蜂蜜中磺胺类药物,视觉LOD为0.25 μg/kg。
胶体金免疫层析法操作方便,适合现场检测,成本较低,灵敏度较高,检测时间较短,一般在5~10 min,适合高通量快速检测。且以上方法初步实现了定量检测,但线性范围较窄,体系不够稳定。
3.5 生物传感器(biosensor)
生物传感器是利用酶、免疫制剂、组织、细胞器或全细胞等生物识别元件的特异性生化反应,借助电、热、光等信号对化学物质进行检测的一类装置。HAO等[41]建立了基于微流控光学的生物传感器,用于准确定量乳制品中的SM2。该生物传感器结合了隐失波免疫传感器和微流控技术,同时,在多模光纤探针上连接了SM2-BSA抗原,在抗体表面标记了Cy 5.5荧光染料,基于间接竞争免疫分析模式,超灵敏、准确地测定牛奶及其他乳制品中的SM2,检测限达0.05 μg/L,线性范围为0.17~10.73 μg/L,牛奶和其他乳制品中的添加回收率为97%~116%,检测时间在15 min以内。探针洗涤后可重复使用300次以上。
LIU等[42]将SM2-BSA抗原固定在光学传感器芯片上,和待测物SM2进行间接竞争免疫反应,在隐失波的激发下,结合在传感器芯片上的标记抗体发出荧光,后经锁定放大器被光电检测器检测,其荧光强度可确定乳制品中的SM2含量。在优化条件下,其检测限可达0.06 μg/L,线性范围0.19~10.10 μg/L,添加回收率80%~107%。
与传统方法相比,生物传感器的高度集成化和微型化使其具有响应快、操作简便、便于携带以及可现场检测等优点,同时灵敏度高,选择性好。它作为一种多学科交叉的新技术,正在食品安全检测中发展为一种强有力的分析工具。
4 展望
兽药滥用现象的普遍存在,使得人们对食品安全忧心忡忡,国内外对兽药残留的监管力度也逐渐加强。免疫分析方法作为一种方便快速、高效灵敏且低成本的分析方法得到飞速发展,商业化ELISA试剂盒、胶体金试纸条应用广泛。SAs残留检测的向简化操作步骤,缩短检测时间,同时提高检测灵敏度、准确度,并实现多残留检测方向发展。
在实际应用中抗体依然是最有效的识别材料,目前制备出的SAs广谱特异性抗体可识别20~30种磺胺药物。同时,新型抗体如基因工程抗体、核酸适配体、分子印记聚合物和受体等逐渐应用于SAs检测,具有稳定性高、亲和力高、易于体外进化、保存方便等优势。其中,单域抗体(纳米抗体)和受体蛋白是重要的发展方向。此外,荧光微球、量子点、镧系元素、上转换纳米粒子等新型荧光探针用于抗原或抗体标记,大大提高了检测的灵敏度和线性范围。侧流免疫层析和生物传感器都有能在短时间内准确定量药物残留的潜力,且可操作性强、高效便携,在SAs多残留检测中有很好的应用前景。
相信在材料、免疫分析模式的不断优化革新下,动物性食品中SAs残留快速检测将得到高速发展。
