基于基因测序技术对辣椒酱生产设备和空气中的细菌检测
2018-11-14徐廷弼钮成拓王琪刘春凤李永仙郑飞云王金晶李崎
徐廷弼,钮成拓,王琪,刘春凤,李永仙,郑飞云,王金晶,李崎
(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122)
辣椒酱是我国传统食品,具有营养丰富、色泽鲜艳、增进食欲等特点,深受消费者喜爱[1]。辣椒酱在生产存储过程中易出现染菌现象,从而导致产品酸败、变色、胀气等现象。辣椒酱中含有的细菌包括乳杆菌属(Lactobacillus)和芽孢杆菌属(Bacillus),在辣椒酱热炒制过程中可以杀死辣椒酱中的绝大部分微生物,但依旧存在部分芽孢杆菌属细菌通过形成芽孢的方式留在辣椒酱中导致辣椒酱腐败[2]。
传统微生物鉴定方法主要通过形态观察、革兰氏染色及生化反应等手段,利用伯杰氏手册等材料进行比对分析[3]。其操作简便、效果直观,但存在精度低、不适用于大批量的菌群分析鉴定等缺点。随着现代生物技术的发展和测序技术成本的降低,现代分子生物学技术,如变形梯度凝胶电泳[4]、宏基因组测序[5]、扩增子测序[6]和16S rDNA测序[7]等手段,极大推动了微生物鉴定领域的发展。16S rDNA存在于所有细菌染色体内,编码16S rRNA对应DNA序列,具有种类少、含量高且高度保守的特性。因此,采用细菌16S rDNA测序技术对样品中的细菌进行系统鉴定的应用具有高通量、可实现不可培养细菌的准确鉴定等一系列优势。
辣椒酱的生产主要可以分为3个工段,第一阶段是将鲜辣椒切碎后与食盐混合,并将混合物置于腌渍池内,使用循环水喷淋的方式使食盐与辣椒充分混合。将混合后的腌渍辣椒用食盐覆盖表层静置3个月后,在第二阶段中将腌渍后辣椒与香料混合后于炒锅内于102 ℃炒制10~14 min,在最后一阶段将炒制后辣椒酱注入冷却塔内,利用盘管冷却后进行包装。辣椒酱成品的盐度在125~150 g/L,然而依旧可能发生微生物污染事件。前期研究发现辣椒酱污染微生物主要为细菌[2],然而污染微生物是如何进入辣椒酱中的途径仍然未知。本文针对某知名辣椒酱食品厂的工艺流程,在辣椒酱原料仓库、炒制间和包装间3个工段分别取样,并采用传统微生物培养方法结合16S rDNA测序对辣椒酱生产阶段设备和空气中存在的细菌情况进行分析,阐述辣椒酱不同生产工段的主要微生物,从而为辣椒酱品质把控和安全生产提供依据。
1 材料与方法
1.1 材料与试剂
酵母粉、胰蛋白胨:分析纯,英国OXOID公司;牛肉膏、K2HPO4、柠檬酸氢二胺、乙酸钠、葡萄糖、吐温80、MgSO4、MnSO4、琼脂粉:分析纯,国药集团化学试剂有限公司;细菌基因组DNA提取试剂盒,北京TIANGEN公司;琼脂糖、DNA Marker,上海Sangon Biotech公司;rTaq、引物,大连TaKaRa公司。
细菌培养采用MRS和LB两种培养基。MRS培养基配方(g/L):蛋白胨10、牛肉膏10、酵母粉5、K2HPO42、柠檬酸氢二胺2、乙酸钠5、葡萄糖2、吐温80 1、MgSO40.28 、MnSO40.14、琼脂粉15,pH自然,115 ℃湿热灭菌15 min;LB培养基配方(g/L):蛋白胨10、酵母粉5、NaCl 10,pH自然,121 ℃湿热灭菌15 min。由于辣椒酱为高盐环境,因此在MRS和LB培养基中需要加入与辣椒酱中相同盐浓度的NaCl。
1.2 仪器与设备
ThermoStat plus金属浴,德国eppendorf公司;自动控温空气摇床,上海福玛实验设备有限公司; TGL-16G台式离心机,上海安亭科学仪器厂;DYY-8C型电泳仪,北京市六一仪器厂;HVE-50全自动高压蒸汽灭菌锅,日本HIRAYAMA株式会社; MICROL17台式高速离心机,美国Thermo Fisher公司; GelDoc-ItTM凝胶成像系统,美国UVP公司;TC5000 PCR仪,英国TECHNE公司。
1.3 方法
1.3.1 空气及设备取样
本实验采用高盐MRS和LB琼脂培养皿,取样方法参考GB/T 18204.1—2000《公共场所空气微生物检验方法-细菌总数测定》自然沉降法。具体方法为:将培养皿置于生产车间及仓库的4角和中央共5处,其中4角相距墙面1 m,距离地面高度1 m。将培养皿打开于空气中暴露30 min, 采用无菌袋封装后分别于37 ℃有氧和无氧环境中培养48 h。取样地点为:原料仓库、炒制间和包装间。
设备取样使用无菌镊子,于各生产设备内壁刮取适量内容物于无菌三角瓶内。经无菌生理盐水稀释后涂布于高盐MRS和LB琼脂培养皿,分别于37 ℃有氧和无氧环境下培养96 h。根据稀释量与涂布量计算每克内容物内的细菌菌群数。
1.3.2 菌落计数及空气中菌群密度的换算
以肉眼方式数出培养皿中的菌落数目。空气菌群密度由奥梅梁斯基公式换算,并将单位转为CFU/m3。根据该公式,在100 cm2表面积的培养皿上5 min内沉降的菌群总数等同于10 L空气内的菌群总数[8],具体公式如式(1)所示:
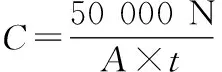
(1)
式中:C,空气内菌群总数,CFU/m3;N,培养皿内菌落数,CFU/皿;A,培养皿表面积,cm2;t,培养皿与空气接触时间,min。
1.3.3 细菌基因组DNA提取
采用TIANGEN细菌基因组DNA提取试剂盒提取样品总基因组DNA,具体操作方法参考试剂盒说明书。目标产物于Nanodrop微量分光光度计检测浓度后于-20 ℃保存备用。
1.3.4 PCR反应
16S rDNA采用50 μL PCR扩增体系,具体组分为:rTaq25 μL;引物27F(AGAGTTTGATCCTGGCTCAG)和1541R( AAGGAGGTGATCCAG CCGCA)各2 μL;模板10 μL;双蒸水11 μL。PCR反应程序如下:94 ℃预变性3 min,94 ℃变性40 s,56 ℃退火35 s,72 ℃延伸80 s,循环30次,70 ℃延伸10 min,4 ℃保存。
1.3.5 16S rDNA测序
将PCR产物委托上海生工生物工程有限公司测序。该公司测序采用Illumina技术,该技术为边合成边测序。在测序时以单链DNA为模板,合成互补链时采用的dNTP带有荧光标记,不同碱基荧光信息经成像系统采集整合后得出目的片段的碱基序列[9]。后续数据的处理方法如下:将reads中的接头序列和barcode序列滤掉;用flash软件将存在overlap的reads对加以拼接;利用QIIME软件对于拼接的数据加以过滤,过滤掉含N较多或者含低质量碱基较多的序列;过滤掉拼接序列内的嵌合体序列[10]。最后将拼接后的结果与美国国立生物技术信息中心(NCBI Blast)进行比对。取最相似结果,鉴定出该序列所对应的菌株[11]。
1.3.6 细菌的产气鉴定
将取样所得单菌落用接种环挑至放置了杜氏小管的厌氧管内,以高盐MRS和LB培养基分别于37 ℃下好氧或厌氧培养96 h,观察产气情况,具体方法参考文献[12]。
2 结果与分析
2.1 辣椒酱生产工段细菌菌群计数
2.1.1 空气中细菌菌群计数
本研究采用MRS和LB两种培养基对厌氧菌和好氧菌进行培养,原因基于本实验室先前针对同一食品厂中豆瓣酱菌群分析的研究,发现在改良TJA培养基、MRS培养基、M17培养基、营养肉汤培养基、LB培养基和RCM培养基中,LB培养基针对好氧菌,MRS培养基针对厌氧菌有较好的分离结果[13]。
针对辣椒酱生产过程空气中的细菌菌群情况,本研究对原料仓库、炒制间和包装间的空气进行了取样并对其微生物总数进行计数。如图1所示,辣椒酱原料仓库、炒制间和包装间空气中的好氧菌菌群密度分别为3.0×102、1.3×104、8.2×102CFU/m3,而厌氧菌菌群密度分别为1.4×103、3.4×103、7.0×101CFU/m3。
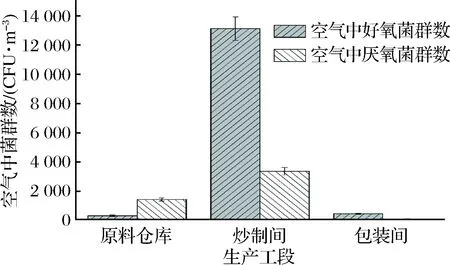
图1 辣椒酱生产工段空气中好氧菌和厌氧菌菌群数Fig.1 Number of aerobic and anaerobic bacteria in theair in each working procedures
空气内的菌群数受到地点、温度、湿度等众多因素影响,通常而言室内菌群数较室外高[14]。本研究中,空气中好氧菌浓度除原料仓库外,均高于厌氧菌菌浓度。根据实际情况,推测辣椒酱生产过程中好氧菌主要源自空气流通等各种方式,厌氧菌的主要来源为辣椒酱。原料仓库中厌氧菌菌浓高源自于该工段的生产模式,盐渍辣椒采用50 kg塑料包装由供应商处运至原料仓库,通过人工卸货方式注入暂储池,全程为开放式操作,在注入时厌氧菌由此进入空气。包装间厌氧菌、好氧菌菌群数低则是由于包装线的密封性,且各环节均采用了包括紫外照射,定期消毒等方式进行消毒杀菌,因此厌氧菌浓度很低。炒制间细菌菌浓显著增高,原因在于该生产工序采用炒锅对辣椒酱进行炒制,炒制过程中产生高温、高湿,其室内平均温度可达42.1 ℃,远高于其他工段(21.3 ℃);相对湿度可达98%,远高于原料仓库(65%)和包装间(61%),且墙壁有肉眼可见的冷凝水析出,因此该高温、高湿环境有利于细菌大量增殖。与此同时,该环境长期用于生产辣椒酱,可视为一种选择性培养基,对于特定细菌具有富集作用。
2.1.2 设备中细菌菌群计数
本文进一步对辣椒酱3个生产工段设备上的细菌菌群进行取样和分析。由图2可知,原料仓库、炒制间和包装间设备中的好氧细菌菌群密度分别为1.4×105、7.6×105、3.6×107CFU/g,而厌氧细菌菌群密度分别为2.1×105、8.7×105、7.4×107CFU/g。包装间与原料车间设备中厌氧菌含量显著高于好氧菌,其原因在于:炒制时搅拌浆带入大量空气,使得辣椒酱内溶氧量上升,而溶氧量的上升会导致后续包装段好氧菌的大量增殖,而原料和包装工段均处于厌氧环境,因此厌氧菌数量高于好氧菌。此外,辣椒酱冷却时在一段较长时间内会维持在30~60 ℃,会促使芽孢杆菌芽孢萌发,从而使包装线内厌氧菌的大量增殖[15]。此解释与包装线内厌氧菌中芽孢菌含量高的现象相符。表皮葡萄球菌(Staphylococcusepidermidis)和多粘芽孢杆菌(Paenibacilluspolymyxa)2种芽孢杆菌即占总菌群比重64.54%。综上,对于微生物的控制重点在于炒制后到灌装这一阶段,此阶段内微生物大量增殖,使其菌种的数量和种类均有大幅度提升。
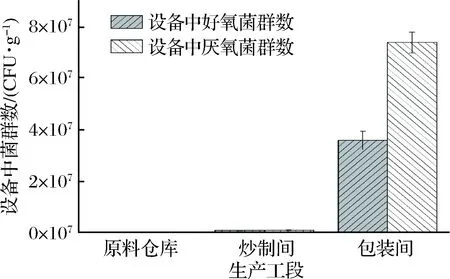
图2 各生产工段内设备中好氧菌、厌氧菌群数Fig.2 The number of aerobic bacteria and anaerobes inthe equipments in each working procedures
2.2 基于16S rDNA测序的辣椒酱生产工段细菌菌群分析
2.2.1 不同工段空气中细菌菌群组成
为了进一步分析辣椒酱生产过程中微生物的组成情况,本研究进一步利用16S rDNA测序技术对辣椒酱3个生产阶段空气和设备中的细菌组成进行了分析。如图3所示,本研究从辣椒酱生产工段空气中共检出6种好氧菌和16种厌氧菌。在好氧菌中,3种为芽孢杆菌,1种为葡萄球菌,2种为考克氏菌。巨大芽孢杆菌(B.megaterium)和短小芽孢杆菌(B.pumilus)在3个工段均有检出,而枯草芽孢杆菌(B.subtilis)仅在原料仓库内检出;2株考克氏菌(Kocuriasedimini,K.palastris)存在于原料仓库和炒制间,而人类葡萄球菌(S.hominis)在包装仓库及包装间检出。在该6种好氧菌中,除考克氏菌外其余5种均可产芽孢[16]。3个工段的好氧菌中芽孢菌占比分别为52.31%、80.23%、100%,这表明在辣椒酱生产过程中芽孢菌具有相对较强的生命力。与此同时,本研究从辣椒酱生产工段空气中筛选得到16种厌氧菌。从图3-B可以看出,维氏链球菌(Straphylococcuswarneri)、头链球菌(S.capitis)、人类链球菌(S.hominis)、木糖溶纤维素梭菌(C.xylanolyticum)和多粘芽孢杆菌(P.polymyxa)在辣椒酱所有生产工段均能检出。在原料阶段检出的7种细菌菌株尽管其中部分菌株在炒制工段未检出,但在包装线均有检出,其中产芽孢菌占比57%。原料辣椒经过炒制后,木糖溶纤维素梭菌(C.xylanolyticum)和德氏肠球菌(Enterococcusdevriesei)所占比例分别下降89.3%、72%,而表皮葡萄球菌(S.epidermidi)和阴沟肠杆菌(Enterobactercloacae)所占比例,上升113%、95%。在炒制辣椒中共新检出2种菌:催产克雷伯氏杆菌(Klebsiellaoxytoca)和维氏肠球菌(E.vikkiensis)。3个工段的厌氧菌中芽孢菌占比分别为28.69%、80.23%、65.00%。辣椒酱各阶段样品细菌菌群中芽孢杆菌比例高,经过加热后芽孢杆菌比重明显上升,说明炒制灭菌可以杀灭细菌营养体而对芽孢效果较差。灭菌后非产芽孢菌的减少减轻了对产芽孢菌的竞争抑制,从而有利于产芽孢菌的生长[17]。
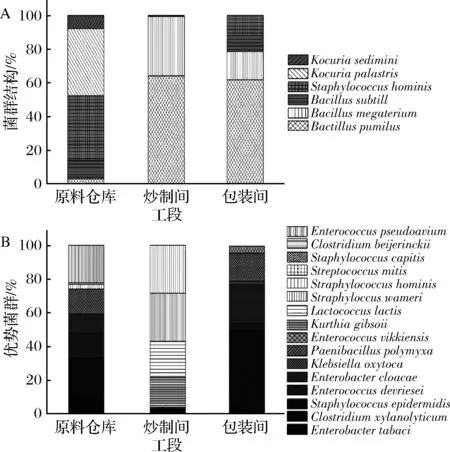
图3 不同工段空气中好氧菌群(A)、厌氧菌群(B)组成Fig.3 The aerobic bacteria (A) and anaerobe (B) in theair of different sections
在分离到的厌氧菌中,头葡萄球菌(S.capitis)[18]、阴沟肠杆菌(E.cloacae)[19]、克雷伯氏杆菌(K.oxytoca)[20]、维氏肠球菌(E.vikkiensis)[21]、轻型链球菌(Streptococcusmitis)[22]均为条件致病菌。其中头葡萄球菌(S.capitis),阴沟肠杆菌(E.cloacae)和轻型链球菌(S.mitis)为革兰氏阳性菌,可以考虑在炒制后加入乳酸链球菌素(nisin)进行特异性抑制。乳酸链球菌素会导致革兰氏阳性菌细胞膜破裂,导致ATP等物质外泄并导致细胞溶解,同时对于孢子也有良好杀灭作用[23]。
2.2.2 不同工段设备中细菌菌群组成
本研究通过16S rDNA技术对于设备内分离到的好氧菌和厌氧菌进行了鉴定。如图4-A所示,本工段共检出好氧菌3种,分别为短小芽孢杆菌(B.pumilus)、巨大芽孢杆菌(B.megaterium)、地衣芽孢杆菌(B.subtilis),其中地衣芽胞杆菌为兼性厌氧菌,因此在好氧和厌氧环境下均有检出。如图4-B所示。共检出6种厌氧菌,其中芽孢菌2种,为木质纤维素梭菌(Clostridiumxylanolyticum)和多黏芽孢杆菌(P.polymyxa),其余为非芽孢菌。其中木质纤维素梭菌(C.xylanolyticum)、克雷伯氏菌(K.oxytoca)和多黏芽孢杆菌(P.polymyxa)在所有工段均有检出。辣椒原料经过炒制后,多黏芽孢杆菌(P.polymyxa)从占比13%增加至65%,并在成品中一直维持较高水平(57%);木质纤维素梭菌(C.xylanolyticum)由开始的32%下降至11%。值得注意的是,在6种厌氧菌中,存在维氏肠球菌(E.vikkiensis)、德氏肠球菌(E.devriesei)、阴沟肠杆菌(E.cloacae)、克雷伯氏菌(k.oxytoca)4种条件致病菌,而多粘芽孢杆菌(P.polymyxa)可以产细菌素,对于细菌和真菌具有抑制作用[24]。

图4 不同工段设备中好氧菌群(A)、厌氧菌群(B)组成Fig.4 The aerobic bacteria (A) and anaerobe (B) in theequipments of different sections
2.3 各工段设备内厌氧菌产气状况
将各工段取样获得的单菌落于放置了杜氏小管的高盐MRS液体培养基内进行纯培养96 h,根据杜氏小管内气体充盈情况判定各厌氧菌的产气能力。产气菌及其产气能力见表1所示。

表1 各工段设备内厌氧菌产气状况Table 1 Aerogens and their gas production in each section
注:“-”未检出产气菌;“+”表示气体接近或达到杜氏小管的1/3;“++”表示气体接近或达到杜氏小管的2/3。
在空气中共检出2株厌氧产气菌,分别为木糖溶纤维素梭菌(C.xylanolyticum)与烟草杆菌(E.tabaci)。原料仓库内2者均有所检出,占比分别为1.12%和0.45%;包装线检出木糖溶纤维素梭菌(C.xylanolyticum),占比1.07%。经过96 h的厌氧培养,木糖溶纤维素梭菌产气1/3杜氏小管,烟草杆菌(E.tabaci)产气2/3杜氏小管。设备中共检出4株产气菌,分别为阴沟肠杆菌(E.cloacae),维氏肠球菌(E.vikkiensis),德氏肠球菌(E.devriesei),枯草芽胞杆菌(B.subtill)。在包装设备总菌群中分别占比:10%、6.7%、7.1%、12.3%。厌氧菌产生气体为葡萄糖经糖酵解途径产生CO2[25]。
3 结论
本文利用16S rDNA测序法,结合传统的培养皿培养法,对辣椒酱生产3个工段的设备和空气中的细菌菌群进行了分离,对其结构进行了鉴定。目的在于详细理解各工段的优势菌群,从而指导实际生产进行生物学防治,减少染菌概率。从鉴定结果来看,空气内检出6种好氧菌,其中芽孢菌3种;16种厌氧菌,其中芽孢菌13种。空气中产气菌3种;设备内检出好氧菌3种,均为芽孢菌;厌氧菌6种,其中芽孢菌2种。设备内产气菌4种。与此同时,还证明了在包装线菌群数目有大幅提升,存在二次染菌的可能。因此应针对以上特点,加强灭菌密度和强度。鉴于分离到的细菌中革兰氏阳性菌占比较高,可以考虑在后期加入nisin进行生物学防制,从而提高抑菌效果。
