动态高压微射流协同糖基化处理对β-乳球蛋白热稳定性和结构的影响
2018-11-14谢雅雯涂宗财张露王振兴杨萍邵艳红沙小梅王辉
谢雅雯,涂宗财,*,张露,王振兴,杨萍,邵艳红,沙小梅,王辉
1(江西师范大学 生命科学学院,功能有机小分子教育部重点实验室,江西 南昌,330022) 2(南昌大学,食品与科学技术国家重点实验室,江西 南昌,330047)
蛋白质作为食品中的重要组成成分,具有较高的营养特性[1]。β-乳球蛋白(β-lactoglobulin,β-Lg)作为乳清蛋白中一种重要的组成部分,约占44%~50%,是一种球形蛋白。它具有结合视黄醇、VE、甾醇类化合物及部分脂肪酸等生理功能,并且拥有极佳的氨基酸比例和丰富的必需氨基酸[2]。但是其变性温度较低则限制了在食品工业中的应用,因此增大β-Lg的热变性温度则尤为迫切和必要。
目前,对食品蛋白进行改性以提高其加工性能或功能活性已成为食品工业领域的研究热点之一,蛋白质常用的改性方法包括多种,例如酶解法,物理方法和化学方法等。近年来,针对于蛋白质改性的研究逐渐增多,特别是非热加工技术(如高压、超声波、脉冲电场、微波、动态高压微射流等)结合糖基化反应的复合方法越来越广泛地应用于蛋白质改性,以提高蛋白质的功能性质。例如OBOROCEANU等[3]发现脉冲电场能有效促进乳清分离蛋白和葡聚糖的羰氨反应,提高乳清分离蛋白的溶解性和乳化特性;BU等[4]研究了温度变化对于β-Lg抗原性的影响,发现当温度变化为50~90 ℃时,其抗原性也逐渐升高,当温度大于90 ℃时,其抗原性显著下降。ZHONG等[5]采用动态高压微射流与糖基化反应对β-Lg进行复合修饰,发现这种复合改性方法能改变β-Lg的空间结构,导致β-Lg的免疫特性发生变化。
动态高压微射流(dynamic high pressure microfluidization,DHPM)是一种特殊形式的超高压均质技术,是以超高压理论、流体力学理论、撞击流理论为基础,集输送、混合、粉碎、加压等多种单元操作于一体的新兴高压加工技术[6]。前期研究发现,DHPM协同半乳糖糖基化改性能有效提升β-Lg的乳化性,降低其致敏性、表面疏水性和内源荧光强度,使其α-螺旋含量升高,β-折叠含量降低[7]。但目前关于DHPM协同多糖糖基化改性β-Lg的研究还少见报道。因此,本实验以多糖(葡聚糖)和β-Lg为研究对象,研究DHPM协同多糖糖基化处理对β-乳球蛋白的热稳定性和结构的影响,同时分析DHPM预处理对β-Lg-葡聚糖糖基化程度的影响,为加工改性β-Lg在食品工业中的应用提供一定理论依据。
1 材料与方法
1.1 材料和仪器
1.1.1 材料和试剂
β-乳球蛋白、葡聚糖,美国Sigma公司;其他所需试剂均为分析纯。
1.1.2 仪器与设备
微射流均质机(M-7125型 Microfluidics型),美国Microfluidics公司;荧光光谱仪(F-7000型),日本日立公司;紫外可见分光光度计(U-2910型),日本日立公司;圆二色谱仪(MOS-450型),法国Bio-Logic SAS公司;酶标分析仪(SynergyH1型),美国Bio Tek公司;DSC差示量热扫描仪(F3-200型),德国耐驰仪器制造有限公司。
1.2 方法
1.2.1 DHPM处理
将β-Lg溶于pH 8.0,0.01 mol/L的PBS溶液中,采用DHPM分别在不同压力下(0、40、80、120 MPa)对β-Lg溶液处理3次,再与葡聚糖按1∶1的质量比混合,冷冻干燥后-20℃储藏备用。最终得到的样品分别表示为β-LgX(代表经DHPM预处理的β-Lg体系,X分别为0、40、80、120 MPa,下同)和β-LgDX(经DHPM预处理的β-Lg葡聚糖体系)。
1.2.2 糖基化反应
称取等量的β-Lg、β-LgDX样品置于装有饱和KI溶液的带盖玻璃样品瓶中,烘箱中55 ℃下干热反应10 h,烘箱中的环境湿度稳定在65%,糖基化反应10 h结束后将离心管置于冰水中终止反应,最后于-20 ℃冰箱内储藏,待测。
1.2.3 热稳定性的测定
采用差示扫描量热仪测量β-Lg糖基化产物的热变性温度[8]。精确称取6.0 mg样品于样品铝盒中,扫描速度为10 ℃/min,扫描温度为30~120 ℃。空盘作参比,得DSC扫描曲线。
1.2.4 游离氨基含量的测定
采用邻苯二甲醛法测定样品中自由氨基的含量[9-10]。取100 μL样品与2 mL OPA试剂(含0.8 g/L OPA、20 g/L SDS、38 g/L硼砂、2 g/L β-巯基乙醇)于试管中混匀,37 ℃温浴反应2 min后于340 nm处测量吸光度,用同体积蒸馏水代替实验对照组。以赖氨酸(0~0.1 mg/mL)为标品绘制标准曲线,计算样品中游离氨基的含量(mg/mL)。
1.2.5 褐变程度的测定
取DHPM协同糖基化处理后的样品溶解成2 mg/mL蛋白溶液浓度,再采用酶标仪测定溶液在294和420 nm处的吸光度[11]。
1.2.6 表面疏水性(H0)的测定
采用ANS荧光探针法测定不同条件处理后的β-Lg表面疏水性的变化。取4 mL 0.1~1 mg/mL蛋白样品与20 μL 8 mmol/L ANS溶液(0.01 mol/L,pH 8.0)混合,然后测定其荧光强度。测定条件:发射光谱波长范围为400~600 nm,激发光谱波长为370 nm,发射和激发的狭缝宽度均为5 nm,扫描速度为1 200 nm/min,电压为400 V。以蛋白质量浓度(mg/mL)为横坐标,荧光强度为纵坐标作图,对曲线采用线性回归分析进行拟合,曲线斜率的计算结果则为蛋白样品的表面疏水性(H0)[12]。
1.2.7 自由巯基含量的测定
采用ELLMAN的试剂分析方法测定不同条件处理后的β-Lg自由巯基含量[13]。将DHPM协同糖基化处理后的样品配成1 mg/mL蛋白溶液,之后取250 μL样品与500 μL 0.01 mol/L的DTNB混匀(0.1 mol/L,pH 8.0磷酸盐缓冲液配制),37 ℃反应20 min后于412 nm处测吸光值。自由巯基的计算见公式(1):
(1)
式中:A412,412 nm处的吸光度;D,稀释倍数;C,样品质量浓度(mg/mL)。
1.2.8 圆二色谱(circular dichroism,CD)分析
根据CHEN等[14]的方法对不同条件处理后的β-Lg和β-LgD体系进行CD分析。将冻干后的样品用蒸馏水配制成0.1 mg/mL,然后采用光路长为0.1 cm的圆形石英比色皿进行远紫外CD分析。扫描范围为190~250 nm,扫描速率为100 nm/min,谱带宽度为1.0 nm,环境温度为22 ℃,每个样品测3次,测量值以椭圆率([θ], degree·cm2/dmol)表示,具体的二级结构含量使用在线分析软件(DichroWeb)分析,网址为:http://dichroweb.cryst.bbk.ac.uk/html/process.shtml。
1.2.9 内源荧光强度的测定
用F-7000型荧光光谱仪测定各个条件处理下β-Lg荧光强度的变化。参照LUCIA等[15]的方法,测定条件:发射光谱波长范围为300~450 nm,激发光谱波长为280 nm,发射和激发的狭缝宽度均为5 nm,扫描速度为1 200 nm/min,电压为400 V。
1.3 数据处理
所有实验均重复3次,结果用平均值±标准偏差表示,所得实验数据采用SPSS 22.0软件进行显著性分析(p<0.05),采用Origin 9.0软件作图。
2 结果与分析
2.1 热稳定性分析
差示扫描量热法是在程序自动的升温、恒温或降温阶段下,测定样品和参照物之间温度与热量差的关系,对于物质热变性的研究已经较为广泛[16]。常用测量曲线中峰顶的温度作为样品变性温度,变性温度越大热稳定性越大,变性温度越小说明其热稳定性越小。由图1-A可知,经DHPM预处理后,样品的峰形发生较大的变化,热峰的高度先是降低,随着处理压力的进一步增大,β-Lg的热峰高度也慢慢回升,压力越大,峰形也越大;β-Lg的热变性温度也随处理压力的增大呈先降低后升高的趋势,由天然β-Lg的73.48 ℃先降至66.66 ℃后升高至78.96 ℃,这与DHPM对乳清蛋白[17]和花生蛋白[18]的影响趋势较为相似。以上结果说明了,40 MPa的动态高压微射流技术降低了β-Lg的热稳定性,同时也降低了变性所需要的能量,而随着压力增大,其热稳定性又逐渐升高,变性所需要的能量也逐渐增大。因此,DHPM处理后的β-Lg处于一个更不稳定的状态,可能是因为有部分相互作用力遭到破坏,β-Lg分子发生了部分变性。
通过比较图1-A和图1-B可知,糖基化后β-Lg的热稳定性明显提升,β-LgD和β-Lg的热变性温度分别为77.28 ℃和73.48 ℃,DHPM 80 MPa预处理的糖基化β-Lg具有最高的变性温度,达82.37 ℃;而β-LgD40和β-LgD120的热变性温度低于80 MPa预处理样品的热变性温度,但仍高于未处理的β-Lg以及DHPM处理下的β-Lg最高(78.96 ℃)的热变性温度,这表明糖基化反应能显著提升β-Lg的热稳定性。CHEVALIER 等[19]报道, β-Lg与不同的糖发生糖基化反应会诱导β-Lg构象发生变化,β-Lg的变性温度升高。CHEN等[20]研究表明β-Lg与还原糖发生糖基化反应后β-Lg的变性温度要高于未发生糖基化反应的β-Lg。这可能是因为一般情况下,一个三维蛋白质的独特结构是由非共价相互作用中的各种吸引力和推斥力以及少数的二硫键所组成,而变性就需要破坏这些相互作用,糖基化后蛋白质的构象发生了变化,变性所需要的相互作用力也就变得更大。
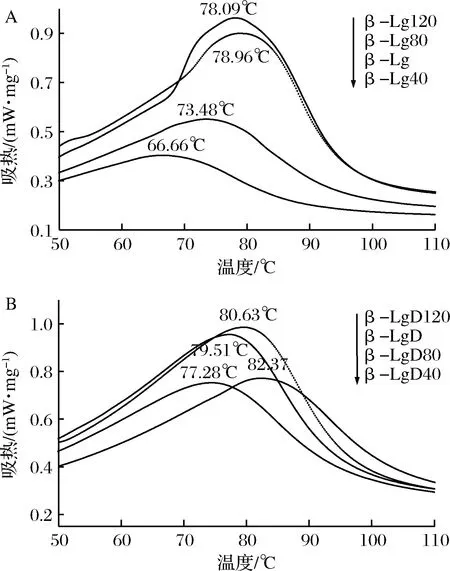
图1 DHPM不同压力预处理对β-Lg(A)和β-Lg-葡聚糖体系(B)热稳定性的影响Fig.1 Effect of DHPM pre-treatment at various pressureson the thermal stability of β-Lg(A) and β-Lg-dextran system(B)
2.2 游离氨基含量分析
糖基化反应是蛋白质的氨基与碳水化合物的羰基通过共价键相互交联形成糖蛋白的化学反应,常用游离氨基含量的变化来表示蛋白质与糖接枝反应的程度。由图2可知,天然β-Lg的游离氨基含量随着DHPM预处理压力的增大呈先减小后增加的趋势,并且在80 MPa时达到最低,为2.55 mg/mL。

图2 DHPM不同压力预处理对β-Lg-葡聚糖体系游离氨基含量的影响Fig.2 Effects of DHPM pre-treatment at various pressureson the content of free amino groups of β-Lg-dextran system
经过DHPM协同糖基化处理后,β-Lg糖基化产物的游离氨基含量明显低于未糖基化的β-Lg,β-LgD的游离氨基含量为为2.69 mg/mL,而β-Lg则为2.89 mg/mL;且其含量随着处理压力的增大呈先下降后升高的趋势,并且在80 MPa时达到最低,为2.29 mg/mL,说明DHPM预处理能够促进β-Lg的糖基化反应。这可能是因为DHPM处理使β-Lg去折叠,同时诱导蛋白质的构象发生变化,使β-Lg的结构达到不同程度的展开,结构变得更为分散,更多的赖氨酸(Lys)残基暴露到分子表面与糖的醛基共价交联,发生羰氨缩合反应[21-23]。当DHPM压力为120 MPa时,游离氨基含量又略有增加,为2.31 mg/mL,可能是因为蛋白质再度发生聚集。
2.3 褐变程度分析
糖基化反应产物的吸光度通常被用来描述糖基化进程,糖基化反应中初级产物的形成量可以用294 nm处的吸光度来评价;而反应的终极产物的形成量则可以用420 nm处的吸光度来评价[24]。DHPM处理和DHPM预处理协同糖基化反应对β-Lg的褐变程度的影响如图3所示。
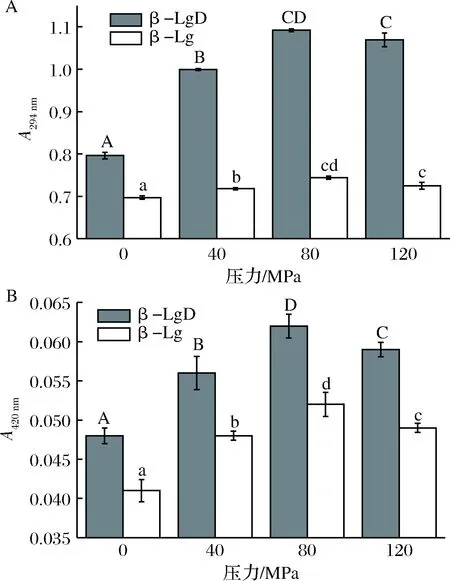
A-294 nm处吸光值;B-420 nm处吸光值图3 DHPM不同压力预处理对β-Lg-葡聚糖体系的褐变程度的影响Fig.3 Effect of DHPM pre-treatment at various pressures onthe browning intensity of β-Lg-dextran system
样品在294 nm处的吸光度与420 nm处的吸光度变化趋势大致相同。DHPM预处理协同糖基化的β-Lg产物在294 nm和420 nm的吸光度明显高于DHPM处理的β-Lg。当DHPM单独进行处理时,β-Lg在294 nm处的吸光值变化较小,在420 nm处的褐变程度变化趋势随着DHPM压力的增大呈先增大后减少趋势,在80 MPa时达到最大。
DHPM协同糖基化处理时,40 MPa预处理结合糖基化的β-Lg的褐变程度与0 MPa时的糖基化产物的褐变程度明显增加,294 nm和420 nm处的吸光值分别由0.80和0.048升高到1.00和0.056;当处理压力为80 MPa时,294 nm和420 nm处的吸光度分别为1.09和0.062,说明80 MPa的DHPM处理能够明显增大β-Lg的糖基化程度;而当处理压力为120 MPa时,两处的吸光值又稍稍降低,低于80 MPa却仍高于40 MPa,分别为1.07和0.059。说明DHPM 80 MPa预处理对β-Lg-葡聚糖糖基化反应有最大的促进作用,因此生成的糖基化产物也最多。所以,DHPM预处理可以促进β-Lg-葡聚糖的糖基化反应,这可能是因为β-Lg经DHPM处理后其结构趋于展开状态[25-26],高压诱导的去折叠态可提高蛋白质的反应活性[27]。
2.4 表面疏水性分析
蛋白质的表面疏水性(H0)作为蛋白质表面与水溶液环境接触的疏水基团的重要参数,在蛋白质三级结构中占有主导地位,对于蛋白质结构的研究非常重要[28]。DHPM预处理结合糖基化反应对β-Lg表面疏水性的影响如图4所示。
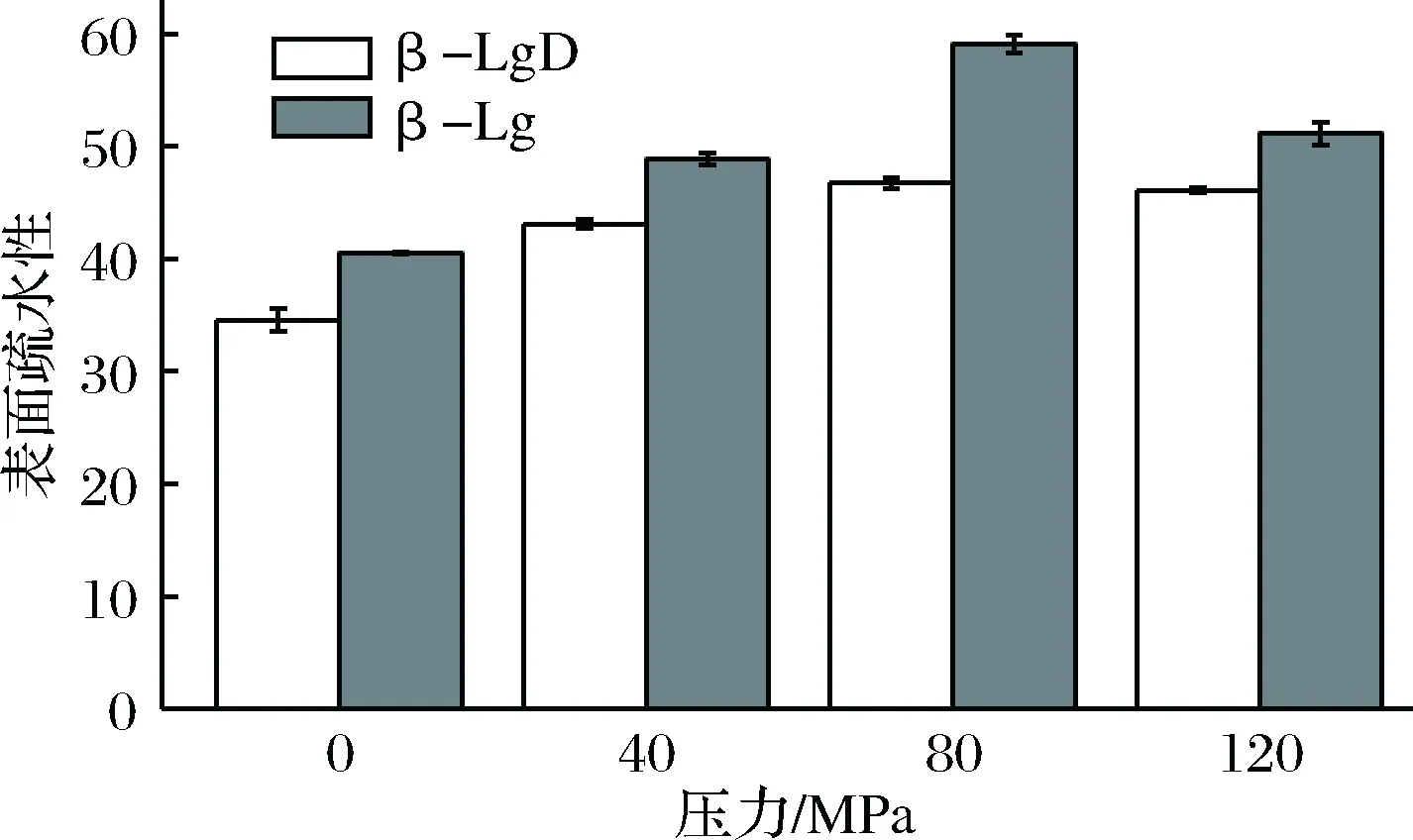
图4 DHPM不同压力对β-Lg-葡聚糖体系表面疏水性的影响Fig.4 Effects of DHPM pre-treatment at various pressureson the surface hydrophobicity in β-Lg-dextran system
由图4可知,随着DHPM处理压力的逐渐增大,β-Lg的表面疏水性明显升高,且在80 MPa处理压力下具有最高的表面疏水性为59.11,原因可能是DHPM处理使β-Lg内部的疏水性区域外翻暴露到分子表面,与疏水性探针ANS结合,使其表面疏水性增加。同时从图4可以看出,未经过糖基化处理的β-Lg明显高于经过糖基化处理后的β-Lg的H0值,说明糖基化反应会改变β-Lg的空间构象,降低其表面疏水性,原因一方面可能是糖基化反应会使分子中外翻的疏水性基团包埋在其内部;另一方面是亲水性的葡聚糖与蛋白质形成共价键导致蛋白质分子表面亲水性基团的增加,从而降低了蛋白质的表面疏水性[29]。
2.5 自由巯基含量分析
巯基基团是蛋白质中很重要的功能性基团,属于维持蛋白质三维结构的弱次级健, 能相互交联形成二硫键来维持蛋白质高级结构的稳定,因此对其功能性质的发挥具有很重要的作用,属于蛋白质中重要的功能性基团。每个β-Lg单体中都含有5个半胱氨酸残基,2个二硫键(Cys 66-Cys 160、Cys 106-Cys 199)和1个自由巯基(Cys 121),其中游离的第121位半胱氨酸是包埋在β-Lg分子内部[30]。图5是不同条件处理对β-Lg自由巯基含量的影响。由图5可知,天然β-Lg的自由巯基含量最低,为39.91 μmol/g,随着DHPM压力的增大,β-Lg中的巯基含量呈先增大后降低的趋势,并在80 MPa时达到最大,为42.06 μmol/g。由此可知,DHPM处理会诱导β-Lg去折叠,导致其巯基含量上升,这与MONAHAN等[31]的研究结果类似。
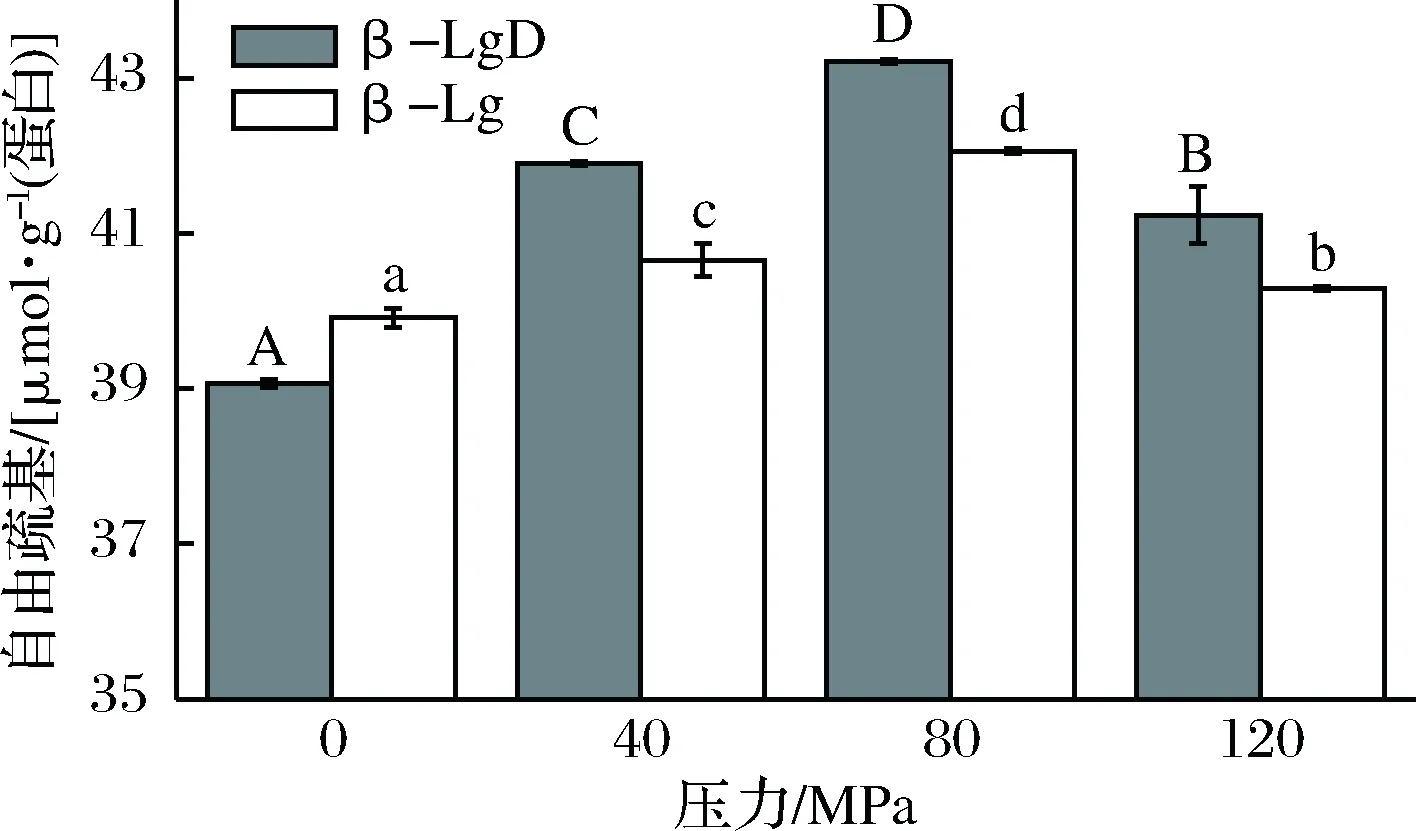
图5 DHPM不同压力对β-Lg-葡聚糖体系自由巯基含量的影响Fig.5 Effects of DHPM pre-treatment at various pressureson the free sulfhydryl groups of β-Lg-dextran system
与天然和DHPM预处理β-Lg相比,DHPM协同葡聚糖糖基化处理能显著增加β-Lg的自由巯基含量。当预处理压力由0 MPa增加到80 MPa时,β-LgD的自由巯基含量由39.07增加到43.22 μmol/g。但预处理压力为120 MPa时,β-LgD体系中的自由巯基含量较80 MPa有所降低,但仍高于0 MPa,为41.23 μmol/g。因此,DHPM 80 MPa预处理样品具有最高的自由巯基含量。以上结果表明,DHPM协同糖基化处理能引起β-Lg蛋白质分子不断“溶胀”发生去折叠,导致蛋白质分子内部的巯基基团不断暴露,内部的二硫键暴露到分子表面,促使巯基含量显著上升。
2.6 β-Lg的二级结构分析
圆二色谱可以用来检测β-Lg的二级结构,解析DHPM处理和糖基化反应对β-Lg二级结构的影响。DHPM处理后β-Lg的CD谱图如图6-A所示,二级结构组成与比例如表2所示。β-Lg是以β-折叠为主的蛋白质,由分子C端上的一个主要的α-螺旋和9条反平行的β-折叠构成[32],这与表中数据相符。由表2可以看出,DHPM处理对β-Lg二级结构的各组分含量有显著影响,其β-折叠和α-螺旋的百分含量随DHPM压力的增大呈先升高后降低的趋势,并且β-转角的百分含量均减少,无规则卷曲的百分含量均增加。当DHPM压力为40 MPa时,β-折叠含量达到最大,为35.0%,但当处理强度进一步增大时,β-折叠含量开始下降,无规则卷曲增加。由于蛋白质的二级结构不仅取决于其氨基酸序列,还与蛋白质不同基团之间的相互作用力有关,如氢键、静电相互作用、范德华力[33],因此DHPM处理会改变β-Lg二级结构,并且β-折叠与无规则卷曲相互转化。

图6 DHPM协同糖基化处理后β-Lg(A)和β-Lg-葡聚糖体系(B)的CD谱图Fig.6 CD spectra of β-Lg(A) and β-Lg-dextran(B)treated by DHPM pre-treatment combined with glycation
图6-B为DHPM协同糖基化处理后的β-Lg的CD谱图,表2中为其二级结构组成与比例。如表2所示,与天然β-Lg相比,糖基化会降低β-Lg中α-螺旋的百分含量,但DHPM协同糖基化处理后的β-折叠均高于天然β-Lg,但β-转角和无规则卷曲的百分含量均呈现明显降低趋势,并均在80 MPa时达到最低,分别为21.1%和29.1%。40 MPa和120 MPa DHPM预处理结合糖基化样品分别具有最高β-折叠百分含量(37.3%)和最低的α-螺旋百分含量(11.1%)。这说明DHPM协同糖基化处理过程β-Lg的二级结构发生显著变化,4种结构之间会相互转换,可能是因为当β-转角、无规则卷曲百分含量减小时,蛋白质的结构会更加稳定,从而提高了β-Lg的热稳定性。
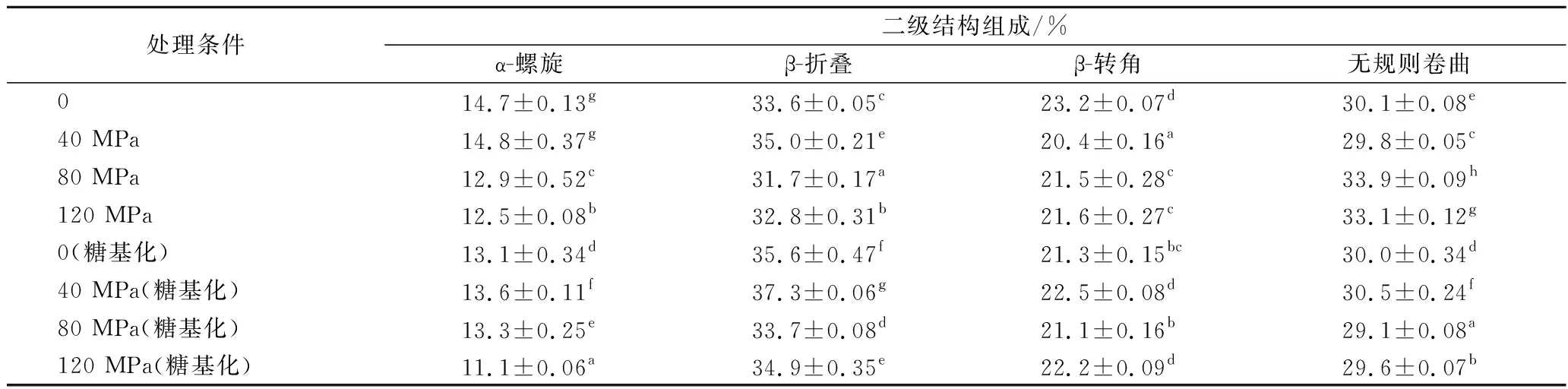
表2 DHPM处理和DHPM预处理结合糖基化对β-Lg-葡聚糖二级结构的影响Table 2 Effect of DHPM treatment and DHPM pre-treatment combined with glycation on the secondary structure of β-Lg
2.7 内源性荧光分析
内源荧光强度通常被用来检验蛋白质分子的3级结构。分子中具有3种荧光特性基团,分别为色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe),β-Lg的内源荧光主要来源于色氨酸残基(Trp 19和Trp 61),因其对于微环境细微变化十分敏感,所以可以用Trp残基作为β-Lg的内源荧光探针来分析蛋白质构象的变化[34-35]。由图7-A可看出,经过DHPM单独处理后的β-Lg荧光强度增大,且随着DHPM压力的增大而逐渐增大。
DHPM不同压力预处理对β-LgD体系的内源荧光强度光谱图的影响如图7-B所示。由图7-B可知,天然β-Lg的内源荧光强度为5 075,经糖基化反应后β-Lg的荧光强度明显下降;而经DHPM预处理协同糖基化反应后,β-Lg的内源性荧光强度随DHPM压力的增加先减少而后增加,且最大吸收峰处的波长发生了3 nm以上的红移,80 MPa预处理的β-LgD反应产物的内源荧光强度最低,仅为3 764,为未处理样品的74%。这可能是由于糖基化反应改变了β-Lg的结构,Trp 19和Trp 61暴露到亲水环境中引起荧光猝灭,并且这种复合处理迫使β-Lg结构展开,从而引起内源性荧光光谱最大吸收峰处的波长发生红移[36]。然而,随着DHPM压力的进一步增大,蛋白发生折叠,迫使β-Lg蛋白的Trp 19和Trp 61残基再次埋到蛋白质结构内部,导致120 MPa时的荧光强度再度增加。
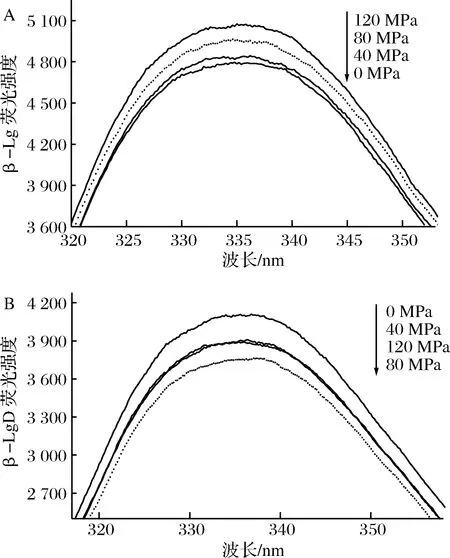
图7 DHPM处理(A)和DHPM预处理结合糖基化(B)对β-乳球蛋白内源荧光光谱的影响Fig.7 Effect of DHPM treatment(A) and DHPM pre-treatment combined with glycation(B) on the intrinsicfluorescence of β-Lg
3 结论
(1)DHPM预处理协同糖基化反应可提高β-Lg的热稳定性,当压力为80 MPa时达到最大。糖基化反应后,β-Lg的游离氨基含量明显降低,褐变程度明显升高;随着DHPM处理压力的增大,β-Lg-葡聚糖反应体系的游离氨基含量和褐变度分别呈先减少后增加和先增大而后减小的趋势,且分别在80 MPa具有最低值和最高值。说明糖基化程度随着DHPM预处理的压力变化而变化,DHPM 80 MPa预处理时样品的糖基化程度最高,热稳定性最大。
(2)DHPM预处理会增加β-Lg的H0,80 MPa处理样品具有最高的H0,而糖基化反应会大大降低其H0;DHPM预处理使β-Lg的自由巯基含量升高,糖基化可再次提高其自由巯基含量,并且在80 MPa时达到了最大;圆二色谱分析证明β-Lg的二级结构发生了变化;内源荧光则表明了β-Lg的三级结构发生了变化,其强度随着压力增大呈先降低后升高的趋势,并且120 MPa时与40 MPa时的内源荧光强度无大致变化,说明随着压力增大,蛋白质再度发生聚集。同时内源荧光强度与糖基化程度的变化趋势相反。
综上,DHPM预处理结合葡聚糖糖基化反应能改变β-Lg的结构,增大其热稳定性,DHPM 80 MPa预处理样品具有高的糖基化程度和热稳定性,为提高β-Lg热稳定性的最佳处理压力。
