两种多酚对马鲛鱼鱼糜凝胶特性的改善
2018-11-14贾慧夏俪宁李琦徐畅董秀萍潘锦锋
贾慧, 夏俪宁, 李琦, 徐畅, 董秀萍, 潘锦锋*
1(大连工业大学 食品学院,辽宁 大连,116034) 2(国家海洋食品工程技术研究中心,辽宁 大连,116034)
鱼糜制品是鱼肉加入食盐,经斩拌使肌原纤维蛋白溶出,加热后蛋白交联形成的具有有序空间网络结构的弹性凝胶食品。鱼糜制品品质特性包括凝胶特性、颜色、持水性等,其中凝胶特性是最重要的指标。为提高鱼糜凝胶强度,不少食品添加物,如淀粉、明胶、大豆蛋白、乳清蛋白、血浆蛋白等被用于鱼糜凝胶特性的改良。非鱼蛋白的加入违背了鱼糜制品的初衷,降低了蛋白含量,使其营养价值、风味特征受到质疑。
多酚是一类具有若干酚性羟基结构的物质,大都具有良好的抗氧化作用,不少亦可抑制微生物生长,是良好的食品添加剂[1]。多酚类物质主要存在于植物如谷物、水果、茶叶等[2],其天然性和安全性高,消费者接受度高。研究发现,多酚类物质可以有效提高蛋白质的交联[3-6],该作用主要源于多酚物质的氧化中间产物醌类物质,后者可以促进蛋白质中赖氨酸、蛋氨酸、丝氨酸的氧化交联,形成更为稳定的网络结构[7-8],同时多酚类物质本身也可促进次级作用力,如氢键、疏水作用,使网络结构更加稳定。目前,多酚物质对于肌肉蛋白作用研究主要见于肉类,鱼肉中研究的较少。
马鲛鱼,又名鲅鱼,是我国重要的海洋经济鱼种之一,2016年产量达43.29万t[9]。由于马鲛鱼肌原纤维蛋白的凝胶性能较弱,如何提升其凝胶特性是马鲛鱼凝胶产品开发的关键。本文以马鲛鱼鱼糜为原料,考察绿原酸、咖啡酸及其氧化形式对马鲛鱼鱼糜凝胶特性的作用;以及马鲛鱼鱼糜的凝胶强度、颜色、持水性、水分分布及微观结构变化,为提升马鲛鱼鱼糜凝胶制品品质提供理论依据和参考。
1 材料与方法
1.1 实验原料
深度冷冻马鲛鱼(10月捕捞、速冻,体重1.2~1.5 kg),购于大连市新长兴市场;塑料肠衣,东北往事特产店;绿原酸、咖啡酸,上海笛柏化学品技术有限公司。
1.2 实验仪器
HH-1数显恒温水浴锅,常州智博瑞仪器制造有限公司;AB204-N电子分析天平,常熟市双杰测试仪器厂;NMI20低场核磁共振分析仪(LF-NMR),上海纽迈电子科技有限公司;CM1950冰冻切片机,德国徕卡(Leica);TA.XT.plus物性测试仪,美国亨特立公司;UltraScan PRO测色仪,美国亨特立公司;扫描投射电镜(SEM)。
1.3 实验方法
1.3.1 鱼糜制备
冷冻马鲛鱼,室温解冻,去头、去皮、去内脏、去红肉,所得鱼肉搅碎,采用BALANGE 等[10]的修改方法进行漂洗。首先次用冰冷去离子水,以1∶3比例漂洗4 min,重复1次。再用冰冷的0.5%NaCl溶液漂洗1次,4 min,然后进行挤压脱水。脱水后的鱼糜加入4%木糖醇和4%山梨糖醇,混合均匀后每袋200 g进行分装,采用-80 ℃速冻40 min 后于-20 ℃贮藏,2个月内使用完毕。
1.3.2 氧化多酚的制备
氧化绿原酸和氧化咖啡酸,按照BENJKUL等[11]方法进行氧化。将多酚以1∶100(g∶mL)的比例溶于去离子水,用6 mol/L NaOH和HCL调节pH到8,使其完全溶解。然后在氮吹仪中,60 ℃下通入氧气氧化2 h,将多酚转化为醌类物质。氧化后采用6 mol/L HCL将多酚溶液pH调至7。未氧化多酚不经通氧气,直接调节pH到8,溶解即可。记绿原酸添加组鱼糜为CHA(chlorogenic acid),氧化绿原酸添加组为OCHA(oxidized-chlorogenic acid),咖啡酸添加组为CA(caffic acid),氧化咖啡酸添加组为OCA(Oxidized-caffic acid)。
1.3.3 鱼糜凝胶制备
将冷冻鱼糜室温缓冻30 min,直到中心温度达-2 ℃。于10 ℃下斩拌1 min分别加入不同体积的多酚或氧化多酚溶液,使得最终多酚或氧化多酚与蛋白质量比为0%,0.15%,0.30%,0.45%。各体系最终补充水分含量到相同的水分含量83%。所得鱼糜继续斩拌2 min,再加入2.5%的食盐斩拌2 min,而后鱼糜灌入直径20 mm的肠衣,采用二段加热法(40 ℃ 30 min,再90 ℃ 20 min)制备鱼肠凝胶所得鱼肠于冰水中冷却,并置于4 ℃冰箱过夜储藏,24 h测定各类性质。
1.3.4 凝胶强度测定
凝胶强度测定法方参照BALANGE等[12],略作修改。将经1.3.3所制凝胶切成高20 mm、直径20 mm圆柱体,采用物性测试仪测定凝胶强度。测试条件:测试探头型号P/5S;测前速度1.00 mm/s,测试速度1.00 mm/s,返回速度10.00 mm/s;下行距离15 mm。每个条件重复测定6次。
1.3.5 颜色测定
颜色测定法方参照ARFAT等[13],稍加修改。将1.3.3所得鱼肠样品切成高20 mm圆柱体,利用测色仪HunterLab测定L*,a*,b*值,由以下公式计算结果。每个条件重复6次,白度W计算参照公式(1)。
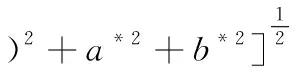
(1)
式中:L*为明度(黑暗色(0)到明亮色(100)),a*为红色(60)到绿色(-60),b*为黄色(60)到蓝色(-60)。
1.3.6 持水性(WHC)测定
持水性参照ZHOU等[14]的方法并作修改。将经1.3.3所得鱼肠取3 g左右,称取质量为m1,切碎,用滤纸吸取表面的水分,于4 ℃下,10 000g离心 10 min,称取质量为m2。持水性计算参照公式(2)。
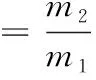
(2)
1.3.7 LF-NMR的水分分布测定
鱼肉凝胶香肠的水分分布参照HAN等[15]方法并作修改。将经1.3.3所得香肠切成20 mm高圆柱体,置于核磁管内,采用低场核磁共振分析仪,利用CPMG脉冲序列测定鱼肠水分的横向弛豫时间T2,测定采用如下运行参数:线圈直径60 mm,频率21 MHz,温度(32±0.01) ℃,TD 360020,NS 4。每个样品重复扫描3次,使用SIRT算法拟合所得指数衰减图得T2谱图。每组重复6个样品。
1.3.8 微观结构
鱼肉凝胶微观结构采用BALANGE等[16]方法进行观察。将经1.3.3所得样品切成2~3 mm的薄片,截面修成5 mm×5 mm的正方形;用2.5%的戊二醛溶液(溶于0.2 mol/L的磷酸缓冲液,pH=7.2)4 ℃浸泡, 过夜,用去离子水反复洗涤3次,每次10 min。然后分别用体积分数为50%,70%,80%,90%的乙醇溶液进行梯度脱水各10 min,随后用100%的乙醇溶液脱水3次,每次30 min。再用V(乙醇)∶V(叔丁醇)=1∶1的溶液将样品浸泡15 min,使其充分的进行置换,最后用100%的叔丁醇4 ℃进行浸泡15 min。所得样品冷冻干燥后粘在铜台上,样品表面进行喷金,采用扫描电子显微镜观察样品。
1.4 统计分析
采用SPSS 19.0对数据进行单因素方差分析ANOVA,并采用Turkey法进行多重比较,显著性水平取p<0.05。
2 结果与分析
2.1 多酚对马鲛鱼鱼糜凝胶强度的影响
不同质量分数CHA、OCHA、CA、OCA作用下的马鲛鱼鱼糜凝胶破断力和凹陷度如图1所示。与对照组相比,多酚添加组的鱼糜凝胶破断力均有一定程度上升(p<0.05),尤其CHA组,最高破断力出现在0.15%,达252.30 g,增加幅度在62.62%以上。而OCHA组凝胶破断力在质量分数为0.30%时最高,约为217.01 g。CA组中凝胶破断力呈现剂量反向效应,在0.15%时最高,0.45%时显著下降(p<0.05)。OCA组则在0.30%时破断力最高(p<0.05),0.45%的添加量无显著效应(p>0.05)。多酚添加组的凝胶破断距离改善不显著,只有质量分数为0.15%CHA、0.30%OCHA、0.15%CA和0.30%OCA组破断距离有轻微提高。研究结果表明,绿原酸、咖啡酸和氧化绿原酸、氧化咖啡酸皆可显著提高马鲛鱼鱼糜的凝胶破断力,但对于破断距离作用不显著。
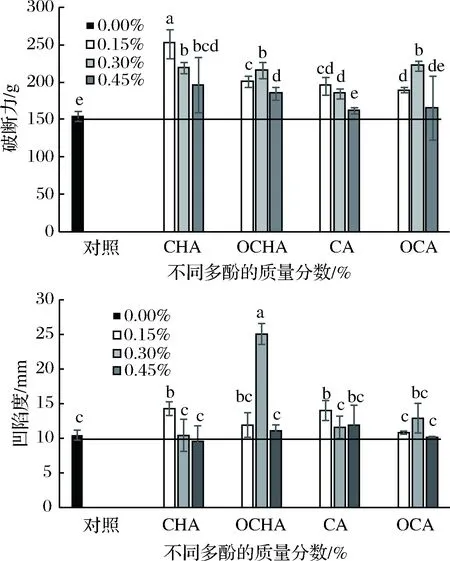
图1 多酚对马鲛鱼鱼糜凝胶破断离和凹陷度的作用Fig.1 Effects of phenolic compounds on breaking force andbreaking distance of mackerel surimi gels注:不同字母表示不同差异水平(p<0.05)(下同)。
PRIGENT等[17]认为多酚物质可以与蛋白质发生共价和非共价相互作用。低浓度的多酚存在时,蛋白质可能与多酚以非共价键的形式相互作用,促使肌原纤维蛋白展开结构,利于加热时的蛋白间交联,使凝胶强度增强[18]。同时,多酚类物质富含羟基,该基团可与蛋白形成大量的氢键和疏水作用,该类非共价作用对增强蛋白的凝胶性能亦有所贡献[6]。本文中CHA与CA可能主要通过此二类作用实现马鲛鱼鱼糜凝胶特性的增强。另一方面,酚类化合物在碱性环境下氧化,可以形成醌类化合物[19],后者可以促进蛋白间的共价交联,包括二硫键、碳硫键等,也可增强蛋白质凝胶特性[20]。本研究中的OCHA和OCA可能通过此类方式使鱼糜凝胶性能提升。然而,随酚类化合物浓度的升高,酚类化合物会发生自我交联,从而阻碍蛋白质间的相互交联能力,导致凝胶强度下降[21]。OCHA和OCA组中添加量为0.45%(质量分数)较添加量0.3%(质量分数)凝胶破断力的显著下降证实了这种推断。可见高浓度的氧化多酚会降低其与蛋白的相互作用效率,类似的结果在乳蛋白与高浓度多酚作用中有所发现[22]。
2.2 多酚对马鲛鱼鱼糜凝胶颜色的影响
由表1可知,与空白组相比多酚的加入显著降低了马鲛鱼鱼糜凝胶的白度(p<0.05),且随着添加浓度的上升,白度下降越显著。其中氧化咖啡酸的鱼糜凝胶白度下降最显著,添加其他几种多酚的鱼糜凝胶颜色尚可接受。这可能是由于OCA在其氧化过程中,形成不稳定物质,导致颜色变深,从而使鱼糜凝胶白度降低。多酚类物质具有较多羟基结构,一般带有颜色[3],在pH值呈碱性下,颜色会加深。本研究中,为了更好地溶解多酚并促进氧化,pH值被调节至8.0左右,因此鱼糜凝胶的颜色产生一定影响。BALANGE等在大眼鲷鱼鱼糜[10]和羽鳃鲐鱼鱼糜中[12]也发现单宁酸、绿原酸、阿魏酸的使用降低了2种鱼糜凝胶白度,类似的结果在O’CONNELL的研究中也发现多酚的添加对干酪制品的颜色产生影响[23]。以上结果表明,多酚的加入对马鲛鱼鱼糜凝胶颜色性质产生显著影响,但在较低使用浓度下颜色改变可以控制在可接受水平。

表1 多酚对马鲛鱼鱼糜凝胶白度的影响Table 1 Effects of phenolic compounds on color properties of mackerel surimi gels
续表1

多酚质量分数/%L*a*b*ΔE*0.1577.45±0.41b-0.76±0.07f2.71±0.33f77.27±0.43bCA0.3076.61±0.98bc-0.70±0.12f2.22±0.50f76.48±0.95bc0.4577.55±0.57b-0.29±0.07e2.57±0.06f77.40±0.56b0.1575.82±0.77c0.97±0.05c4.39±0.24cde75.41±0.78cOCA0.3074.40±0.51d2.07±0.09b6.02±0.52b73.62±0.54d0.4573.14±0.66e2.71±0.22a7.17±0.35a72.06±0.65e
注:不同字母表示处于不同显著差异水平。
2.3 多酚对马鲛鱼鱼糜凝胶持水性(WHC)的影响
不同质量分数多酚处理的马鲛鱼鱼糜凝胶WHC变化如图2所示。
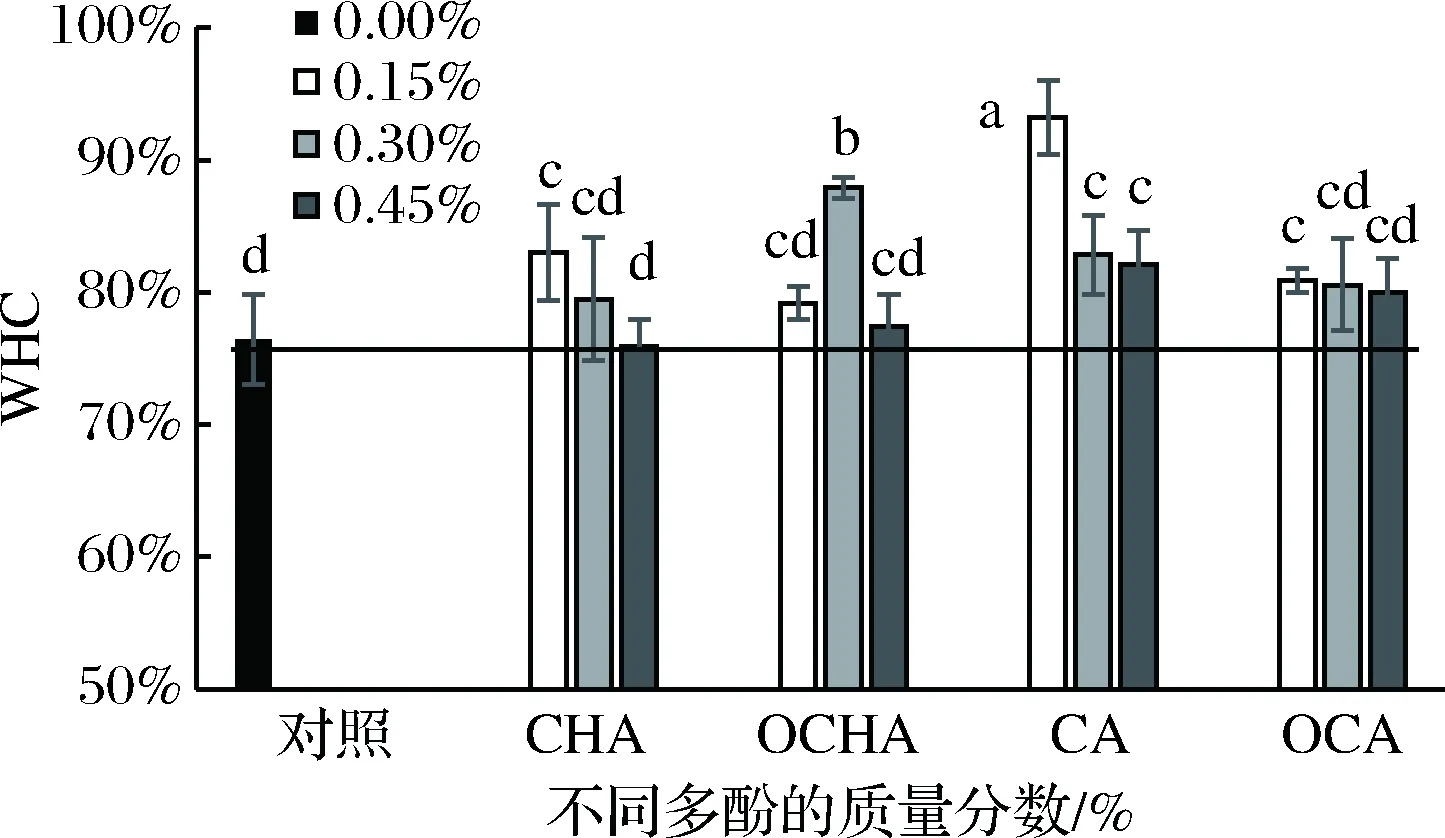
图2 多酚质量分数对马鲛鱼鱼糜凝胶WHC的影响Fig.2 Effects of phenolic compounds on WHC ofmackerel surimi gels
与对照组相比,0.15%CHA组和0.30%OCHA组WHC显著上升,且后者高于前者(p<0.05)。其他几组呈现一定上升但不显著,而0.45%CHA组WHC与对照组无差异(p>0.05)。呈现最高WHC的CHA和OCHA添加组浓度与凝胶破断力的结果一致,而这主要源于绿原酸的次级作用力的增强和氧化绿原酸对应醌类物质对于肌原纤维蛋白的共价交联作用。结果表明,绿原酸通过非共价作用力形成的蛋白凝胶结构对保水性能的提升效果弱于氧化氯原酸形成的共价作用力效果。CA与OCA组WHC较对照组均有上升(p<0.05),其中CA在添加量为0.15%时WHC最高,提高接近93.21%,继续提高质量分数,WHC反而下降。添加量为0.15% OCA组WHC较对照组显著上升(p<0.05),但不同浓度组间无显著差异(p>0.05)。CA组WHC变化与其凝胶破断力变化一致,表明CA的添加可能促使蛋白发生了结构改变,利于更强烈的蛋白相互作用,提高凝胶保水性能,尤其是低浓度的CA效应最为显著。然而OCA组WHC变化趋势与其凝胶破断力变化趋势不同。可能由于肌原纤维蛋白随着氧化酚酸质量分数升高,发生了过氧化现象,导致蛋白质之间过度交联,肌原纤维蛋白之间内部网络结构破坏,束缚水的能力下降,WHC因此减弱。但此时过度交联没有降低凝胶强度,可能会使凝胶更硬,不利于鱼糜制品口感,类似结果在WANG等[24]的研究中有过报道。以上结果表明,绿原酸、咖啡酸及他们的氧化形式在适宜质量分数下均可提升马鲛鱼鱼糜凝胶的保水性能。
2.4 多酚对马鲛鱼鱼糜凝胶弛豫时间的影响
如图3所示,T2出现了3个类型的峰:T21峰(0~10 ms)、T22峰(60~200 ms)、T23峰(>600 ms)。
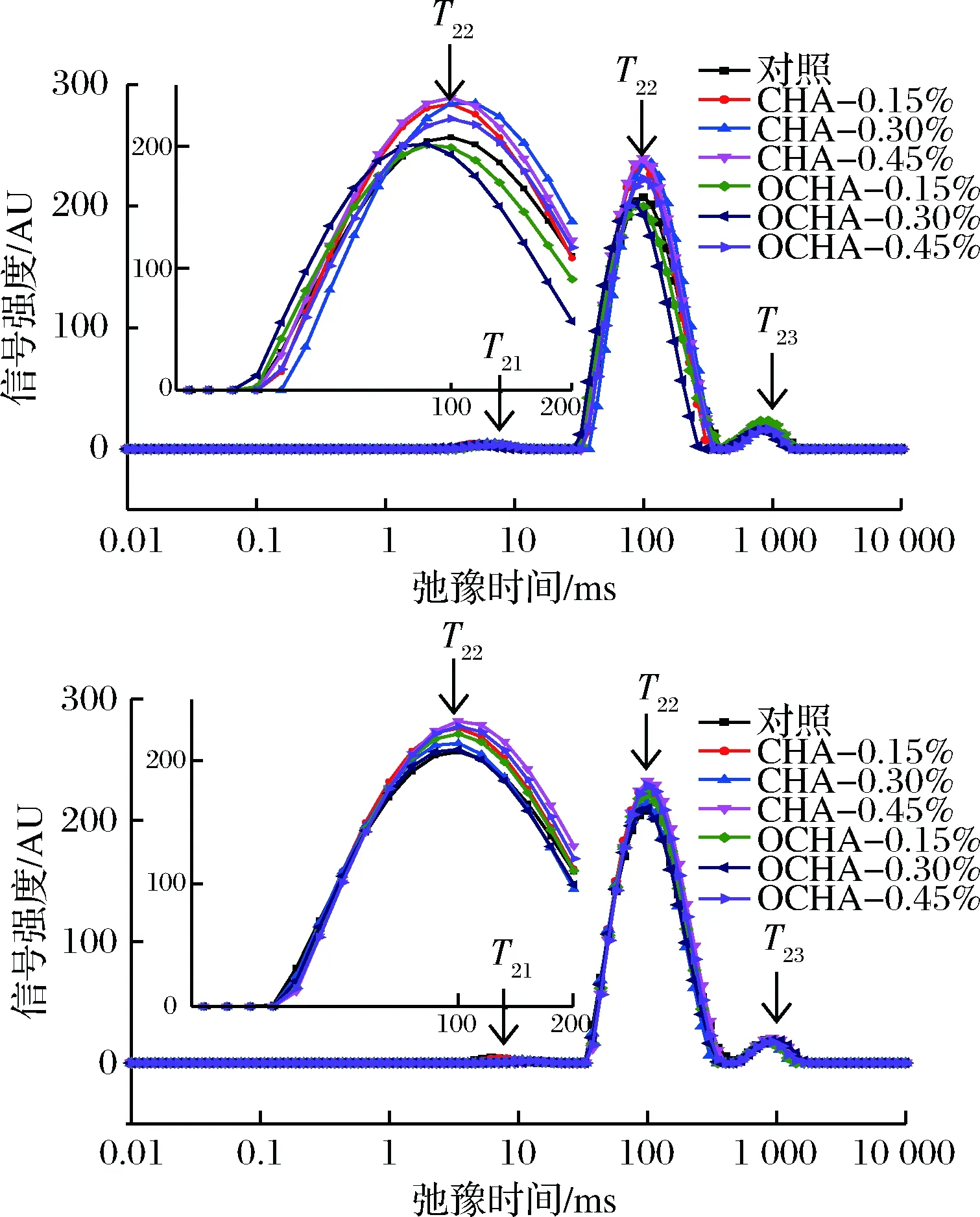
图3 多酚对马鲛鱼鱼糜凝胶弛豫时间T2分布的影响Fig.3 Effects of phenolic compounds on T2 relaxation timedistribution of mackerel surimi gels
根据SANCHEZ-ALONSO等[25]报道,低场核磁共振中的弛豫时间T2反映的是体系中水分子的自由度,包括T21、T22、T23,且分别代表着结合水、吸附水、自由水。与对照组的马鲛鱼鱼糜凝胶相比,随着多酚浓度的升高T2峰值发生不同程度的偏移。CHA与OCHA均向左发生偏移,且CHA组和0.45%OCHA的峰都在增大(p<0.05),0.45%CHA的峰最高, 0.15%OCHA和0.30%OCHA的峰略有减小(p<0.05)。CA与OCA也均向左发生偏移,与对照组相比所有的峰都在增大(p<0.05), 0.45%CA的峰值最高, 0.30%OCA的峰值增加最少。ZHANG等[26]研究发现,适宜温度处理鱼糜凝胶后,其T22的弛豫时间左移、增加,吸附水也增加,此现象说明部分自由水在转化为吸附水,水与凝胶网络间的相互作用增强,鱼糜凝胶束缚水的能力增强。以上结果表明在CHA, OCHA, CA和OCA的作用下,凝胶的保水能力在增强,这与2.3中结果相一致。但是并不是所有的多酚添加组WHC都与各自T22峰值相对应,这可能由于实验本身误差导致。
2.5 多酚对马鲛鱼鱼糜凝胶微观结构的影响
凝胶强度较对照组有所提升的马鲛鱼鱼糜凝胶微观结构电镜观察结果如图4所示。

图4 多酚对马鲛鱼鱼糜凝胶微观结构的影响Fig.4 Effects of phenolic compounds on microstructureof mackerel surimi gels
对照组(图4-E)凝胶微观结构比较松散,孔隙较大且不均匀,添加了绿原酸、咖啡酸和二者氧化形式的马鲛鱼鱼糜凝胶网状结构变得紧实致密,孔洞相对均匀、微小,尤其是0.15%CHA组和0.30%OCA组。吕宏宇等[27]在氧化多酚作用于鲫鱼鱼糜的研究中也发现,凝胶结构在添加适当浓度的多酚后变得均匀,孔径更小,更致密,同时凝胶性能增强,而BALANGE[12]在羽鳃鲐鱼鱼糜研究中也发现氧化单宁酸、氧化阿魏酸和氧化茶多酚增强了凝胶强度,且增强组凝胶形成的孔洞更均匀致密。此外,BUMARD等[11]也报道沙丁鱼鱼糜在添加富含多酚的椰果壳提取物后形成的凝胶较对照组明显的更致密、空洞更小。可见,多酚可与肌原纤维蛋白发生共价与非共价键作用,改变其凝胶微观构造,网络结构致密,抵抗外压能力增强,凝胶强度提高。
3 结论
在适宜浓度的绿原酸、咖啡酸和氧化氯原酸、氧化咖啡酸均可提升马鲛鱼鱼糜凝胶特性。绿原酸和咖啡酸主要通过非共价作用力促进马鲛鱼鱼糜肌原纤维蛋白之间作用,而氧化绿原酸和氧化咖啡酸主要通过共价交联促进肌原纤维蛋白网络结构的改善,形成更多致密均匀孔洞,提高凝胶强度和保水能力。二者的使用对鱼糜凝胶白度有一定影响,低浓度使用造成的颜色变化可以接受。
