蚓激酶基因在毕赤酵母中的表达及其发酵条件优化
2018-11-14江鹏汤斌
江鹏,汤斌
1(安徽工程大学 生物与化学工程学院,安徽 芜湖,241000) 2(微生物发酵安徽省工程研究中心,安徽 芜湖,241000)
蚓激酶(Lumbrokinase,LK)是从蚯蚓体内发现的一组同时具有纤溶活性和激酶活性的丝氨酸蛋白酶[1]。该酶能够刺激纤溶酶原转变成纤溶酶,从而催化纤维蛋白,起到溶血栓作用[2]。临床试验表明,蚓激酶还可用于预防和治疗冠心病、脑梗塞、肺心病和下肢深静脉血栓等疾病[3-4]。该酶稳定性良好,酶制剂既能口服,亦可注射,已得到广泛应用[5-6]。目前,市售蚓激酶主要来源于蚯蚓粉末的提取纯化,此法所得产品纯度较低且产量少。因此,通过异源表达生产高纯度的蚓激酶已成为未来蚓激酶工业化生产的趋势[7]。
近年来,研究者已从不同种类蚯蚓中克隆得到蚓激酶编码基因,并在大肠杆菌中进行表达,但目的蛋白多以包涵体形式存在,因而没有纤溶活性[8-11]。相较于原核表达系统,毕赤酵母表达系统具有胞外分泌且易于纯化目的蛋白的优势[12-14]。赵明明[15]等首次在毕赤酵母中成功表达了蚓激酶F238基因,酶活最高为100 U/mL。随后,宋馨宇[16]等人通过G418抗性梯度筛选获得1株耐高抗性的GS115-pPIC9K-F238菌株,摇瓶培养84 h后达蚓激酶酶活峰值257.6 U/mL。然而,目前蚓激酶在毕赤酵母中表达研究的报道较少,且表达量较低,远不能应用于工业化生产[15-16]。
为了提高蚓激酶在毕赤酵母表达系统中的产量,本文从重组菌诱导表达条件出发,优化初始菌体量、pH和温度,并研究氨基酸对蚓激酶在酵母中表达的影响,最终通过高密度发酵手段实现蚓激酶基因在毕赤酵母中的大量表达,为今后蚓激酶的工业化生产提供理论参考。
1 材料与方法
1.1 材料与试剂
蚯蚓样本:获自校园土壤中,经本实验室分子生物学鉴定为赤子爱胜蚓。本文所用E.coliJM109、毕赤酵母GS115、pPIC9K质粒均为安徽工程大学微生物发酵研究中心保藏菌种,pMD18-T载体购自上海Sangon公司。Trizol试剂、尿激酶、购自上海Sangon公司,牛血纤维蛋白原、凝血酶购自Sigma公司,其他试剂购自国药。
1.2 蚓激酶基因的克隆及表达
利用Trizol法提取赤子爱胜蚓总RNA,试剂盒法反转录合成cDNA。通过GenBank数据库搜索蚓激酶编码序列,经比对分析设计引物对Primer 1-F+Primer 1-R。以cDNA为模板克隆目的基因,并将其连接pMD18-T载体,送上海生工测序。根据测序结果设计引物对Primer 2-F+Primer 2-R。PCR产物和质粒同时用EcoRⅠ和NotⅠ双酶切,连接后转化E.coliJM109,筛选得到重组质粒pPIC9K-lks2送上海生工测序。引物见表1。利用SacI酶对该重组质粒进行线性化,电转化毕赤酵母GS115感受态细胞,利用MD平板进行筛选,并提取转化子基因组DNA,进行PCR验证。挑取MD平板上的酵母单菌落接种于YPD培养基中,30 ℃,220 r/min培养18 h。按1%量接种于30 mL BMGY培养基中,30 ℃,220 r/min培养至OD600值为2~6,离心去上清收集菌体,将菌体重悬于 30 mL BMMY 培养基中,30 ℃,220 r/min振荡培养,每隔24 h加体积分数0.5%甲醇进行诱导表达。
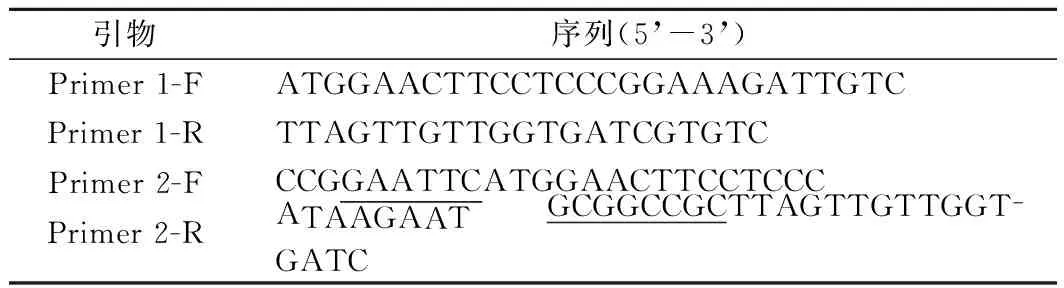
表1 本研究所用引物Table 1 Primers used in this study
注:下划线为酶切位点。
1.3 蚓激酶活力测定方法
本文采用国标法[17](纤维蛋白平板法)测定蚓激酶活力:制备纤维蛋白平板,将梯度浓度的尿激酶标准品点样于纤维蛋白平板上,放置10 min后移入37 ℃培养箱,保温18 h取出测量溶圈垂直的2个直径,并计算2个直径的乘积,重复测定3次,求平均值。以测定不同浓度的溶圈垂直直径乘积(A)的对数为纵坐标,标准品尿激酶浓度(C)的对数为横坐标绘制标准曲线。线性回归方程为:lnA=0.864lnC+2.047 7,R2=0.969 8。
1.4 蚓激酶毕赤酵母重组菌的发酵条件优化
基础诱导培养基为BMMY,诱导温度30℃,装液量30%,摇床转速220 r/min,甲醇添加量体积分数为0.5%。诱导初始菌体量优化:初始OD600分别为0.5、1、1.5、2和2.5,取发酵液上清以纤维平板法测纤溶活力。诱导pH值的优化:在上述优化基础上,调整初始pH值分别为4.5、5、5.5、6、6.5和7,以纤溶活力确定最佳pH值。诱导温度的优化:上述优化基础上,设置初始温度分别为26、28、30、32、34 ℃,同样根据纤溶活力确定最佳诱导温度。
氨基酸对重组菌产酶的影响:在BMMY培养基中分别添加体积分数为0.1%的不同种类氨基酸,对照组不加氨基酸,诱导84 h后取样检测酶活力。
1.5 重组毕赤酵母发酵罐放大培养
1.5.1 种子培养
一级种子液:挑取MD平板上的重组菌,接于10 mL YPD中,30 ℃,220 r/min培养18 h,OD600值为12左右。
二级种子液:按1%的接种量取一级种子液接于350 mL BMGY中,30 ℃,220 r/min培养至OD600值为6~7。
1.5.2 发酵过程控制
10 L发酵罐装液量6.5 L,培养基为BSM培养基,添加体积分数为0.1%的丝氨酸,PTM1添加量为4 mL/L培养基,通过氨水调节pH 5.0。将二级种子液接入发酵罐中,根据毕赤酵母表达手册进行菌体的前期培养,控制DO为40%,发酵pH值为5.0,培养温度30 ℃,通气量为0.5 vvm,罐压0.08 MPa。待菌体湿重达到200 g/L左右后,停止流加甘油。溶氧上升后,饥饿培养0.5 h,开始甲醇诱导。诱导过程严格控制甲醇流加速率使DO在40%小幅波动,氨水调节pH值控制在5.5,诱导温度28 ℃,通气量为0.6 vvm,罐压控制在0.08 MPa。
1.5.3 菌体初始浓度优化
将450 mL二级种子液离心,去上清,用100 mL BMMY培养基洗匀菌体,全部接入发酵罐中,取发酵液离心测得菌体湿重为3±0.5 g/L,以此为基准,通过控制加入的二级种子液的量来使得接种后发酵罐中菌体初始质量浓度分别为3±0.5、6±0.5、9±0.5和12±0.5 g/L,培养条件均一致。发酵过程每隔12 h取样,测菌体湿重和蚓激酶活力。
2 结果与分析
2.1 蚓激酶基因的克隆及分析
目前在GenBank数据库中已公布的蚓激酶编码序列共有19条,其中F238基因[17-19](GeneBank No. DQ202401)的相关研究最多。本文从赤子爱胜蚓中扩增得到蚓激酶基因lks2,全长738 bp,编码246个氨基酸(图1-A)。比对结果显示,lks2与F238基因同源性为99.59%,其中第136、175和398位碱基不同,导致编码的46和59位氨基酸发生差异(图2)。
图1 蚓激酶基因克隆(A)、表达载体双酶切(B)和重组菌基因组PCR(C)Fig.1 Lumbrukinase gene cloning (A), expression vectordouble enzyme cutting (B) and recombinant bacterialgenome PCR (C)
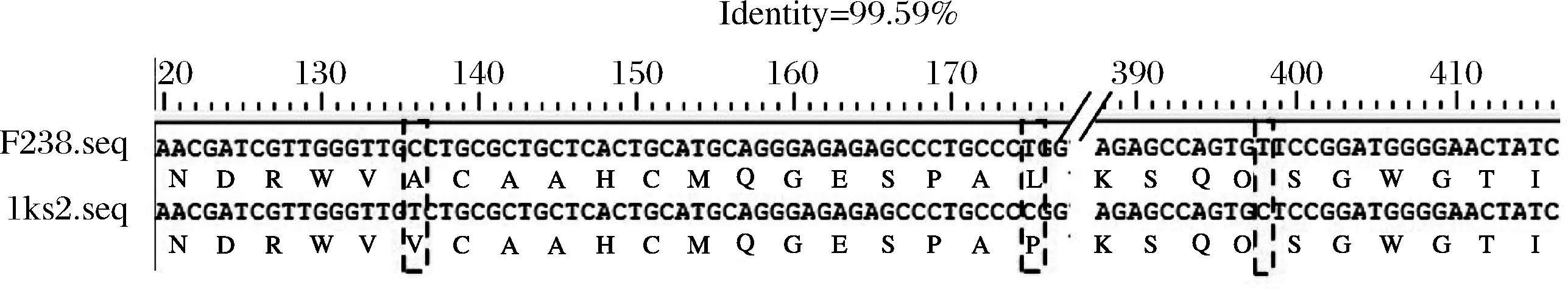
图2 lks2基因与F238基因的差异Fig.2 The difference between lks2 gene and F238 gene
2.2 蚓激酶基因在毕赤酵母中的表达
将lks2与pPIC9k质粒相连接,双酶切验证结果显示表达载体pPIC9K-lks2构建成功(图1-B)。将该表达载体电转化毕赤酵母,获得重组菌GS115-pPIC9K-lks2,经转化子基因组DNA的PCR验证结果显示构建成功(图1-C)。将该重组菌进行摇瓶发酵试验,取不同诱导时间的发酵上清适当稀释,点样于纤维蛋白平板。结果显示,重组毕赤酵母的蚓激酶酶活在84 h达到峰值254.4 U/mL(图3)。
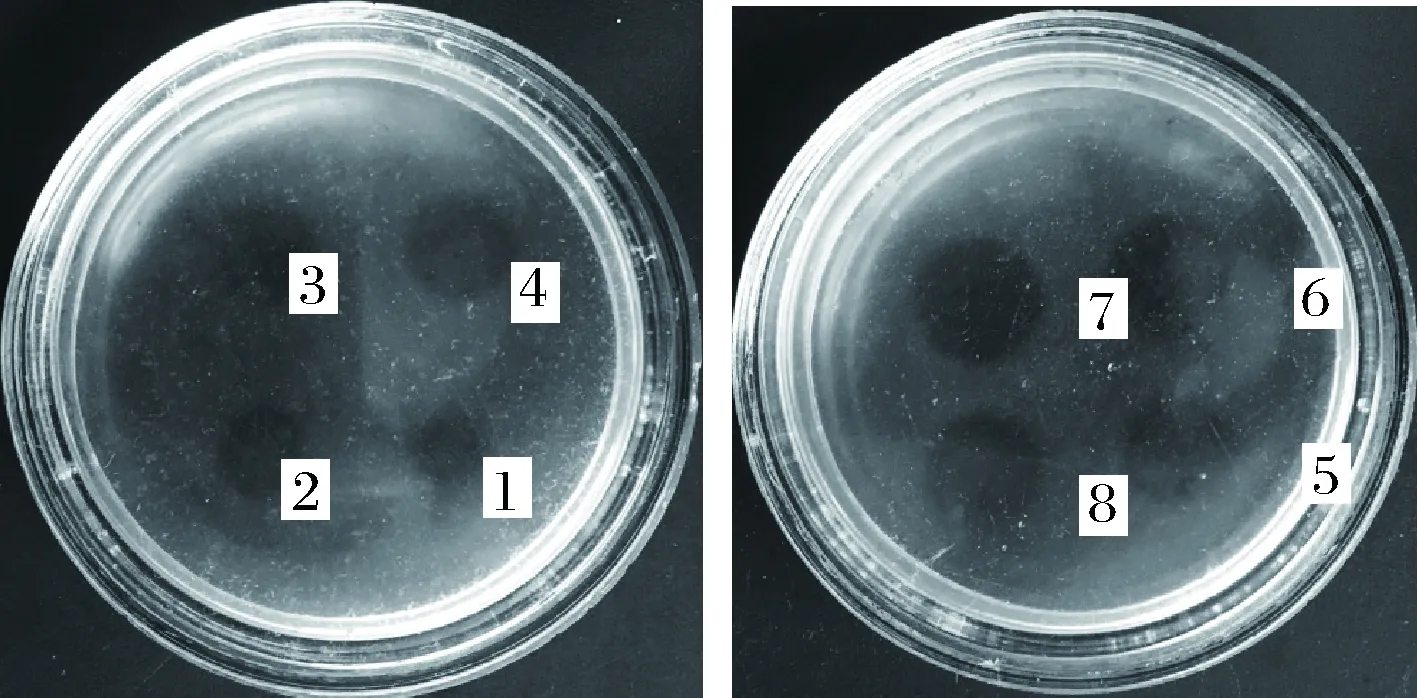
图3 重组菌纤溶活力测定Fig.3 Fibrinolytic activity of GS115-pPIC9K-lks2
2.3 重组菌GS115-pPIC9K-lks2的发酵条件优化
2.3.1 诱导初始培养条件优化
毕赤酵母甲醇诱导过程中需要消耗大量的氧,当菌体浓度较低时培养基成分和供氧量充足,但随着菌体量的增加使得培养基中溶氧降低,从而影响菌体代谢,因此接种量对重组菌产酶影响较大。通过调整初始OD600值来研究初始菌体量对重组菌GS115-pPIC9K-lks2的影响,不同接种量的产酶变化趋势基本一致,达到最高酶活时间点均是诱导84 h。当OD600=1.5时,蚓激酶酶活最高,峰值为288 U/mL(图4-A)。在此基础上优化诱导pH值和温度,结果如图4-B,C所示,最佳诱导初始pH值为5.5,最适诱导温度为28 ℃,此条件下蚓激酶酶活峰值达364.4 U/mL。
2.3.2 氨基酸添加对重组菌产酶的影响
氨基酸是构成蛋白质的基本组成,通过添加氨基酸可在一定程度上加快目的蛋白的合成。本文在BMMY培养基中添加各类氨基酸,研究不同氨基酸对重组菌的产酶影响。结果如图5所示,丝氨酸、甘氨酸和异亮氨酸的添加对重组菌产酶有促进作用,其中以丝氨酸效果最佳。添加0.1%丝氨酸后,蚓激酶酶活达到397.6 U/mL。这可能是丝氨酸在菌体代谢过程中影响了重组菌合成蛋白的能力,对外源基因表达过程起到一定的调控作用。
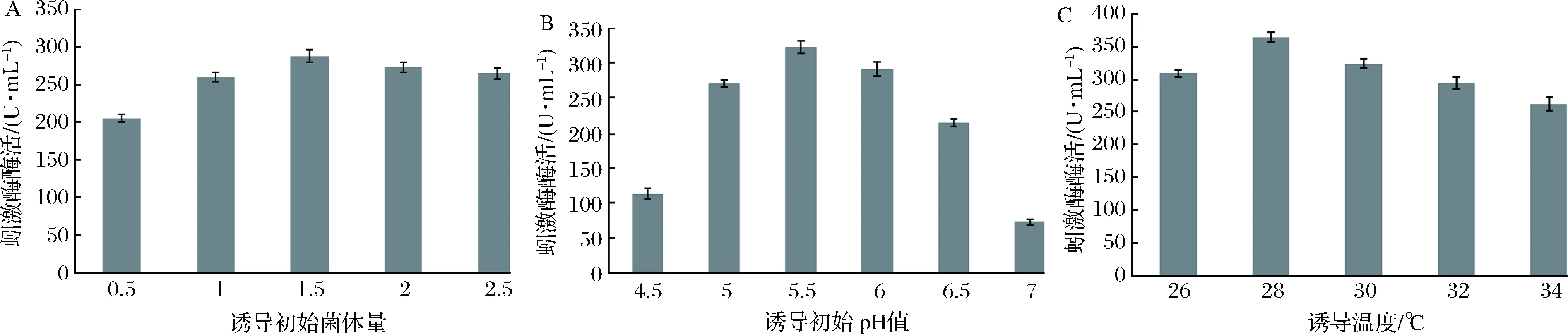
图4 重组毕赤酵母GS115-pPIC9K-lks2的发酵条件优化Fig.4 Optimization of fermentation conditions for the GS115-pPIC9K-lks2
2.4 重组菌发酵罐放大培养
在摇瓶优化基础上,利用10 L发酵罐对重组菌GS115-pPIC9K-lks2进行放大培养及高密度发酵条件研究。种子液浓度为OD600=6时进行上罐发酵,此时菌体处于对数生长期,代谢能力强,有利于扩大培养。由于初始菌体量对毕赤酵母蚓激酶的高效表达具有重要影响,本文对发酵罐初始菌体接种量进行了比较研究。结果如图6-A所示,初始菌体量的增加有利于提高菌体生长速率,达到在相同时间内迅速增加菌体密度的目标。随着菌体密度增加,蚓激酶活力迅速上升,最佳接种菌浓度为9±0.5 g/L(图6-B)。此外,初始接种量的增加可显著缩短发酵周期。当菌体初始浓度为9±0.5 g/L时,诱导前期培养时间较优化前(3±0.5 g/L)缩短了11.5 h,蚓激酶酶活提高了1.08倍(3±0.5 g/L,蚓激酶酶活为527.8 U/mL),达到1 098.2 U/mL。
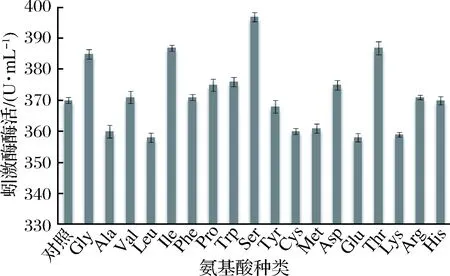
图5 不同氨基酸对产酶影响Fig.5 Different amino acid effect on enzyme production
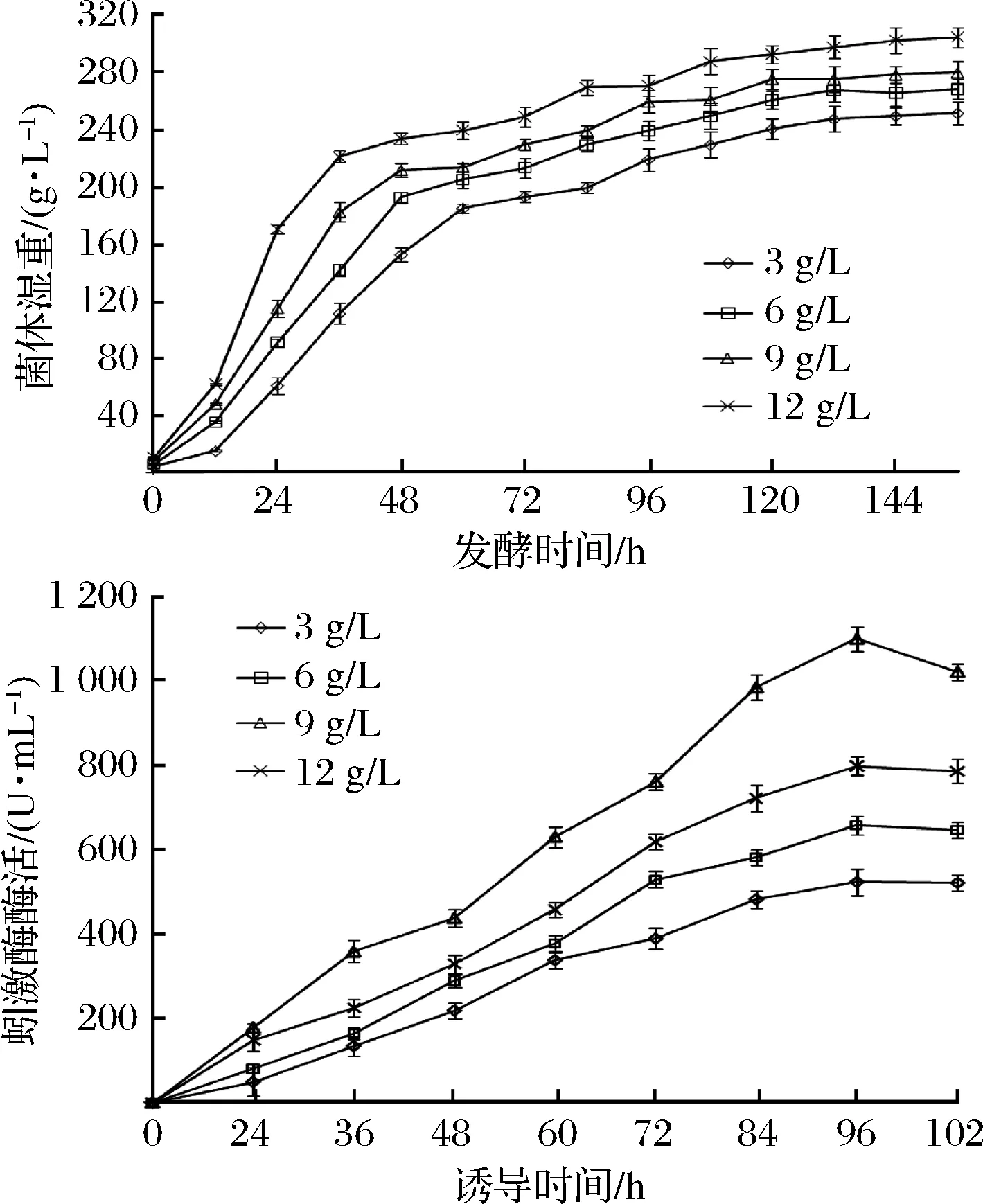
图6 发酵罐放大培养Fig.6 Fermentation tank amplification culture
3 讨论
蚓激酶属于丝氨酸蛋白酶,其编码基因已经成功在细菌、真菌和动植物中实现表达。本文研究了蚓激酶在毕赤酵母中的异源表达,并通过诱导条件优化及高密度发酵研究,有效提高了蚓激酶的产量并缩短了发酵周期,突破了目前毕赤酵母蚓激酶表达量低的瓶颈,具有重要的工业应用价值。
本研究通过对重组菌GS115-pPIC9K-lks2的诱导条件优化,发现诱导初始菌体密度对产酶效果影响较大。菌体密度过低,会导致菌体生长环境中相对甲醇量偏高,从而产生毒性影响菌体正常代谢。甲醇诱导毕赤酵母产酶过程需要消耗大量的氧气,因此菌体密度过高会导致溶氧不足,造成菌体无法有效利用碳源维持自身生存,同样影响产酶能力。因而,确定最佳诱导初始菌体密度对蚓激酶在毕赤酵母中的表达十分关键。本文在摇瓶培养和发酵罐扩大培养过程中完成了最佳初始菌体量的优化,从而显著提升了蚓激酶的产量,为其大规模生产提供了方向。
