基于ISSR标记分析浙江省樱花种质资源的遗传多样性
2018-11-10蒋冬月李因刚石从广杨少宗柳新红
蒋冬月,沈 鑫,吴 帆,李因刚,石从广,杨少宗,柳新红
基于ISSR标记分析浙江省樱花种质资源的遗传多样性
蒋冬月1,2,沈 鑫1,吴 帆1,李因刚1,石从广1,杨少宗1,柳新红1
(1. 浙江省林业科学研究院,浙江 杭州 310023;2. 中国科学院 植物研究所,北京 100093)
为探究浙江省樱花种质资源的亲缘关系和遗传多样性,运用ISSR分子标记从100条引物中筛选出17条多态性好的引物对95份樱花种质资源进行分析。结果表明,17条引物共扩增出110条清晰条带,其中101条具有多态性,平均多态性条带比率为91.78%。95份资源间的遗传相似系数为0.38 ~ 0.90,平均0.61;遗传距离为0.10 ~ 1.38,平均0.50。根据UPGMA聚类分析,在遗传相似系数为0.577 5时,95份种质资源可分为四大类,分别包含了23份、42份、25份和5份材料。研究结果表明浙江省樱花种质资源具有较为丰富的遗传多样性。
樱花;种质资源;ISSR;遗传多样性;浙江
樱花是蔷薇科Rosaceae李亚科Prunoideae樱属典型樱亚属植物Subg.的泛称。全世界约150种,分布于亚洲、欧洲、北美洲等北半球温和地带,我国有38个种,8个变种;其中,浙江省有10个种,包括浙闽樱桃,迎春樱桃,尾叶樱桃,大叶早樱,山樱花,华中樱桃等[1-3]。樱花是浙江省早春开花植物之一,种质资源丰富,分布范围广,形态变异大,花色丰富。花色有白色、粉色、玫红色、黄绿色及各种渐变色和交叉色,花期一般在2-5月,少数11月至翌年1月;果色多为红色、紫红色、深红色至黑色,果期为4-6月,少数10月[4]。樱花既有高大挺拔的乔木,又有低矮稠密的灌木,其花朵数量多,独树成景,成片种植时花海极为震撼。由于樱花种质资源分布广泛,变异丰富,种间或种内的自然杂交频频发生,这给野生樱花的分类鉴定工作带来了很大的困难;且樱花在各地同名异物或同物异名的现象时有发生,因此,仅仅依靠形态特征的鉴定已不能满足樱花资源的分类和选育。分子标记作为一种以核酸多态性为基础的遗传标记,因其不受组织类别、发育时期、环境条件等干扰,具有数量极多、多态性高等优点,被证实是评价种属间亲缘关系和遗传多样性的理想标记[5-7]。ISSR(Inter-simple Sequence Repeat)是建立在SSR(Simple Sequence Repeat)基础上的一种新型的分子标记技术,具有操作简单、成本低、多态性高和重复性好等优点[8],已广泛应用于香茅属[9],鸢尾属[10],风信子[11],桃[12]等植物的遗传多样性和亲缘关系研究。本研究以浙江省野生樱花资源为试验材料,利用ISSR标记从分子水平研究野生资源的亲缘关系和遗传多样性,为野生樱花资源的分类、保护和利用提供参考。
1 材料与方法
1.1 材料
2016年5-6月,从浙江省的14个县(区、市)共采集到95份樱花野生资源(表1),隶属6种2变种,包括迎春樱桃,浙闽樱桃,大叶早樱,山樱花,毛叶山樱花.var.,华中樱桃,毛萼华中樱.var.和尾叶樱桃。每份资源均采集新鲜、无病害的幼嫩叶片作为提取基因组DNA的供试材料,放置于装有硅胶的自封袋中密封保存至完全干燥。

表1 樱花种质资源及采集地点
1.2 试验方法
1.2.1 DNA提取 利用植物基因组DNA提取试剂盒(DP3112,Bioteke,北京)提取95份供试材料的基因组DNA,提取前利用预冷的缓冲液[13](0.25 M NaCl,0.2 M Tris-HCl pH 8.0,50 mM EDTA,2% PVP,1%巯基乙醇)对样品进行预处理,以去除大量的多糖、色素等杂质。利用1%的琼脂糖凝胶电泳法检测DNA质量,用Nanodrop超微量分光光度计(NanoDrop 2 000,Thermo Scientific)测定DNA浓度,并将其稀释到50 ng·μL-1。
1.2.2 ISSR-PCR反应 经过预实验确定PCR优化体系为20 μL反应液,包括2×Taq PCR Master Mix(TSINGKE,北京)10 μL,10 μmol·L-1ISSR-primer 0.6 μL,模板DNA 1.0 μL,ddH2O 8.4 μL。PCR扩增程序为94℃预变性5 min;94℃变性30 s,47.10 ~ 59.50℃复性30 s(见表2),72℃延伸90 s,共35个循环;最后72℃延伸7 min,于4℃保存。PCR扩增产物在1.5%琼脂糖凝胶中150 V电泳30 min,然后置于自动凝胶成像系统(ChemiDoc XRS+,Bio-Rad)中拍照、记录。ISSR引物来源于美国哥伦比亚大学(UBC)公布的ISSR通用引物,由生工生物工程(上海)股份有限公司合成。
1.3 数据处理
采用人工计数法对电泳结果进行统计,同一引物扩增出的相同条带记为1,无相同条带记为0,构建0,1数据矩阵[14]。根据0,1数据矩阵,利用Ntsys 2.1软件计算各样品间的遗传相似系数(Coefficient),并采用UPGMA法进行聚类[15]。
2 结果与分析
2.1 ISSR标记多态性分析
从100条ISSR通用引物中共筛选出17条扩增条带清晰、稳定、重复性好的多态性引物,见表2、图1。利用这17条ISSR引物分别对95份樱花材料的基因组DNA进行扩增,共获得110条清晰的条带,长度介于250 ~ 1 200 bp之间,其中多态性条带为101条。不同ISSR引物扩增的多态性条带数介于4 ~ 8条,平均每个引物扩增5.94条多态性条带,平均多态性条带比率为91.78%。这些均表明17条ISSR引物对野生樱花基因组DNA扩增的多态性较高,说明分布于浙江省的樱花种质资源具有丰富的遗传多样性。
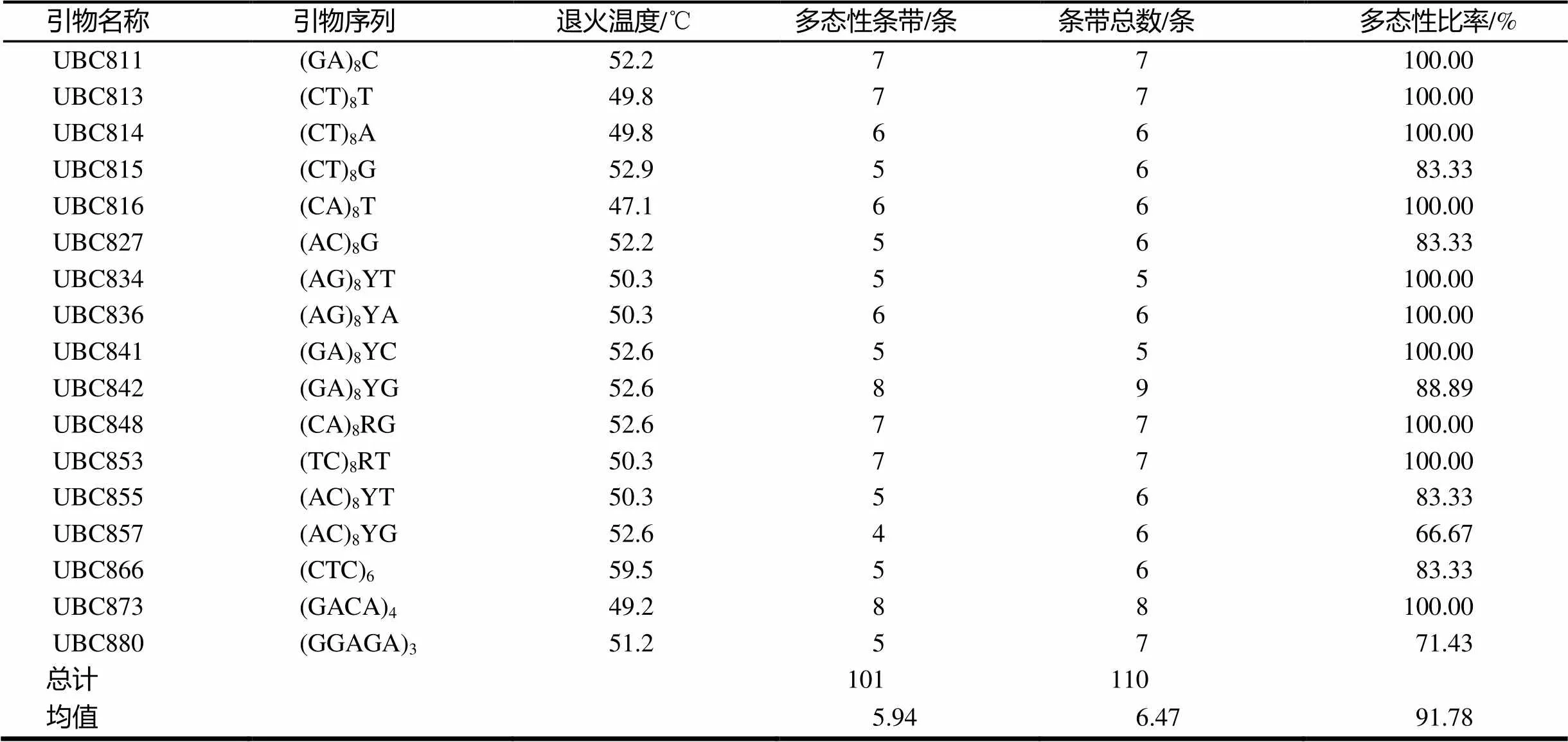
表2 ISSR引物退火温度及扩增结果
注:Y = (C,T);R= ( A,G)。
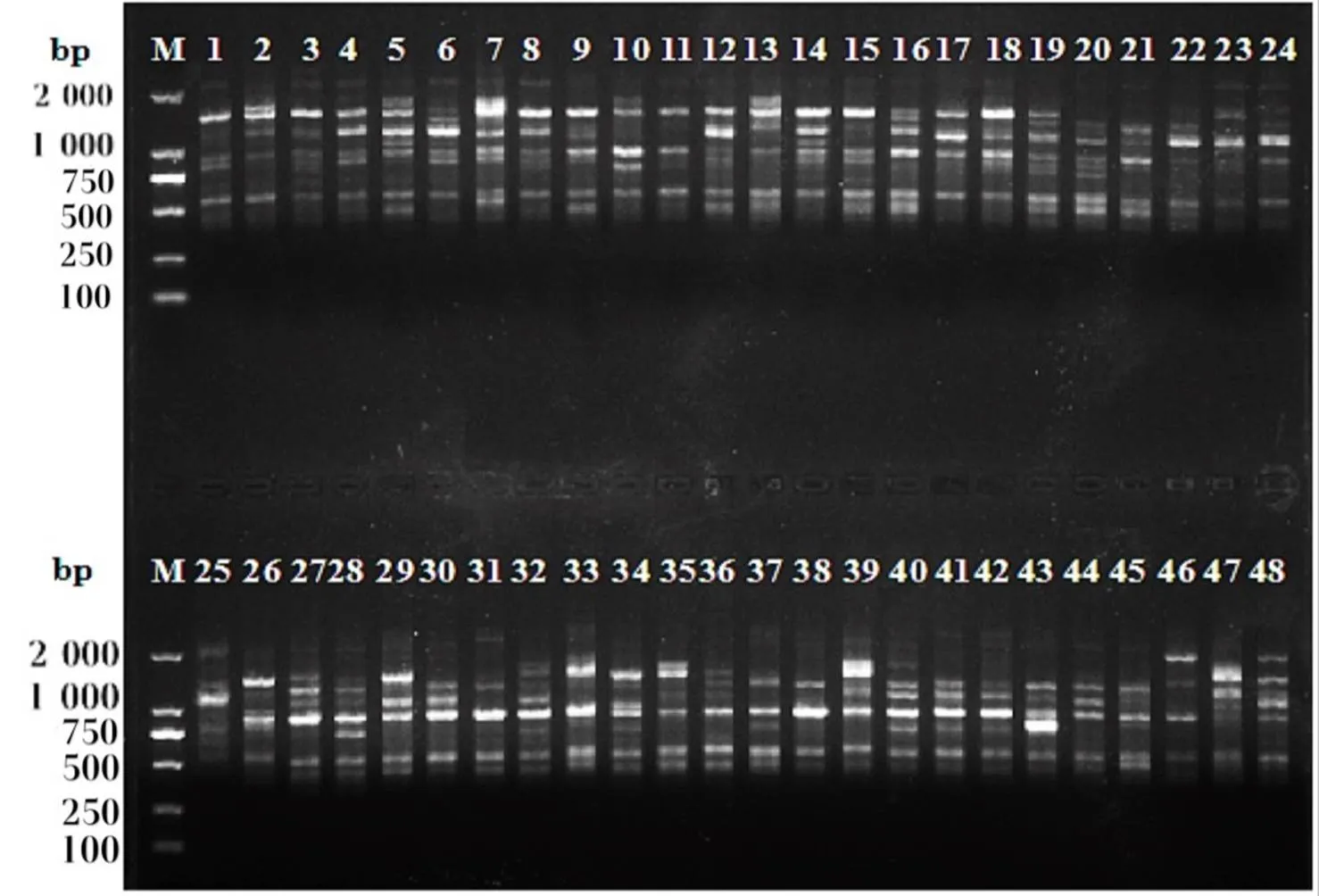
图1 UBC813引物对部分樱花基因组DNA的扩增图谱
Figure 1 Gel diagram of genomic DNA ofspp. amplified with primer UBC813
2.2 樱花种质资源遗传多样性和聚类分析
95份野生樱花资源的遗传相似系数范围为0.38 ~ 0.90,平均0.61;根据遗传相似系数对95份樱花种质资源进行聚类分析,在遗传相似系数为0.577 5时,95份野生樱花分为四大类(图2)。A类群共23份材料,均为华中樱桃,其中2个毛萼华中樱桃在一起;包括3份资源来自金华市,4份资源来自丽水市,16份来自温州市。
B类群共42份材料,当遗传相似系数为0.595时,将B类群又分为3小类。B1类群有1份材料来自丽水景宁县的华中樱桃。B2类群有24份材料,其中6份迎春樱聚为一类,18份尾叶樱桃聚为一类。B3类群有17份材料,包括12份迎春樱,3份华中樱桃,2份大叶早樱。
C类群共25份材料,当遗传相似系数为0.609时,将C类群又分为2小类。C1类群17份材料,主要为山樱花类,包括9份毛叶山樱花,6份山樱花,1份迎春樱,1份华中樱桃,其中山樱花和毛叶山樱花聚为1类。C2类群有8份材料,包括4份尾叶樱桃,2份毛叶山樱花和2份浙闽樱桃。
D类群共5份材料,均为大叶早樱,其中3份来自宁波市,1份来自台州市,1份来自金华市。
3 结论与讨论
分子标记技术是继形态标记、细胞标记以及生化标记之后发展起来的直接反应遗传多样性的一种遗传标记,可以高效、稳定、准确地鉴定植物材料,评价种属间亲缘关系和遗传多样性,已在牡丹[16],月季花[17],风信子[11],杜鹃spp.[18]等花卉中广泛应用。在樱花种质资源的研究上,Badenes等[19]、曹东伟等[20]利用RFLP标记得出不同樱桃的亲缘关系;Gerlach等[21]、周春玲等[22]、Hormaza[23]成功利用RAPD技术对樱花进行亲缘关系鉴定和品种分类;Antonius等[24]、Kato等[25]、商韬等[26]通过SSR标记研究樱花资源的遗传多样性。本研究中所用引物平均多态性条带比率为91.78%,说明这17条ISSR引物能够较好的将95份供试材料分开,表现出较高的鉴别效率。这与下列研究结果一致,宋常美等[27]利用21条ISSR引物对64份中国樱桃资源多样性进行分析,得到引物的多态性比例为87.28%;艾呈祥等[28]对34份樱桃资源进行ISSR分析,得到多态性比率为95.97%;Shahi等[29]通过ISSR对伊朗的野生樱花资源多样性研究,得出其多态性比率均大于81.80%;这些研究均证明ISSR标记可以将樱花种质资源区分开,可作为资源鉴定的有效手段。95份樱花种质资源基于遗传相似系数的UPGMA聚类分析(图2)表明,遗传背景相近的樱花资源其彼此间遗传相似系数较大,遗传距离较小,具有较近的亲缘关系。A类群为华中樱类群,其中毛萼华中樱和华中樱桃聚在一起,说明作为华中樱桃变种,其与原种亲缘关系较近,原种中与YZ16号华中樱桃的亲缘关系最近,这符合原种与变种的变异原则。在C类群中,山樱花和其变种毛叶山樱花也聚在了一起,形成C1类群;毛叶山樱花、尾叶樱桃和浙闽樱桃聚为C2类群。同时,调查时发现浙闽樱桃的叶片和花部形态特征与毛叶山樱花、尾叶樱的有一定的相似性,处于中间过渡类型,因此,YZ82和YZ85可能不是浙闽樱桃,而是尾叶樱桃和毛叶山樱花的杂交后代,这有待进一步深入研究。D类群为大叶早樱类群,YZ30和YZ35号大叶早樱没有聚到D类群里,而是聚到了B3类群里;这2份资源虽然形态特征上接近大叶早樱,但其与D类群中大叶早樱的亲缘关系相对较远,这可能是繁殖过程中部分单株发生了遗传变异,从而形成一些独特的遗传组成[30]。

Figure 2 UPGMA dendrogram ofspp. based on genetic similarity coefficients
综上所述,本研究通过ISSR标记的方法,筛选出17条多态性好的引物,在分子水平揭示了所收集到的浙江省野生樱花种质资源具有丰富的遗传多样性;并基于遗传相似系数将95份种质资源分为华中樱类群、大叶早樱类群等四大类。本研究证明了ISSR分子标记是分析樱花种质资源遗传多样性十分有效的方法,通过其遗传多样性和亲缘关系的研究可为今后浙江省野生樱花资源的保护和利用提供理论依据,为后期新品种选育提供花色艳、花量大、抗逆性强的亲本材料。
[1] Li C L,Bruce B. Flora of China. Volume 9: Pittosporaceae through Connaraceae[M]. Beijing:Science Press,2003:404-420.
[2] 中国科学院中国植物志编委会. 中国植物志[M]. 北京:科学出版社,1986:41-87.
[3] 韦直,何业祺. 浙江省植物志[M]. 杭州:浙江科学技术出版社,1993:239-252.
[4] 王贤荣. 中国樱花品种图志[M]. 北京:科学出版社,2014:80-82.
[5] 李达,于晓英,吴莉英,等. 观赏植物分子标记研究进展[J]. 生物技术通讯,2007,18(6):1060-1063.
[6] Anthony F,Bertrand B,Quiros O,. Genetic diversity of wild coffee (L.) using molecular markers[J]. Euphytica,2001,118(1):53-65.
[7] Warnakula W A D L,Kottearachchi N S,Yakandawala K. Morphological, SSR and ISSR marker based genetic diversity assessment of mountain papaya germplasm in comparison with[J]. J Nat Sci Found Sri Lanka,2017,45(3):255-264.
[8] Zietkiewicz E,Rafalski A,Labuda D. Genome fingerprinting by simple sequence repeat (SSR)-anchored polymerase chain reaction amplification[J]. Genomics,1994,20(2):176-183.
[9] Baruah J,Gogoi B,Das K,. Genetic diversity study amongstspecies from NE-India using RAPD and ISSR markers[J]. Ind Crop Prod,2017,95(1):235-243.
[10] 童俊,周媛,毛静,等. 鸢尾属部分园艺品种遗传多样性的ISSR分析[J]. 北方园艺,2015(10):104-107.
[11] 胡凤荣,胡月苗,王斐,等. 利用ISSR分子标记分析29个风信子品种的遗传多样性[J]. 分子植物育种,2015,13(2):379-385.
[12]罗慧,丁广文,郭启高,等. 基于ISSR标记的44份桃种质资源遗传多样性分析[J]. 西南大学学报:自然科学版,2015,37(5):45-50.
[13] 吴帆,柳新红,蒋冬月,等. 典型樱亚属植物基因组DNA改良提取方法研究[J]. 中国野生植物资源,2017,36(2):24-27.
[14] 陈宗游,黄夕洋,唐辉,等. 广西甜茶种质资源遗传多样性的ISSR分析[J]. 园艺学报,2017,44(1):161-169.
[15] Williams J G,Kubelik A R,Livak K J,. DNA polymorphisms amplified by arbitrary primers are useful as genetic markers.[J]. Nucl Acid Res,1990,18(22):6531-6535.
[16] 李宗艳,秦艳玲,蒙进芳,等. 西南牡丹品种起源的ISSR研究[J]. 中国农业科学,2015,48(5):931-940.
[17] 夏至,周艳,王璐静,等. 月季花、玫瑰及其近缘种ISSR分析与鉴定[J]. 中草药,2016,47(24):4433-4438.
[18] 罗清,卢业飞,於艳萍,等. 24份杜鹃属植物的ISSR分子鉴定[J]. 西北林学院学报,2016,31(3):154-158.
[19] Badenes M L,Parfitt D E. Phylogenetic relationships of cultivated Prunus species from an analysis of chloroplast DNA variation[J]. Theor App Genet,1995,90(7-8):1035-1041.
[20] 曹东伟,蔡宇良,杨娟,等. 中国樱桃的PCR-RFLP分析[J]. 西北农林科技大学学报:自然科学版,2007,35(5):173-178.
[21] Gerlach H K,Stösser R. Patterns of random amplified polymorphic DNAs for sweet cherry (L.) cultivar identification.[J]. Angewandte Bot,1997,71(5):212-218.
[22] 周春玲,陈芳,韩德铎,等. 青岛市19个樱花品种的RAPD分析[J]. 西北植物学报,2007,27(12):2559-2563.
[23] Hormaza J I. Early selection in cherry combining RAPDs with embryo culture[J]. Sci Hor,1999,79(1–2):121-126.
[24] Antonius K,Aaltonen M,Uosukainen M,. Genotypic and phenotypic diversity in Finnish cultivated sour cherry (L.)[J]. Genet Res Crop Evol,2012,59(3):375-388.
[25] Kato S,Matsumoto A,Yoshimura K,. Origins of Japanese flowering cherry () cultivars revealed using nuclear SSR markers[J]. Tree Genet Genom,2014,10(3):477-487.
[26] 商韬,王贤荣,南程慧,等. 基于SSR标记的迎春樱自然居群遗传多样性分析[J]. 甘肃农大学报,2013,8(6):04-109.
[27] 宋常美,文晓鹏,杨尔泰. 贵州樱桃种质资源的ISSR分析[J]. 园艺学报,2011,8(8):531-1538.
[28] 艾呈祥,张力思,李国田,等. ISSR标记对34份樱桃种质资源的遗传分析[J]. 中国农学通报,2008,24(4):47-51.
[29] SHAHI-GHARAHLAR A,ZAMANI Z, FATAHI R,. Estimation of genetic diversity in some Iranian wildsubgenusaccessions using inter-simple sequence repeat (ISSR) markers [J]. Biochemical Systematics & Ecology,2011,39(4):826-833.
[30] 陈红,杨鑫,安华明,等. 贵州桃种质资源遗传多样性的SCoT分析[J]. 西北植物学报,2014,34(8):1559-1564.
Genetic Diversities ofspp. from Zhejiang Province Based on ISSR Markers
JIANG Dong-yue1,2,SHEN Xin1,WU Fan1,LI Yin-gang1,SHI Cong-guang1,YANG Shao-zong1,LIU Xin-hong1
(1. Zhejiang Academy of Forestry, Hangzhou 310023, China; 2. Institute of Botany, Chinese Academy of Sciences, Beijing 100093, China)
Collections of 95 germplasm resources ofspp. were carried out in May and June of 2016 from 14 counties of Zhejiang province. Experiments were implemented for their genetic diversities using 17 ISSR (inter simple sequence repeat) markers from 100 ones. The results showed that 110 bands were amplified by 17 primers, in which 101 bands were polymorphic with average percentage of ISSR polymorphism of 91.78 %. The genetic similarity coefficients of tested resources ranged from 0.38 to 0.90, with an average of 0.61. The genetic distances ranged from 0.10 to 1.38, with an average of 0.5. UPGMA (unweighted pair-group method with arithmetic means) analysis demonstrated that 95 germplasm resources could be divided into four categories when genetic similarity coefficient was 0.5775. The results indicated that there were rich genetic diversities inspp.from Zhejiang.
spp.; germplasm resources; ISSR; genetic diversity
10.3969/j.issn.1001-3776.2018.04.001
S685.99
A
1001-3776(2018)04-0001-07
2017-10-29;
2018-03-26
浙江省樱亚属遗传多样性研究(2017F30017);国产樱花新品系无性快繁技术体系研发(2016F50024);浙江省十三五林木新品种选育项目(2016C02056-12)
蒋冬月,助理研究员,从事园林植物应用研究;E-mail:jdyzjforestry@163.com。
柳新红,研究员,从事林木育种研究;E-mail:sliuxh@163.com。
