三种影像学检查方法在术前评估子宫内膜癌高危因素中的价值
2018-11-09田思娟赵敏伊田雪叶杨筱凤
杨 婷,田思娟,李 扬,赵敏伊,田雪叶,王 玮,赵 娟,杨筱凤*
(1西安交通大学第一附属医院妇产科,西安 710061;2中日友好医院妇产科;*通讯作者,E-mail:yxf73@163.com)
子宫内膜癌是世界范围内排名第6位的高发恶性肿瘤,每年有29万的新发病例。子宫内膜癌发病的累积风险在高收入地区是1.6%,在低收入国家是0.7%[1]。治疗策略以手术为主,基本术式是全子宫+双附件切除术,有高危因素者需要同时施行盆腔+腹主动脉旁淋巴结切除术。2015国际妇产科联盟(FIGO)指南推荐的高危因素有:①肿瘤低分化(G3);②50%以上肌层浸润;③淋巴脉管浸润;④非子宫内膜样腺癌(浆液性癌,透明细胞癌,未分化癌,小细胞癌等);⑤宫颈间质浸润。肿瘤肌层、宫颈和淋巴结的浸润术前只能通过影像学的检查、术中标本剖视或者术中冰冻病理学检查确定。对于如何在术前选择一个最佳的影像学评估手段和标准,业界目前尚没有共识。
目前常用的影像学检查方法包括:磁共振、二维经阴道超声(2D-TVS)和三维经阴道超声(3D-TVS)。因为MRI对于软组织有很好的对比分辨能力,因此被认为是子宫内膜癌术前评估最准确的影像学方法[2,3],2D-TVS是妇产科最常用的检查方法,普遍推广并价格低廉。3D-TVS于肌层浸润的评估有很多的优势,冠状切面对于宫角部的肌层浸润判断更有意义,而且3D技术可以增加组织的对比度,更有利于判断病灶的界限。
本研究比较MRI、2D-TVS和3D-TVS在术前对子宫内膜癌深肌层浸润、宫颈浸润和淋巴结转移的评估价值,旨在为患者选择最佳的术前分期的检查方法,制定个体化的手术方式。
1 对象与方法
1.1 研究对象
回顾性分析2013-01~2015-12在西安交通大学第一附属医院妇产科住院已确诊的子宫内膜癌患者314例。其中,182例术前进行MRI检查,314例接受了二维超声检查,78例进行了三维超声检查。所有患者均按照2009年FIGO子宫内膜癌指南早期没有高危因素者施行全子宫+双附件切除术,合并高危因素的患者同时行盆腔+腹主动脉旁淋巴结切除术,Ⅱ期患者建议行广泛性全子宫+双附件切除术+盆腔淋巴结清扫术,Ⅲ期和Ⅳ期的患者行肿瘤细胞减灭术。子宫内膜浆液性或者透明细胞癌行大网膜切除术。术后病理标本由西安交通大学第一附属医院资深病理专家遵循WHO2000妇科生殖系统肿瘤标准诊断[4]。
1.2 盆腔MRI检查
使用3T磁共振(Signa HDx 3.0T,GE Medical Systems),采用8通道相控阵线圈及Trosopa盆腔相控阵表面线圈。患者检查时采用仰卧位并保持膀胱部分充盈。MRI肌层浸润诊断的标准是结合带是否破坏或者中断。如果结合带可见,看到光滑连续的子宫内膜-肌层表面,判定没有肌层浸润。如果子宫内膜与肌层间的低信号强度环状结合带不规则或不完整则提示肌层浸润。如果肿瘤在T2W上的信号强度大于一半,则为深肌层浸润。淋巴结在短轴上的直径>10 mm被认为病理性的。所有的诊断都经过我院3位资深影像科医师共同阅片制定。
1.3 盆腔2D-TVS检查
超声检查使用GE Voluson E8多频经阴道探头(5-9 MHz)。患者排空膀胱并膀胱截石位,由同一观察者(TXY)完成图像扫查,在B-型超声评估后,二维能量多普勒评估内膜或者肌层的血管化以及肌层浸润和宫颈浸润的深度。
1.4 盆腔3D-TVS检查
在矢状面上获取1-3个3D体积并存储下来。3D取样框覆盖子宫,设置扫查角度能包揽整个子宫体和宫颈。应用4D浏览(版本10.2 GE医疗)进行约1 cm厚度体积的VOCAL自动分析。肌层浸润深度判断标准:①内膜和肌层交界处完整判定为肿瘤局限于内膜;②正常肌层的最薄处在矢状面、轴向和冠状面上均小于肌层厚度的一半判定为肌层浸润深度不超过50%;③正常肌层的最薄处在矢状面、轴向和冠状面上超过肌层厚度的一半判定为肌层浸润深度大于50%;④恶性肿瘤组织扩展至浆膜层判定为浸润超过了子宫浆膜层。宫颈受累的情况的判断标准:①宫颈内口到宫颈外口完整判定为宫颈未受累;②宫颈被肿瘤破坏或者宫颈管因肿瘤组织生长而膨大,并且其被阴道探头加压也不移动者则判定为受累。
1.5 统计分析
使用SPSS 18.0软件进行数据分析,以手术后病理为最终判定标准,将三种检查所得出的结果与之进行比较,计算出MRI、2D-TVS和3D-TVS检查在评估浸润情况中的灵敏度、特异度、阴性预测值(NPV)、阳性预测值(PPV)和准确度。用McNemar test检验比较诊断的准确度,P<0.05认为差异有统计学意义。
2 结果
2.1 一般资料
患者的平均年龄为54.1岁(32-78岁),根据FIGO2015分期标准:277例患者为Ⅰ期,12例患者为Ⅱ期,23例为Ⅲ期,2例为Ⅳ期。子宫内膜样腺癌者256例,黏液腺癌者6例,12例为浆液性腺癌,3例为透明细胞癌,13例为混合性癌。
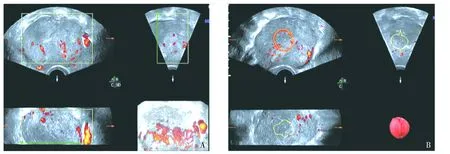
240例肌层浸润小于50%,74例肌层浸润大于50%,10例有宫颈间质的浸润,119例进行了盆腔淋巴结的切除,其中13例有盆腔淋巴结的转移。深浅肌层浸润、宫颈浸润和淋巴结转移患者的典型磁共振影像学表现见图1,浅肌层浸润的子宫内膜癌患者的三维超声表现见图2。

A.一名53岁的绝经前ⅠA期患者,箭头所指为浅肌层浸润;B.55岁的绝经后ⅠB期患者,箭头所指为深肌层浸润;C.60岁的的Ⅱ期子宫内膜癌患者,箭头所指为宫颈间质浸润;D.48岁的绝经前Ⅲc期子宫内膜癌患者,有淋巴结转移,箭头所指为病变淋巴结
A.从不同切面选取3个图像并存储下来 B.VOCAL软件自动分析病灶浸润至肌层新生血管的血管化指数,分析肌层浸润深度,结果显示为浅肌层浸润
2.2 三种影像学技术对于深肌层的浸润、宫颈浸润和淋巴结转移的预测价值
通过与术后病理结果的对比,研究MRI、2D-TVS、3D-TVS预测深肌层的浸润灵敏度和特异度,结果表明MRI和3D-TVS诊断深肌层浸润的灵敏度(89.19%vs86.36%)、准确度(89.01%vs89.74%),明显高于二维超声(70.27%,71.02%),差异有统计学意义(P<0.05,见表2)。MRI、2D-TVS、3D-TVS对于宫颈浸润的预测比较,MRI和3D-TVS诊断宫颈浸润的灵敏度是(75.00%vs77.78%)、准确度(91.20%vs92.40%),高于2D-TVS(35.29%,84.39%),差异有统计学意义(P<0.05,见表3)。MRI与3D-TVS两种诊断方法对于预测深肌层浸润和宫颈浸润的比较,差异无统计学意义(P>0.05)。三种检查方法对于宫颈浸润的灵敏度都不理想。

表1 患者的临床病理特征Table 1 Characteristics of patients with endometrial cancer

表2 MRI、2D-TVS、3D-TVS评估深肌层浸润情况Table 2 Comparison of MRI, 2D-TVS and 3D-TVS results with histologic findings on deep myometrial invasion

表3 MRI、2D-TVS、3D-TVS评估宫颈间质浸润情况Table 3 MRI, 2D-TVS and 3D-TVS in preoperative evaluation for cancer in detecting cervical invasion
与术后病理结果比较,MRI对于淋巴结转移的预测,灵敏度、特异度、阳性预测值、阴性预测值和准确度为58.33%,96.26%,63.63%,95.37%和92.43%(见表4)。
术前联合影像学检查与术后病理结果比较显示,MRI、2D-TVS、3D-TVS三者联合预测深肌层浸润的灵敏度为98.2%,特异度为32.5%,阳性预测值为38.9%,阴性预测值为98.6%,诊断宫颈浸润的灵敏度为83.5%,特异度为65.1%,阳性预测值为40.2%,阴性预测值为90.1%,联合两种或者多种方法对于深肌层浸润和宫颈浸润的灵敏度较单用一种检查方法高(P<0.05),但同时特异度不高(见表5)。

表4 MRI诊断淋巴结浸润的预测价值Table 4 Preoperative evaluation of MRI in lymph node metastases

表5 联合检查在预测深肌层浸润和宫颈浸润中的价值 (%)Table 5 Predictive value of combined detection for deep myometrial invasion and cervical invasion in endometrial cancer patients (%)
3 讨论
寻找合理的非侵入性检查能在术前精准判断子宫内膜癌的分期可以为患者提供最佳的手术方式、降低手术范围过大造成的手术并发症。近期人们尝试利用MRI和3D-TVS评估病灶肌层浸润和宫颈浸润的程度,Manfredi等[5]的资料显示:传统MRI联合增强MRI诊断深肌层的灵敏度、特异度、PPV和NPV为87%,91%,87%和91%。Hwang等[6]发现MRI判定子宫内膜癌深肌层的灵敏度较低(50%-84%),而特异度较高(50%-100%)。不同研究团队利用MRI和2D-TVS对于深肌层浸润的准确度,灵敏度从50%到89%,特异度从81%到100%不等[7-12]。在本研究中,对于深肌层浸润的判断,MRI的灵敏度、特异度分别是89.19%,88.97%,而PPV、NPV、准确度依次为67.35%,97.99%和89.01%。3D-TVS对于深肌层浸润的判定的灵敏度、特异度为86.36%,91.07%,而PPV、NPV、准确度依次为79.17%,94.44%和89.74%。2D-TVS的这些指标中,灵敏度、特异度是70.27%和71.25%,而PPV、NPV、准确度达到42.98%,89.53%和71.02%。通过对比可以发现,3D-TVS和MRI诊断的灵敏度、特异度、阳性预测值、阴性预测值和诊断的准确度都高于2D-TVS,总体在评价深肌层浸润的情况时较理想,但是这三项检查诊断深肌层浸润的阳性预测值都不高,3D-TVS 79.17%,MRI 67.35%,2D-TVS只有42.98%,这可能与深肌层浸润总体样本量少(37例)有关。3D-TVS能形象、直观地观察肿物内血流灌注的状态和立体结构的空间位置关系,可定量分析感兴趣区内的彩色亮度及灰阶值,在对于深肌层浸润的判断上相比较2D-TVS有很强的优势,MRI由于具有对软组织分辨率高、能够多方位及多序列成像等优势,目前已被广泛认为是一种可以用于子宫内膜癌诊断、分期以及指导治疗和随访的可靠方法[13-15]。MRI联合3D-TVS对于深肌层浸润诊断的灵敏度更高,达到96.5%。
Cicinelli等[12]和Rockall等[16]的研究中,评估宫颈浸润磁共振的灵敏度范围为19%-100%,特异度87%-100%,波动范围很大,我们的研究提示MRI预测宫颈浸润的灵敏度、特异度是75%与92.35%;3D-TVS分别为77.78%与94.29%;2D-TVS为35.29%与87.2%。三者相比,MRI、3D-TVS对于宫颈浸润的灵敏度相比较对于深肌层浸润的灵敏度来说均较低,两者联合应用可以使灵敏度提高到83.5%。但是特异度较高,都在90%以上,表明他们排除非宫颈浸润还是有一定的优势,我们的研究中MRI和3D-TVS对于宫颈间质浸润的灵敏度和特异度在检索到的文献中属于偏高的,现在宫颈浸润特指宫颈间质的浸润,而在2009年以前的FIGO指南中,宫颈黏膜浸润也属于宫颈浸润,而磁共振对于宫颈间质浸润判断相比较宫颈黏膜的浸润要更清晰和容易一些,所以我们研究的灵敏度和特异度较高与此有一定的关系。因为宫颈浸润需行宫颈癌根治术,而诊刮术不能很好地判断是否存在宫颈间质的浸润,所以推荐术前联合应用MRI和3D-TVS作为评估宫颈浸润很好的方法,当然这也需要多中心大数据的支持以及磁共振和超声医生水平的提高。
相较于2D-TVS和3D-TVS都不能预测淋巴结的转移的劣势,MRI对于淋巴结预测的灵敏度有报道为46%-56%,特异度为88%-95%[17,18]。我们研究结果显示MRI对于预测淋巴结转移的灵敏度、特异度58%,96%,PPV,NPV和准确度为63%,95%和92.43%。MRI对于淋巴结转移的灵敏度不高的原因在于只有增大淋巴结超过10 mm磁共振才能发现。有学者提出采用FDG PET/CT的方法检测葡萄糖代谢在淋巴结中的差别[19]。目前关于PET/CT在子宫内膜癌淋巴结转移中的评估作用的报道很少,Signorelli等[20]、Horowitz等[21]和Kitajima等[22]报道它诊断的灵敏度是53.3%-63%,特异度为94.7%-99.6%。与我们的研究结果相比,并没有表现出更好的优势。
在术前预测子宫内膜癌患者深肌层浸润、宫颈间质的浸润以及淋巴结的转移对于精准制定手术方案至关重要。本研究发现,MRI和3D-TVS对于深肌层浸润和宫颈浸润的评估的准确度、灵敏度是优于2D-TVS的,联合使用能够显著提高灵敏度,能够较好地指导手术医生选择合适的手术方式。而对于淋巴结转移的评估主要还是依赖于磁共振检查。Lin等[23]的研究发现磁共振动态增强扫描(MRI-DCE)对于绝经前子宫内膜癌患者的深肌层浸润预测上表现出优势,而共振弥散加权成像(MRI-DWI)对于绝经后患者更佳。Tanaka等[24]的研究则显示术中冰冻对于深肌层浸润判断比磁共振更有优势。Antonsen等[25]的研究发现PET-CT对于术前深肌层浸润、宫颈间质浸润和淋巴结浸润判断的各项指标都高于磁共振和二维超声。所以,MRI-DWI、MRI-DCE、FDG PET/CT和术中冰冻病理检查也是术前辅助检查评估子宫内膜癌高危因素的热点。此外,Jantarasaengaram等[26]和Christensen等[27]研究运用三维超声VCI的多维模式来发现更好的图像处理方法提高诊断的灵敏度。
总之,术前磁共振和三维超声是预测深肌层浸润和宫颈浸润很好的方法,利于子宫内膜癌患者术前准确分期,避免不必要扩大手术范围,规避相应风险,有利于个体化地治疗子宫内膜癌。
