再探图示法解决质子守恒
2018-11-08李鹏飞
李鹏飞
(安徽省安庆野寨中学 246309)
电解质溶液的三大守恒—电荷守恒、物料守恒、质子守恒是历年高考的热点与难点,而大学数学生书写溶液的质子守恒时,通常利用电荷-物料守恒法得到,导致此类题目的错误率较高.因而出现了新的方法—图示法,图示法近几年得到了很大的推广,例如:2012年,刘文兵、韩善芳老师用图示法分别分析了Na2CO3单一溶液和NaHCO3单一溶液的质子守恒.2013年,林飞、戴洁老师指出图示法是解决混合溶液质子守恒的最佳方法.2014年,杨青山、叶漫、朱方仕老师指出图示法书写混合溶液的质子守恒,不仅适用于单一溶液、浓度相等的混合溶液,也适用于浓度不同的混合溶液.
下面通过实例对图示法进行研究.
一、单一溶液的质子守恒
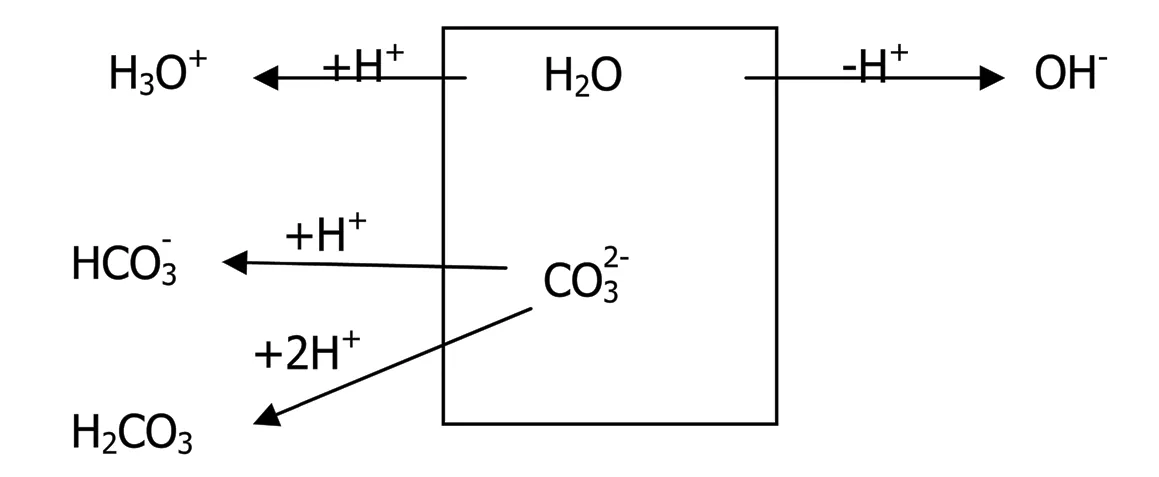
例1 写出Na2CO3溶液的质子守恒.
1.图示法
2.电荷-物料守恒法



点评此例中,图示法解决质子守恒直观简洁,不易出错,并能反映质子守恒的本质,对于其它的单一溶液,例NaHCO3溶液、NaH2PO4溶液、Na2HPO4溶液、(NH4)2CO3溶液等,图示法均能很快的写出质子守恒.
二、无共轭酸碱体系的混合溶液
例2 书写0.1mol/L CH3COONa、0.1mol/L Na2CO3混合溶液的质子守恒.
1.图示法

2.电荷-物料守恒法
物料守恒:3[c(CH3COOH)+c(CH3COO-)]=c(Na+) ②




点评此例中,两个方法得到的结果一致,电荷-物料守恒法过程非常繁杂,但利用此法可以得到3个质子守恒式,而图示法只能得到1个质子守恒.因此,有时电荷-物料守恒法解决无共轭酸碱混合体系的混合液的质子守恒时有不可替代的作用.
三、共轭酸碱体系的混合液
例3 书写0.1mol/L CH3COOH与0.1mol/L CH3COONa混合溶液的质子守恒.
1.电荷-物料法
c(H+)+c(Na+)=c(OH-)+c(CH3COO-) ①
c(CH3COOH)+c(CH3COO-)=2c(Na+) ②
由①②得:2c(H+)+c(CH3COOH)=2c(OH-)+c(CH3COO-)
2.图示法
2013年,林飞老师在《用图示法解决混合溶液中质子守恒题》中指出:用图示法解决共轭酸碱体系的混合液时需要选择2个参考水准.
分别选择CH3COOH和H2O、CH3COO-和H2O两个参考水准:

c(H+)=c(OH-)+c(CH3COO-)-0.1 ③
(注意原溶液中有0.1mol/L的CH3COO-,所以CH3COO-的浓度要减去0.1)

c(H+)+c(CH3COOH)-0.1=c(OH-) ④
(注意原溶液中有0.1mol/L的CH3COOH,所以CH3COOH的浓度要减去0.1)
由③④得2c(H+)+c(CH3COOH)=2c(OH-)+c(CH3COO-)
点评用图示法解决共轭酸碱体系混合液首先需要选择2个参考水准,过程比电荷-物料法复杂,不易被学生掌握.还有为什么选择两个参考水准就能得到正确的质子守恒呢?在CH3COOH与CH3COONa混合液中,CH3COOH发生电离,CH3COO-发生水解,因此1个图示写不出质子守恒.但若考虑净过程,则问题就变得简单了,若CH3COOH的电离浓度大于CH3COO-的水解浓度,则认为只发生CH3COOH的电离,没有CH3COO-的水解,H2O电离的c(H+)=c(OH-),CH3COOH电离的c(H+)=c(CH3COO-)-0.1,即③式;若CH3COO-的水解浓度大于CH3COOH的电离浓度,则认为只发生CH3COO-水解,没有CH3COOH电离,H2O电离的c(OH-)=c(H+),CH3COO-水解的c(OH-)=c(CH3COOH)-0.1,即④式.③和④相当于两种极限状态,但实际上表达的是同一溶液的质子守恒,两个式子是等效的,因此可以得到正确的结论.
通过对图示法解决共轭酸碱共轭体系混合液的质子守恒的原理探究,笔者发现:溶液中的质子守恒与过程无关,只与溶液的始末状态有关,类似与化学平衡状态与投料方式无关.因此提出了一种解决混合溶液中质子守恒的新方法—等效拆分法.若将混合溶液中的离子拆成H+和其它离子或拆成OH-和其它离子,分别得到的质子守恒应该也是等效的.
四、等效拆分法解决混合溶液的质子守恒
例4 写出0.2mol/L的CH3COOH与0.1mol/L CH3COONa混合溶液的质子守恒.
将原溶液拆成0.2mol/LH+与0.3mol/LCH3COO-溶液可得:
c(H+)-0.2+c(CH3COOH)=c(OH-) ①
将原溶液拆成0.3mol/L的CH3COOH与0.1mol/LOH-溶液可得:
c(H+)=c(OH-)-0.1+c(CH3COO-) ②
由①②得:3c(H+)+c(CH3COOH)=3c(OH-)+2c(CH3COO-),这与电荷-物料守恒法得到的结论一致.
例5 写出0.1mol/L Na2CO3与0.1mol/L NaHCO3混合溶液的质子守恒.





例6 写出0.1mol/LNH4Cl与0.1mol/LHCl混合溶液的质子守恒.
可得:c(H+)-0.1=c(OH-)+c(NH3·H2O) ①
将溶液拆成:0.1mol/L NH3·H2O与0.2mol/L H+


不同的方法适用于不同的溶液的质子守恒.对于单一溶液,图示法过程直观简洁,不易出错,而且能反映出质子守恒的本质.对于无共轭酸碱体系的混合溶液,图示法仍然简洁直观,但只能得到1个质子守恒,而电荷-物料法可得到多个质子守恒的等效式.对共轭酸碱体系的混合溶液,图示法的过程与电荷-物料法相差不大,此时用等效拆分法可以很快的写出质子守恒.
