基于高通量测序的草莓酒发酵过程中的细菌群落分析
2018-11-08王明跃张新红孙晓璐刘文福王士华
张 源,兰 伟,王明跃,张新红,孙晓璐,刘文福,王士华
1.阜阳师范学院生物与食品工程学院,阜阳,236037;2.阜阳职业技术学院生化工程系,阜阳,236031;3.阜阳市鸿福农业科技股份有限公司,阜阳,236127;4.阜阳市颍泉区农产品质量安全检验检测站,阜阳,236000
针对草莓酒的初步研究发现,利用单一酵母菌种发酵酿制的草莓酒酒质纯净但口感较为淡薄,而自然发酵酿制的草莓酒虽然口感偏酸,但香味更丰富,口感也更醇厚[1-2]。表明草莓酒自然发酵过程中复杂的自然菌群对草莓酒的酿制具有积极作用。因此,研究草莓酒发酵过程中的自然菌群,阐明其群落结构及组成,是后续深入研究草莓酒酒体特征形成机理的基础,对弥补单一菌种发酵的产品缺陷,提升草莓酒品质具有重要意义。
此前,有关微生物群落及其多样性的研究主要基于传统的微生物分离及纯培养技术、荧光定量PCR技术[3]、变性梯度凝胶电泳技术(DGGE)[4]、末端限制性片段长度多态性分析技术(TRFLP)[5]等。但上述研究方法往往难以得到确切的微生物种类及其绝对含量[6]。高通量测序技术近年来发展迅速,该技术可快速、准确、全面地解析样本中的微生物群落,在环境微生物、食品微生物等研究中应用广泛[7-9],但基于发酵过程的研究较少,特别是果酒自然发酵过程中的细菌群落研究鲜有报道。研究表明,除酵母菌以外,细菌同样会对发酵过程产生重要影响。如:葡糖杆菌属(Gluconobacter)细菌在葡萄酒酿造过程中产生乙酸,对葡萄酒感官品质产生不利影响[10],而乳杆菌属(Lactorbacillus)细菌的苹果酸代谢则会导致葡萄酒产生异味[11-12]。因此,本研究利用高通量测序技术,对草莓酒发酵初、中、末期的细菌群落及其变化规律进行研究,以期从宏观上了解草莓酒发酵过程中的细菌群落,分析其对草莓酒品质的影响,为后续研究提供参考。
1 材料与方法
1.1 材 料
草莓品种为“甜查理”,于2017年4月24日采收于阜阳市颍泉区闻集镇文福草莓种植专业合作社。白砂糖(市售);破碎机(合肥大汉酿酒设备有限公司)灭菌10 L发酵罐(烟台帝伯仕自酿机有限公司);控温培养箱(LRH-70,上海-恒科学仪器有限公司)。
1.2 方 法
新鲜草莓经破碎机破碎打浆,皮渣分离后,装入无菌发酵罐。加入鲜重20%的白砂糖,25℃条件下自然发酵。在超净工作台内分别采集发酵初期(第2天)、发酵中期(第8天)和发酵末期(第16天)的发酵样品。样品设两个平行(初期A011,A012;中期 A021,022;末期 A031,A032),所取样品 -20℃冻藏保存,后送往上海派森诺生物科技股份有限公司武汉分公司进行测序,测序平台为 Illumina Miseq。
根据测序结果进行Alpha多样性指数分析,衡量样本物种多样性及组间样本差异。根据每个样本在各分类水平的具体组成,分析不同发酵时期样本的群落结构及群落组成的动态变化及差异。并在属的分类水平上分析可能对草莓酒品质产生重要影响的关键细菌类群。
测定发酵过程中(第 1,3,6,10,16天)的总糖、还原糖和总酸,测定方法参照GB/T15038-2006,酒精度测定参照GB5009225-2016。
2 结果与分析
2.1 实验样本的选择与草莓酒自然发酵进程
由于果酒发酵过程中的微生物主要来源于果实附着的环境微生物,因此,不同地区、不同气候条件、不同季节,果实表面附着的微生物种群均存在一定差异[13-14]。但在草莓酒的生产中,由于企业主要选择每年4~5月份草莓集中上市,价格低廉时组织生产,且为了使发酵后的草莓酒便于储存,往往添加较高比例的蔗糖(通常为15%~20%),以获取较高的酒精含量。因此,本研究选择了4月底的草莓样本,添加20%蔗糖的实验条件,以反映本地区该时间段草莓酒发酵过程中的细菌群落情况。
结果显示:在25℃条件下,第1~3天启动发酵。第3~10天快速发酵,酒精度由2.0°快速升至12.1°。第10天后,酒精度缓慢升至 13.2°,发酵基本结束。发酵过程中,总糖呈快速下降趋势,还原糖呈先升高后降低趋势,总酸与pH值变化不明显(见表1)。

表1 草莓酒自然发酵不同阶段的理化指标
2.2 宏基因组16S rDNA测序结果
2.2.1 OTU聚类及样本复杂性分析
通过高通量测序,在发酵初、中、末期共得到的有效序列数、聚类得到OTU数见表2,稀疏曲线见图1。
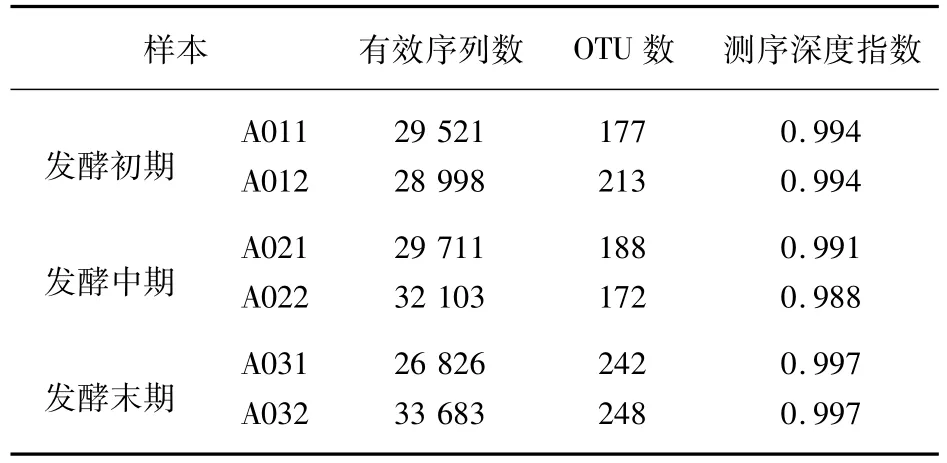
表2 有效序列数及OTU聚类
从表2和图1可知,随着测序数量的增加,稀疏曲线逐渐趋于平缓,表明测序结果已足够反映当前样本所包含的多样性,继续增加测序深度也无法检测到更多新的OTU。从测序深度指数可以看出,本实验的测序数据量已足够大,基本可以反映草莓酒发酵过程中的绝大多数细菌信息。
为了比较不同样本的多样性,首先对OTU丰度矩阵中的全体样本在90%的最低测序深度水平统一进行随机重抽样,从而校正测序深度引起的多样性差异。随后,使用QIIME软件分别对每个样本计算4种多样性指数。结果如表3所示。

图1 稀疏曲线

表3 草莓酒自然发酵不同阶段的细菌A lpha多样性
物种丰富度指数Chao1与ACE值在发酵初、中、末期呈现先升高后降低的趋势,显示发酵中期的物种最丰富。物种多样性指数Shannon和Simpson值在发酵末期最低,菌群结构趋于简单。这表明,草莓酒自然发酵过程中的绝大多数细菌比较适宜在发酵中期较低的酒精度和中等水平含糖量条件下生存,高的初始糖分与高酒精度环境均会抑制其生长繁殖。
2.2.2 细菌群落结构及动态变化
(1)门、纲、目、科分类水平的细菌群落结构
OTU物种注释结果显示,草莓酒自然发酵过程中的细菌分别属于5个菌门,11个纲,18个目,47个科、86个属。
在门的分类水平,变形菌门(Proteobacteria)细菌在草莓酒自然发酵的初、中、末期始终是绝对优势菌群,其丰度占到整个菌群的98.9%~99.6%。厚壁菌门(Firmicutes)虽然是第二大菌群,但其平均占比仅有0.3%~0.75%(见图2A)。在科的分类水平,肠杆菌科(Enterobacteriaceae)细菌在发酵的初、中、末期始终是绝对优势菌群,其丰度占到真个菌群的93.3%~97.6%,显示出草莓酒自然发酵过程中细菌群落结构的高度不均一性。
从图2可以看出,在门、纲、目、科的分类水平,发酵的初、中、末期除α-变形菌纲(Aiphaproteobacteria)、立克次体目(Rickettsiales)外,细菌群落结构并无明显变化(图2 B、C、D),显示出草莓酒自然发酵过程中细菌群落具有相对稳定性。进一步分析显示,mitochondria很可能是草莓果肉细胞中的线粒体基因组干扰所致(图2D)。

图2 发酵过程中草莓酒中菌群在门、纲、目与科水平的注释结果
(2)属分类水平的群落结构及动态变化
如表4所示,在属的分类水平上,细菌群落结构同样表现出高度的不均一性。本研究共检测到86个属,但其中丰度最高的前13个属相对丰度已占整个菌群的97.7%~99%,而其余73个属(Others)的总丰度不及2.4%(表4)。
在属的分类水平上,肠杆菌科的欧文氏菌属(Erwinia)、泛菌属(Pantoea)、未知属(unidentified)和柠檬酸菌属(Citrobacter)细菌是优势菌群,占整个菌群的91.8% ~97.5%(表4)。但在发酵的初、中、末期,属水平的群落结构存在一定差异。其中,欧文氏菌属细菌在发酵过程中呈逐渐上升趋势;而泛菌属与未知属则呈逐渐下降趋势。柠檬酸菌属细菌相对占比较低,在发酵过程中呈现先升高后降低的趋势。但至发酵末期,它们仍保持了相对较高的菌群占比,显示出其对发酵过程中高糖、高酸、高酒精度环境具有一定适应性。
从表4可以看出,其他菌群,如葡糖杆菌属(Gluconobacter)、雷尔氏菌属(Ralstonia)、乳酸球菌属(Lactococcus)、沙雷氏菌属(Serratia)、伯克氏菌属(Burkholderia)等细菌在菌群的占比均较低,且在整个发酵过程中的丰度无明显变化,表明发酵环境抑制其生长繁殖。

表4 属分类水平上的优势菌群及其结构
2.2.3 分类学组成的差异分析及其与草莓酒品质的关系
为进一步分析发酵初、中、末期属水平的菌群差异,使用 Mothur软件,调用 Metastats[15]的统计学算法,对属水平的各个分类单元在发酵初、中、末期之间的序列量(即绝对丰度)差异进行两两比较检验。结果显示,分别有10个属、7个属、6个属存在显著性差异(P<0.05)(见表5)。表明在属水平,细菌群落结构同样具有相对稳定性,存在显著性丰度差异的菌群较少。

表5 不同发酵阶段样本之间的M etastats两两比较检验结果统计表
如表5所示,在发酵初、中、末期存在显著性差异,且菌群丰度较高的有欧文氏菌属、泛菌属、柠檬酸菌属、乳酸球菌属、葡糖杆菌属、雷尔氏菌属等。由于果酒发酵过程中的微生物主要来源于果实附着的环境微生物,草莓酒发酵初期的菌群结构基本代表了草莓果实自然附着的细菌类群,其对酒体的影响主要表现在后续生长繁殖过程中的生理代谢底物、产物及代谢底物、产物的数量。因此,上述优势菌群及其动态变化与草莓酒的风味密切相关。
如表5所示,欧文氏菌属丰度在发酵初期与中期的丰度无显著差异,而发酵中期与末期存在显著性差异,表明欧文氏菌属细菌在发酵中后期存在显著的菌群增殖。柠檬酸菌属细菌丰度在发酵初期与中期存在显著性差异,而初期与末期无显著性差异,表明其在发酵中期存在显著的菌群增殖,但至发酵末期,其丰度又回落到初期的水平。乳酸球菌属细菌丰度在发酵初期与中期,初期与末期存在显著性差异,但中期与末期无显著性差异,表明其在发酵中期存在显著的菌群增殖,随后保持相对稳定的菌群状态。由于它们在发酵过程中均存在显著的菌群增殖过程,其生理代谢必然会对酒体风味产生影响。研究显示,欧文氏菌属细菌可以产生果胶裂解酶[16],可分解果胶,因此,可能与草莓酒的颜色浸提及果酒澄清有关系。某些柠檬酸菌属细菌可产生β-葡萄糖苷酶[17],而β-葡萄糖苷酶可用于果酒增香、脱苦等[18],与自然发酵草莓酒更丰富的香气[1]可能存在一定关系。乳酸球菌属细菌可代谢产生乳酸[11,12],与自然发酵草莓酒中较高的乳酸含量[1]关系密切。
泛菌属丰度在发酵初期、中期与末期均存在显著性差异,表明泛菌属细菌随着发酵的进行经历了持续的菌群衰亡,但至发酵末期仍然保持了较高的菌群丰度。表明其尽管不适应发酵环境,但仍有一定耐受力。有研究发现,泛菌属的Pantoea ananatis可产生香味物质[19]。因此,该类细菌与草莓酒风味形成可能存在关系。但值得注意的是,由于高通量测序技术以微生物DNA作为检测基础,无法区分死细菌与活细菌,因此,发酵末期的酒体中是否真的存在大量泛菌属细菌仍需要传统的培养鉴定方法予以验证。
在草莓酒发酵过程中,葡糖杆菌属丰度无显著差异,柠檬酸菌属细菌虽然在发酵中期存在显著的菌群增殖,但它与葡糖杆菌属细菌在发酵末期的菌群丰度均不高。但葡糖杆菌属细菌能够代谢乙醇产乙酸,而柠檬酸菌属细菌可以利用柠檬酸盐作为唯一碳源代谢柠檬酸,且柠檬酸是草莓果实中最主要的有机酸[1,20],这表明,在发酵末期高乙醇、低糖的条件下,尽管这类细菌的丰度较低,但它们在酒体的后期陈酿过程中可能发挥着更为重要的作用,并与陈酿草莓酒中较高的乙酸含量[1]和较低的柠檬酸含量[1]存在密切关联。
受高通量测序技术的局限性,本研究中肠杆菌科未知属(unidentified)未能得到有效鉴定,尽管其在发酵过程中呈现菌群衰亡趋势,但由于相对丰度较高,该类细菌与草莓酒风味形成可能存在一定关系。对此,仍需依赖传统的微生物分离及纯培养技术对其进行进一步研究。
3 结论
本研究利用高通量测序技术,初步阐明了草莓酒自然发酵过程中的细菌群落结构,并分析了优势菌群与草莓酒酒体特征及风味之间的关系。结果表明:(1)变形菌门、γ-变形菌纲、肠杆菌目、肠杆菌科细菌是草莓酒自然发酵过程中的优势菌群。在属水平,欧文氏菌属、泛菌属、肠杆菌科未知属、柠檬酸菌属、葡糖杆菌属、乳酸球菌属等是草莓酒自然发酵过程中的主要优势属。(2)发酵初、中、末期存在显著丰度差异的菌群较少,细菌群落在发酵过程中具有相对稳定性。(3)发酵过程中的菌群动态分析及属水平的Metastats分析显示,欧文氏菌属、柠檬酸菌属、葡糖杆菌属、乳酸球菌属细菌与自然发酵草莓酒的酒体特征及风味之间存在较为密切的关联。
