玉竹多糖对低氧训练肥胖大鼠血清自由基代谢的影响
2018-11-08洪卫星黄徐根
许 超,洪卫星,蒋 珍,黄徐根
1.铜陵学院体育部,铜陵,244000;2.安徽师范大学体育学院,芜湖,241002
自由基客观存在于机体中,正常情况下自由基的产生与清除处于动态平衡的状态;然而平衡一旦被打破,过多的自由基对人体组织细胞等产生毒害作用,且与多种疾病息息相关[1]。研究表明:肥胖可致自由基清除速率下降[2],适宜的低氧训练可有效改善机体的抗氧化能力[3,4]。近年来,传统中药的研究取得了长足进步,利用天然药物提取物来提高人体抗氧化能力以及抗衰老、抗肿瘤能力等[5-7]成为研究热点。本文以传统中药玉竹提取物玉竹多糖对低氧训练过程中的肥胖大鼠进行干预,研究其血清自由基变化情况,为玉竹多糖在运动训练、大众健身中的开发利用提供理论依据。
1 研究对象与方法
1.1 研究对象
6周龄健康雄性SD大鼠203只(购自上海实验动物中心,许可证号:SCXK(沪)2013-0006),SPF级,体重172.15±11.94 g。分笼饲养,自由饮食,自然采光,通风条件良好,温度(23±2)℃,相对湿度40%~60%。实验期间严格控制饲养条件。
1.2 研究方法
1.2.1 实验条件
采用美国进口的小型低氧发生器(MAG-10)组建低氧帐篷(低氧帐篷面积约6.75 m2,空间体积约9.45 m3),建立氧浓度为13.6%(模拟海拔3500米高度),压强为101 KPa的常压低氧环境;利用动物跑台创造训练条件。
1.2.2 肥胖大鼠模型建立
203只雄性SD大鼠经适应性饲养7天后,随机挑选25只普通饲料饲养,178只高脂饲料饲养(高脂饲料配方为:猪油12%、蛋黄粉8%、白砂糖5%、全脂奶粉8%、胆固醇1%、胆盐0.2%、普通饲料65.8%)。饲养第 18周末,按肥胖标准[8](体重增量大于普通饲料饲养组体重增量均值加上1倍标准差)筛选肥胖大鼠112只。
1.2.3 适应性训练及实验大鼠筛选
筛选出的肥胖大鼠随后进行1周低氧仓适应后,进行为期2周逐渐增加强度的适应训练(训练方案参照赵鹏[4]并稍加修改,第1周适应训练时间为20 min,强度为12~18 m/min;第2周适应训练时间为40 min,强度为18~22 m/min)。经过适应性训练后,对于运动能力极好和极差以及有伤病的大鼠进行剔除,且剔除体重过重和过轻的大鼠,保留56只肥胖大鼠随机分为7组,并从25只普通饲料饲养的大鼠中挑选8只作为正常安静对照组(C组),具体分组安排如表1所示。
1.2.4 大鼠实验分组安排
各训练组大鼠在水平动物实验跑台上进行耐力性练习。低氧条件下进行60 min/d×5d/w×4w的训练,训练强度为20 m/min;常氧条件下进行60 min/d×5 d/w×4w的训练,速度为22m/min。具体实验分组安排见表1。
1.2.5 给药方案
FHLP和FLHP大鼠灌服玉竹多糖溶液(河南中冠建业生物科技有限公司)1 g·kg-1(灌胃方案参照谢建军[7]并稍加修改),其余各训练组大鼠灌服等量的生理盐水,上午训练后1 h灌胃,一周灌胃5次,共4周。
1.2.6 血清自由基指标的测定
4周实验后大鼠采用腹主动脉取血,放入离心管中,37℃水浴箱水浴60 min,3 000 r/min离心20 min,取上层血清,根据南京建成生物工程研究所试剂盒说明,测定血清超氧化物歧化酶(SOD)、过氧化氢酶 (CAT)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛 (MDA)指标。主要仪器:分光光度计(7200型,尤尼柯(上海)仪器有限公司)、酶标仪(A-6半自动生化仪,上海华岩仪器设备有限公司)。

表1 实验大鼠分组情况 n=8
1.2.7 统计分析
采用Office Excel 2010版软件录入以均值±标准差()表示的实验数据,建立数据库。实验数据的统计分析均运用SPSS 22.0软件进行。利用单因素方差分析检验分析样本,其中P<0.05表示显著性差异水平,P<0.01表示极显著性差异水平。
2 结果与分析
2.1 玉竹多糖结合低氧训练对肥胖大鼠血清MDA含量的影响
4周实验后各组大鼠血清MDA含量见表2。从表2可见,正常安静对照组大鼠血清MDA含量与肥胖低住安静对照组相比没有显著性差异(P>0.05);肥胖高住安静对照组大鼠血清MDA含量显著高于肥胖低住安静组、正常安静对照组和肥胖低住低练组(P<0.05);肥胖低住高练组大鼠血清MDA含量与肥胖高住低练组相比组间无显著性差异(P>0.05),但二者均显著高于各肥胖安静对照组和肥胖低住低练组(P<0.05);补充玉竹多糖的各低氧训练组大鼠血清MDA含量均显著低于其对应的各训练组(P <0.05)。
表2 各组大鼠血清抗氧化物酶活性一览表 n=8,
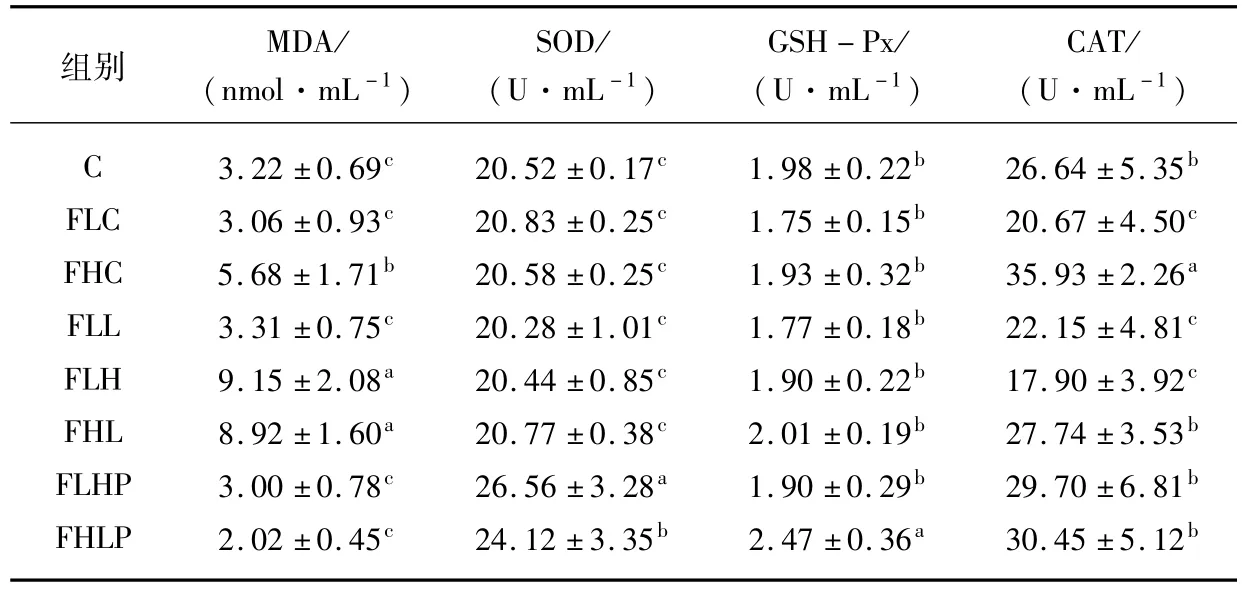
表2 各组大鼠血清抗氧化物酶活性一览表 n=8,
组别 MDA/(nmol·mL-1)SOD/(U·mL-1)GSH-Px/(U·mL-1)CAT/(U·mL-1)C 3.22±0.69c 20.52±0.17c 1.98±0.22b 26.64±5.35b FLC 3.06±0.93c 20.83±0.25c 1.75±0.15b 20.67±4.50c FHC 5.68±1.71b 20.58±0.25c 1.93±0.32b 35.93±2.26a FLL 3.31±0.75c 20.28±1.01c 1.77±0.18b 22.15±4.81c FLH 9.15±2.08a 20.44±0.85c 1.90±0.22b 17.90±3.92c FHL 8.92±1.60a 20.77±0.38c 2.01±0.19b 27.74±3.53b FLHP 3.00±0.78c 26.56±3.28a 1.90±0.29b 29.70±6.81b FHLP 2.02±0.45c 24.12±3.35b 2.47±0.36a 30.45±5.12b
注:应用单因素方差分析中的Duncan检验不同组同一指标,以P<0.05为显著性水平,不同上标间差异显著,且a>b>c。
2.2 玉竹多糖结合低氧训练对肥胖大鼠血清抗氧化物酶活性的影响
4周实验后各组大鼠血清抗氧化物酶活性见表2。可以看出,与正常安静对照组相比,各肥胖安静对照组大鼠血清SOD活性无显著性差异(P>0.05);与各肥胖安静对照组和肥胖低住低练组相比,肥胖低住高练玉竹组和肥胖高住低练玉竹组大鼠血清SOD活性均显著较高(P<0.05);补充玉竹多糖的各低氧训练组大鼠血清SOD活性显著高于其对应的各训练组(P<0.05)。
通过比较发现(表2),各安静对照组大鼠GSH-Px活性组间差异不显著(P>0.05);肥胖高住低练玉竹组大鼠GSH-Px活性显著高于各安静组和肥胖低住低练组(P<0.05);各训练组除肥胖高住低练玉竹组外,其余各组组间无显著差异(P>0.05)。
由表2可看出,肥胖高住安静对照组大鼠血清CAT活性显著高于肥胖低住安静对照组、正常安静对照组和肥胖低住低练组(P<0.05);各肥胖低氧训练组除肥胖低住高练组外,其余各低氧训练组显著高于肥胖低住低练组(P<0.05);补充玉竹多糖的肥胖高住低练组与其对应的低氧训练组组间无显著性差异(P>0.05);肥胖低住高练玉竹组大鼠血清CAT活性显著高于肥胖低住高练组(P<0.05)。
3 结论
本实验中,低氧暴露的大鼠MDA含量明显升高,在低氧环境中训练可使氧化应激现象更为剧烈;通过给予玉竹多糖干预,其低氧训练组MDA含量明显减少,SOD,CAT和GSH-PX活性均有所升高。说明玉竹多糖能够干预低氧训练引起的机体脂质过氧化作用,增强脂质过氧化产物的代谢能力,有效提高了高脂饮食大鼠血清中自由基清除能力。
