锂原子基态变分法的研究
2018-11-07董良杰
□董良杰
(山西广播电视大学,山西 太原 030027)
在物理方面,多粒子体系经常会被我们遇到。类似于经典力学,很难解决多粒子体系相互作用的问题。事实上,它不能被严格解决,而只能近似求解。量子力学中,两种常用的近似方法是微扰法和变分法。本文将采用变分法对简单的多粒子体系(锂原子)的基态进行研究。
一、物理学中的变分法
(一)变分法的思想
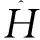
Ε0,Ε1,Ε2,…Εn…
(1)
这些本征值对应的本征函数是
Ψ0,Ψ1,Ψ2,…Ψn…
(2)
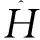
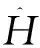
Ψn=ΕnΨn
(3)
假使Ψ为归一的任一波函数,将Ψ按Ψn展开,则有
Ψ=∑anΨn
(4)
在Ψ描绘的状态中,系统能量的期望值是
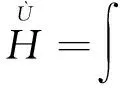
Ψ*ΗΨdτ
(5)
将(4)式代入(5)式中,则得
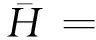
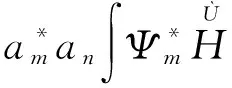
(6)
应用(3)式有
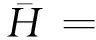
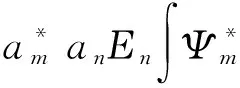
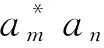
(7)
由于Ε0是基态能量,所以有Ε0<Εn(n=1,2,3,…),在上式中用Ε0代Εn,则
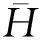
≥Ε0∑|an|2=Ε0
(8)
最后一步用了Ψ的归一化条件:∑|an|2=1
(7)和(8)式给出:
(9)
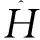
在上述讨论中,假定Ψ是归一化的,如果Ψ不归一化,那么(5)式应写为
(10)
(9)式则应写为
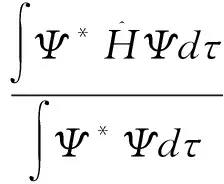
(11)
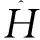
(二)变分法计算基态能量和波函数的步骤
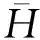
(12)
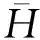
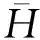
(三)变分法的价值
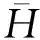
二、用变分法计算锂原子的基态能量及波函数
锂原子是有两个电子处于1s态,一个价电子处于2s态的多电子体系。为此,锂原子的哈密顿量可写为:
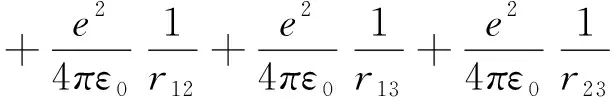
(13)
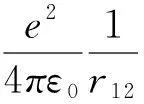
(一)选取合适的尝试波函数
将(13)式进行重组,则此式可写成:
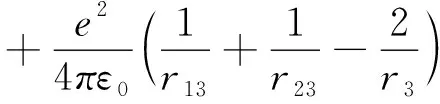
(14)
因为锂原子的1s电子几乎不受2s电子的屏蔽,所以锂原子的1s态下的波函数选择Li+的两个1s电子波函数u(r)代表。所以,锂原子1s态下的尝试波函数为[5]:
(15)
此外,锂原子的两个1s电子对2s电子有一定的屏蔽,2s电子受到的有效电荷相当于类氢原子,故而,采用类氢原子的基态波函数作为2s态下的尝试波函数[3]:
(16)
式中λ=1+σ,(σ≥0)σ刻画屏蔽效应的大小。若σ=0,则λ=1,表示无屏蔽。且2s电子遵循薛定谔方程:
υ(r3)=
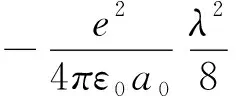
(17)
当忽略电子波函数的交换对称性时,锂原子的尝试波函数可写为
ψ=u(r1)u(r2)υ(r3)
(18)
(二)变分法计算基态能量和波函数
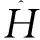
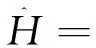
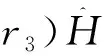
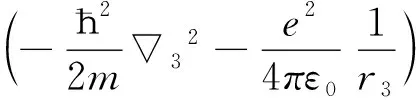
u2(r1)u2(r2)υ2(r3)dτ1dτ2dτ3
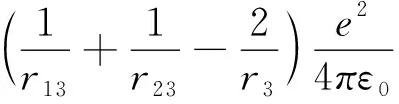
u2(r1)u2(r2)υ2(r3)dτ1dτ2dτ3
(19)
υ2(r3)dτ3
(20)
由于J项中r13和r23较难处理,可近似将r13、r23看作r3和r3,则
u2(r1)u2(r2)υ2(r3)
u2(r1)u2(r2)υ2(r3)=0
(21)
可得:
(22)
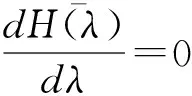
λ=1
(23)
所以
.936(eV)
(24)
然后我们将λ代入试探波函数,得到锂原子的基态波函数为:
ψ=u(r1)u(r2)υ(r3)
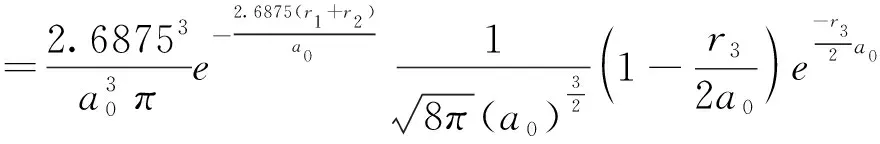
(25)
三、结论
我们知道,在实验中测得的锂原子基态能量为-203.345eV,而在此次论文中算出的数值与实验值的误差为1.68%。造成如此大的误差原因主要是:忽略了电子的交换对称性;同时,在计算J项时,我们近似处理了1s的两个电子与2s上的电子间的相互距离。例如,将第1个和第3个电子的间距看作是将第1个电子放在核上,由此第1个和第3个电子的间距就变成了核与第3个电子的间距,即r13=r3。同理,r23=r3。因此,锂原子基态能量的计算值具有比理论值有较大的误差。
