肝细胞生长因子、生长分化因子-15对慢性心力衰竭的诊断和预后价值
2018-11-07胡泽平顾奕玥王云飞
郭 影,胡泽平,圣 波,顾奕玥,王云飞,周 青,王 渊
慢性心力衰竭(chronic heart failure,CHF)是各类心脏疾病发展的终末阶段,成为21世纪最为严重的心血管病,预后差,极大的威胁着人们的健康与安全,因此CHF早期诊断、评估病情严重程度和预后极其重要。研究[1]发现心衰血清生化标志物可反映不同的病理生理机制,包括心肌细胞纤维化、心室重构、神经激素激活、炎症及氧化应激等,其变化有助于临床决策。脑钠肽(brain natriuretic peptide,BNP)是目前临床最常用的CHF生化标志物[2]。但其有一定的局限性,易受年龄、肾功能、肥胖等多种因素的影响,对CHF病因诊断亦缺乏特异性。近年来研究[3-4]发现,肝细胞生长因子(hepatocyte growth factor,HGF)、生长分化因子-15(growth differentiation factor-15,GDF-15)在CHF患者中升高,对CHF诊断、严重程度评估和预后有一定的临床意义。国内外有关HGF、GDF-15在CHF中的相关文献报道甚少。该研究旨在探究血清HGF、GDF-15在CHF患者中的诊断和预后价值。
1 材料与方法
1.1病例资料选取2015年12月~2017年5月安徽医科大学第一附属医院心内科住院治疗的CHF患者150例为心衰组,男94例,女56例,年龄39~96(68.9±12.5)岁。其中,冠心病82例,高血压心脏病14例,扩张性心肌病48例,先天性心脏病5例,酒精性心肌病1例。入选标准:所有CHF患者均符合2014年中国心力衰竭诊断和治疗指南[1]与 2016年欧洲急慢性心衰诊治指南[5],冠心病诊断经冠状动脉造影或冠状动脉血管CT成像或既往有陈旧性心肌梗死病史等明确。排除标准:急性心肌梗死、风湿性瓣膜病、严重肝肾功能损害、严重感染、恶性肿瘤、活动性自身免疫性疾病等。按照纽约心脏病学会(New York heart disease association, NYHA)心功能分级分为NYHA II级40例,NYHA III级60例,NYHA IV级50例;根据原发病病因将冠心病归为缺血性心衰(ischemic heart failure,IHF)组共82例,其他CHF病因归为非缺血性心衰(non-ischemic heart failure,NIHF)组共68例。选取同期体检中心健康体检者28例为对照组,男18例,女12例,年龄60~77(64.8±4.4)岁。
1.2一般资料所有患者入院后收集年龄、体质量、身高、既往用药史等一般资料,记录身体质量指数(body mass index,BMI)、心率(heart rate,HR)、收缩压(systolic pressure,SBP)、舒张压(diastolic pressure,DBP)等。患者入院24 h内检测BNP及血常规、肝肾功能、电解质、血脂、血糖等。
1.3超声心动图检查使用PHILIPS IE33彩色多普勒超声心动图诊断仪测定左室射血分数(left ventricular ejection fraction,LVEF)及左室舒张末期内径(left ventricular end-diastolic diameter,LVEDd)。
1.4HGF、GDF-15检测研究对象于入院24 h内均抽取清晨平卧位外周静脉血4 ml,3 000 r/min离心10 min,分离血清,分装并放置在-80 ℃的恒温冰箱保存。采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测血清HGF、GDF-15水平,试剂盒购自上海源叶生物有限公司。
1.5随访6个月心衰组患者每月电话随访1次,共6个月,记录CHF不良事件,即因心衰再次入院和心衰性死亡。
1.6西雅图心衰模型(seattleheartfailuremodel,SHFM)计算CHF患者平均生存年本试验由于时间限制,根据患者临床特征(性别、年龄、BMI、SBP、NYHA分级、LVEF、IHF或NIHF)、实验室指标[总胆固醇(total cholesterol,TCH)、血尿酸(uric acid,UA)、血红蛋白(hemoglobin,Hb)、血淋巴细胞百分比、钠离子(Na+)]及干预措施的应用(β受体阻滞剂、血管紧张素转换酶抑制剂(angiotensin converting enzyme inhibitor,ACEI)、血管紧张素受体拮抗剂(angiotensin receptor antagonist,ARB)、醛固酮受体拮抗剂、他汀类药、利尿剂、别嘌呤及双心室起搏、置入型复律除颤器等药物或器械治疗),通过SHFM计算CHF患者平均生存年。
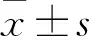
2 结果
2.1对照组与CHF组一般临床资料及HGF、GDF-15比较与对照组比较,CHF组HR、Hb、Na+、尿素氮(blood urea nitrogen,BUN)、UA、肌酐(creatinine,CRE)、谷草转氨酶(aspartate transaminase,AST)、谷丙转氨酶(alanine aminotransfer-ase,ALT)、低密度脂蛋白(low-density lipoprotein,LDL-c)两组间差异有统计学意义(P<0.05)。年龄、空腹血糖、BMI、SBP、DBP、钾离子(K+)、氯离子(CL-)、三酰甘油(triglyceride,TG)等两组间差异无统计学意义(P>0.05)。HGF、GDF-15、BNP、LVEDd水平明显较高,LVEF降低,差异有统计学意义(P<0.05)。见表1。

表1 对照组与CHF组一般临床资料及HGF、GDF-15比较
与对照组比较:*P<0.05

表2 NYHA心功能分级亚组间一般资料及HGF、GDF-15水平的比较
与NYHA Ⅱ级比较:*P<0.05;与NYHA Ⅲ级比较:#P<0.05
2.2NYHA心功能亚组间一般临床资料及HGF、GDF-15水平的比较随着NYHA心功能分级增加,HGF、GDF-15以及BNP、LVEDd水平升高,LVEF降低,差异有统计学意义(P<0.05)。见表2。
2.3IHF组和NIHF组一般资料及HGF、GDF-15水平比较与NIHF组比较,IHF组年龄、BMI、HR、HGF、BUN、UA、LVEDd两组间差异有统计学意义(P<0.05)。血糖、SBP、DBP、Hb、K+、 Na+、 Cl-、GRE、AST、ALT、TG、LDL-c、BNP、LVEF、用药情况等两组间差异无统计学意义(P>0.05)。GDF-15水平在IHF与NIHF组中升高不明显,见表3。

表3 IHF与NIHF组一般临床资料及HGF、GDF-15水平比较
与NIHF组比较:*P<0.05
2.4HGF、GDF-15与BNP、NYHA心功能分级、超声心动图指标及SHFM平均生存年间的相关性分析相关分析显示血清HGF、GDF-15水平与BNP、LVEDd、NYHA心功能分级呈正相关性(Pearson或Spearman相关系数分别为r=0.47、0.34, 0.42、0.33,0.85、0.74,P<0.05),与LVEF、SHFM平均生存年呈负相关性(r=-0.49、-0.45,-0.27、-0.30,P<0.05)。
2.5ROC曲线分析血清HGF、GDF-15水平对CHF的诊断价值ROC曲线显示,血清HGF、GDF-15对CHF诊断的AUC分别是0.886、0.862,最佳诊断临界点分别是820.5 pg/ml、822.0 pg/ml,HGF、GDF-15两者联合AUC为0.891,HGF、GDF-15、BNP三者联合AUC为0.898,生化指标联合的诊断价值优于单一指标(P<0.05),见表4。血清HGF对IHF诊断的AUC是0.757(P<0.05),最佳诊断临界点是1 038.0 pg/ml,对诊断NIHF诊断的AUC是0.409(P<0.05),GDF-15诊断IHF、NIHF的AUC是0.458、0.487(P<0.05)。

表4 ROC曲线分析血清HGF、GDF-15水平对CHF的诊断价值
与HGF比较:*P<0.05;与GDF-15比较:#P<0.05
2.6ROC曲线分析血清HGF、GDF-15水平对CHF的预后价值对CHF组患者随访6个月,CHF不良事件发生共46例,其中心衰性死亡4例,再住院42例。ROC曲线显示,血清HGF、GDF-15对CHF不良事件预测的AUC分别是0.843、0.817,最佳诊断临界点是960.5、1 280.5 pg/ml;HGF对CHF的预后价值高于GDF-15,HGF、GDF-15两者联合AUC为0.873,HGF、GDF-15、BNP三者联合AUC为0.911,其预后价值优于单一指标(P<0.05),见表5。血清HGF对IHF的CHF不良事件预测的AUC是0.806,最佳诊断临界点是980.0 pg/ml,对NIHF的CHF不良事件预测的AUC是0.488;GDF-15对IHF、NIHF的CHF不良事件预测AUC是0.481、0.429(P<0.05)。

表5 ROC曲线分析血清HGF、GDF-15水平对CHF的预后价值
与HGF比较:*P<0.05;与GDF-15比较:#P<0.05
3 讨论
HGF最初是从肝切除术后的残余肝组织中发现的,是一种间质细胞衍生的多功能细胞因子,广泛存在于心血管系统中,其与原癌基因C-met编码的特异性受体结合后产生多种生物学活性:抗炎、保护血管内皮、促进血管新生、抑制细胞凋亡和抑制心室重构等[3,6]。Ueno et al[7]发现,在CHF患者中,血清HGF水平会明显升高,但随着病情逐渐稳定后HGF浓度下降。本研究结果显示,CHF组血清HGF水平明显高于对照组,且随着NYHA心功能分级的增加血清HGF逐渐升高。相关性分析显示血清HGF水平与BNP、LVEDd、NYHA心功能分级呈正相关,与LVEF呈负相关性,显示血清HGF水平与可用于CHF的诊断,且与CHF严重程度相关。进一步分析显示血清HGF在IHF中升高较NIHF更明显,差异有统计学意义。ROC曲线显示,血清HGF对CHF诊断的AUC是0.886,诊断IHF、NIHF的AUC分别是0.757、0.409(P<0.05)。表明血清HGF可作为诊断CHF的指标,对原发病病因诊断上具有特异性。
有研究者对CHF患者进行随访,结果显示血HGF水平越高的患者预后越差,死亡率明显增加,亚组分析显示血清HGF水平对缺血性心肌病患者可以显著预测心血管事件的死亡率,而对非缺血性心肌病患者预测价值有限[8-9]。本研究对CHF患者随访半年,记录CHF不良事件共46例,其中心衰性死亡4例,再住院42例,发生率为30.7%,ROC曲线中,血清HGF对CHF不良事件预测的AUC是0.843,对IHF、NIHF的CHF不良事件预测的AUC是0.806、0.488(P<0.05)。本研究由于时间限制,随访时间较短,利用SHFM[4]计算患者的平均生存年,SHFM是一种多元危险因素模型,通过引入CHF患者的疾病状态,相关药物、仪器的治疗,实验室指标等参数来获得患者的平均生存年,可准确预测患者的预后。本研究中血清HGF水平与SHFM生存年呈负相关。表明HGF对CHF有较高的预测价值,尤其是IHF患者的预后,可作为CHF患者判断预后的指标。
GDF-15是转化生长因子β超家族成员之一,生理状态下大部分组织和器官中(包括心脏)几乎不表达,但在缺血-再灌注损伤、氧化应激、炎症反应和压力负荷等病理状态下心肌细胞中高表达,血清GDF-15浓度也迅速升高,具有抗炎、抑制细胞凋亡、改善心肌重构和心室肥厚等作用[10-11]。本研究显示,心衰组血清GDF-15水平明显高于对照组,随着NYHA心功能升高而增加,并与BNP呈正相关,与LVEF、SHFM生存年呈负相关,在IHF和NIHF两组间差异无统计学意义。此结果与Kempf et al[12]、Lok et al[13]研究相似。在ROC曲线中,GDF-15对CHF诊断和不良事件预测的AUC下面积均大于0.5,对INF、NIHF的AUC下面积均小于0.5(P<0.05)。表明GDF-15对CHF诊断和预后评估有一定的价值,但对CHF基础心脏病病因诊断和预后判断无价值。
另外,本研究显示HGF对CHF的预后价值高于GDF-15,且HGF、GDF-15二者联合和HGF、GDF-15、BNP三者联合,用于CHF诊断和不良事件预测的AUC均高于单一指标,表明HGF、GDF-15、BNP多指标联合可提高对CHF诊断和预后判断的准确性,为CHF的诊治提供更加可靠的依据。
综上所述,CHF患者血清HGF、GDF-15水平明显升高,提示心功能恶化,临床预后不良;基础心脏疾病为IHF的CHF患者,血清HGF水平升高更为明显,提示对CHF患者的基础心脏疾病的鉴别诊断具有一定价值;多指标的联合可提高对CHF的诊断和预测价值。
