肝细胞生长因子对小鼠巨噬细胞M1、M2亚型极化的影响
2018-11-07胡泽平顾奕玥王云飞
圣 波,胡泽平,郭 影,顾奕玥,王云飞,周 青,汪 渊
肝细胞生长因子(hepatocyte growth factor, HGF)是间质细胞趋化的多功能生长因子,可作用于多种类型的细胞,在细胞增殖、运动与迁移、抗凋亡、抗纤维化和调节免疫等方面发挥重要的生物学功能[1]。最近研究[2]表明:HGF具有很强的抗炎作用,增加其表达可能有抗动脉粥样硬化(atherosclerosis, AS)作用。AS是发生在动脉血管壁的慢性炎症性疾病,炎症反应是其突出的促发因素。其中,巨噬细胞扮演着重要角色[3]。巨噬细胞根据激活方式的不同,可分为经典活化的M1型和替代活化的M2型。M1型巨噬细胞具有促炎作用,增加易损斑块的不稳定性,加速AS进程;M2型巨噬细胞具有抗炎作用,促进组织修复与血管形成,延缓AS进程。在AS中,两者之间的比例显著影响斑块的结局。本课题组前期研究[4]已表明,在AS兔模型中,HGF通过抑制M1型巨噬细胞浸润、诱导M2型巨噬细胞分化而促进斑块稳定,抑制AS进展。然而,体外条件下,HGF能否调控巨噬细胞极化至今尚未见报道。该研究探讨体外条件下,HGF对巨噬细胞M1、M2型极化的影响。
1 材料与方法
1.1材料
1.1.1细胞株 RAW264.7细胞株为小鼠来源的巨噬细胞株,由中国科学技术大学生命科学院馈赠。
1.1.2主要试剂和仪器 HGF、白介素-4(interleukin-4, IL-4)和干扰素-γ(interferon-γ, IFN-γ)购自美国Peprotech公司;二甲基亚砜(dimethylsulfoxide, DMSO)、细菌脂多糖(lipopolysaccharide, LPS)及3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide, MTT]购自美国Sigma公司;DMEM培养基(高糖)购自美国Gibco公司;胎牛血清购自杭州四季青生物工程材料有限公司;青霉素、链霉素购自华北制药华胜公司;兔诱导性一氧化氮合酶(inducible nitric oxide synthase, iNOS)多抗购自美国Abcam公司;兔精氨酸酶II(arginase II, Arg II) 多抗、兔精氨酸酶I(arginase I, Arg I)多抗购自北京博奥森生物技术有限公司;β-actin 单抗购于美国Santa Cruz公司;相应二抗购自北京中杉金桥生物技术有限公司;免疫荧光试剂盒购自碧云天公司;白介素-6(interleukin-6, IL-6)、白介素-10(interleukin-10, IL-10)ELISA试剂盒购自北京四正柏科技有限公司。
1.2方法
1.2.1细胞培养与传代 RAW264.7细胞培养于DMEM高糖完全培养基中(10%胎牛血清、100 μg/ml青霉素、100 U/ml链霉素),细胞培养瓶置入饱和湿度、37 ℃、5%CO2培养箱培养,待细胞长至80%~90%融合并处于对数生长期时,PBS清洗3次后,0.25%胰酶进行1 ∶3消化传代。
1.2.2体外诱导RAW264.7细胞极化 待细胞处于对数生长期时,细胞换液后,用含IFN-γ(20 ng/ml)和LPS(500 ng/ml)的DMEM高糖完全培养基培养24 h,诱导其向M1型极化;用含IL-4(20 ng/ml)的DMEM高糖完全培养基培养24 h,诱导其向M2型极化。
1.2.3实验分组 实验分为5组。细胞对照组:即Mφ型巨噬细胞;空白对照组:即M1、M2型巨噬细胞;用药组:分别给予0.1、1.0、10.0 ng/ml的HGF对M1、M2型巨噬细胞进行处理12 h。
1.2.4MTT试验 取对数生长期的RAW264.7细胞悬液以200 μl/孔(2×103个细胞)接种于96孔板中,置于饱和湿度、37 ℃、5%CO2培养箱培养,待细胞贴壁后,吸弃上清液,换成含不同浓度的HGF完全培养基,HGF的浓度分别为0、0.1、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、8.0、9.0、10.0 ng/ml;培养12 h后,每孔加入20 μl MTT继续孵育4 h,弃MTT上清液,添加200 μl DMSO并置于平板床上低速震动10 min,待结晶完全溶解后,在酶标仪上测定450 nm波长处的吸光度值。同样的方法分别测定M1、M2型巨噬细胞在HGF浓度为0.1、1.0、10.0 ng/ ml时的吸光度值。
1.2.5Western blot法检测Arg II、Arg I的蛋白表达 按上述方法进行细胞培养及极化,在诱导12 h后,分别加入0.1、1.0、10.0 ng/ml的HGF处理细胞,同时设立细胞对照组与空白对照组,共培养24 h,每孔加入80 μl蛋白裂解液,冰上静置30 min,充分裂解后提取蛋白,反复冻融3次,于4 ℃、14 000 r/min离心30 min后采用BCA法进行蛋白定量。12.5%SDS聚丙烯酰胺凝胶进行蛋白电泳,50 V浓缩胶,100 V分离胶,电泳分离细胞蛋白质,160 mA将蛋白质转移至PVDF膜上。室温下5%脱脂牛奶封闭2 h,孵育相应一抗Arg Ⅱ(1 ∶200)、Arg I(1 ∶200)4 ℃过夜,TBST洗膜3次,每次10 min,室温孵育二抗2 h,TBST洗涤3次后用ECL进行显影及曝光,以β-actin为内参,用Quantity One系统进行灰度值分析。
1.2.6细胞免疫荧光法检测iNOS、Arg I的表达 将盖玻片置于12孔板中,种入RAW264.7细胞培养过夜,按上述极化方法及实验分组培养细胞,共培养24 h,取出盖玻片,PBS清洗,在37 ℃条件下用4%多聚甲醛固定细胞20 min,PBS清洗后,0.3%聚乙二醇辛基苯基醚(TritonX-100)透化细胞膜5 min,TBS清洗1次后改用PBS清洗2次,封闭液(含5%BSA及0.1% TritonX-100)封闭细胞60 min,去封闭液,加入iNOS和Arg I一抗(均1 ∶150),4 ℃孵育过夜,次日去除一抗,TBS清洗1次,PBS清洗2次,每次5 min,加入FITC标记的山羊抗小鼠IgG二抗(1 ∶1 000),室温避光孵育60 min,TBS清洗1次,PBS清洗2次, DAPI(0.5 μg/ml)染核10 min,弃DAPI,PBS清洗3次,抗荧光淬灭封片液进行封片,荧光显微镜下观察结果并采集图片。
1.2.7ELISA法检测细胞上清液中IL-6、IL-10的浓度 取各组培养上清液进行实验,根据IL-6、IL-10的ELISA 试剂盒说明书进行操作,检测上清液中表达水平,酶标仪检测吸光度值,用标准曲线计算浓度。
2 结果
2.1HGF对RAW264.7及M1、M2型巨噬细胞增殖的影响HGF浓度在0.1~10.0 ng/ml范围内对RAW264.7巨噬细胞无增殖作用(F=0.720,P=0.770)(表1);当HGF浓度分别为0.1、1.0、10.0 ng/ml时,对M1及M2型巨噬细胞均无增殖作用(F=1.238,P=0.323;F=0.469,P=0.707)(表2);结果提示本实验采取的药物浓度梯度对后续实验无影响。
2.2HGF对M1型巨噬细胞极化的影响

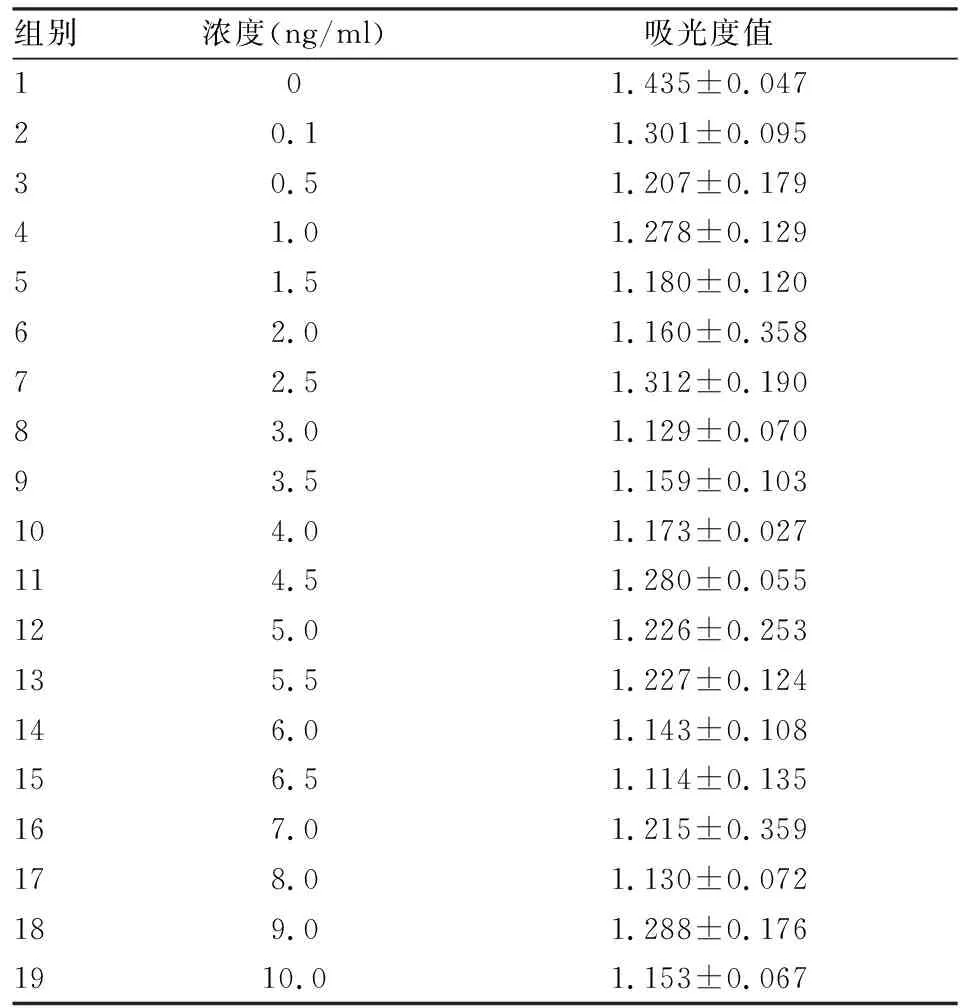
组别浓度(ng/ml)吸光度值101.435±0.04720.11.301±0.09530.51.207±0.17941.01.278±0.12951.51.180±0.12062.01.160±0.35872.51.312±0.19083.01.129±0.07093.51.159±0.103104.01.173±0.027114.51.280±0.055125.01.226±0.253135.51.227±0.12414 6.01.143±0.108156.51.114±0.135167.01.215±0.359178.01.130±0.072189.01.288±0.1761910.01.153±0.067


浓度(ng/ml)吸光度值M1型M2型01.190±0.1261.054±0.1220.11.071±0.0471.055±0.1011.01.061±0.1871.019±0.06910.00.982±0.2180.993±0.131
2.2.1HGF对M1型巨噬细胞标志物Arg II蛋白表达的影响 结果显示:与Mφ组相比,M1组Arg II表达明显增加(F=3.680,P<0.05);与M1组相比,HGF各干预组Arg II表达明显减少(F=183.472,P<0.05)。见图1。

图1 Western blot 法检测Arg II蛋白表达
1:Mφ组;2:M1组;3:M1+0.1ng/ml HGF组;4:M1+1.0 ng/ml HGF组;5:M1+10.0 ng/ml HGF组;与Mφ组比较:*P<0.05;与M1组比较:#P<0.05
2.2.2HGF对M1型巨噬细胞胞内iNOS蛋白表达的影响 结果显示:与Mφ组相比,M1组iNOS表达明显增加;与M1组相比,HGF各干预组iNOS表达明显减少。见图2。
2.2.3HGF对M1型巨噬细胞培养上清液IL-6水平的影响 结果显示:与Mφ组相比,M1组细胞上清液IL-6水平明显增加(F=0.430,P<0.05);与M1组相比,HGF各干预组细胞上清液IL-6水平明显减少(F=30.367,P<0.05)。见图3。
2.3HGF对M2型巨噬细胞极化的影响
2.3.1HGF对M2型巨噬细胞标志物Arg I蛋白表达的影响 结果显示:与Mφ组相比,M2组Arg I表达明显上升(F=0.920,P<0.05);与M2组相比,HGF各干预组Arg I表达明显上升(F=1.338,P<0.05),且1.0、10.0 ng/ml HGF处理组呈剂量依赖性(F=0.182,P<0.01)。见图4。
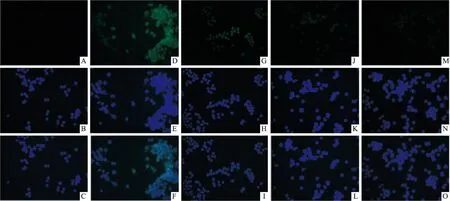
图2 细胞免疫荧光法检测iNOS蛋白表达 ×400
A:Mφ组iNOS表达;B:Mφ组细胞核染色;C:A、B合成图;D:M1组iNOS表达;E:M1组细胞核染色;F:D、E合成图;G:M1+0.1ng/ml HGF组iNOS表达;H:M1+0.1ng/ml HGF组细胞核染色;I:G、H合成图;J:M1+1.0 ng/ml HGF组iNOS表达;K:M1+1.0 ng/ml HGF组细胞核染色;L:J、K合成图;M:M1+10.0 ng/ml HGF组iNOS表达;N:M1+10.0 ng/ml HGF组细胞核染色;O:M、N合成图
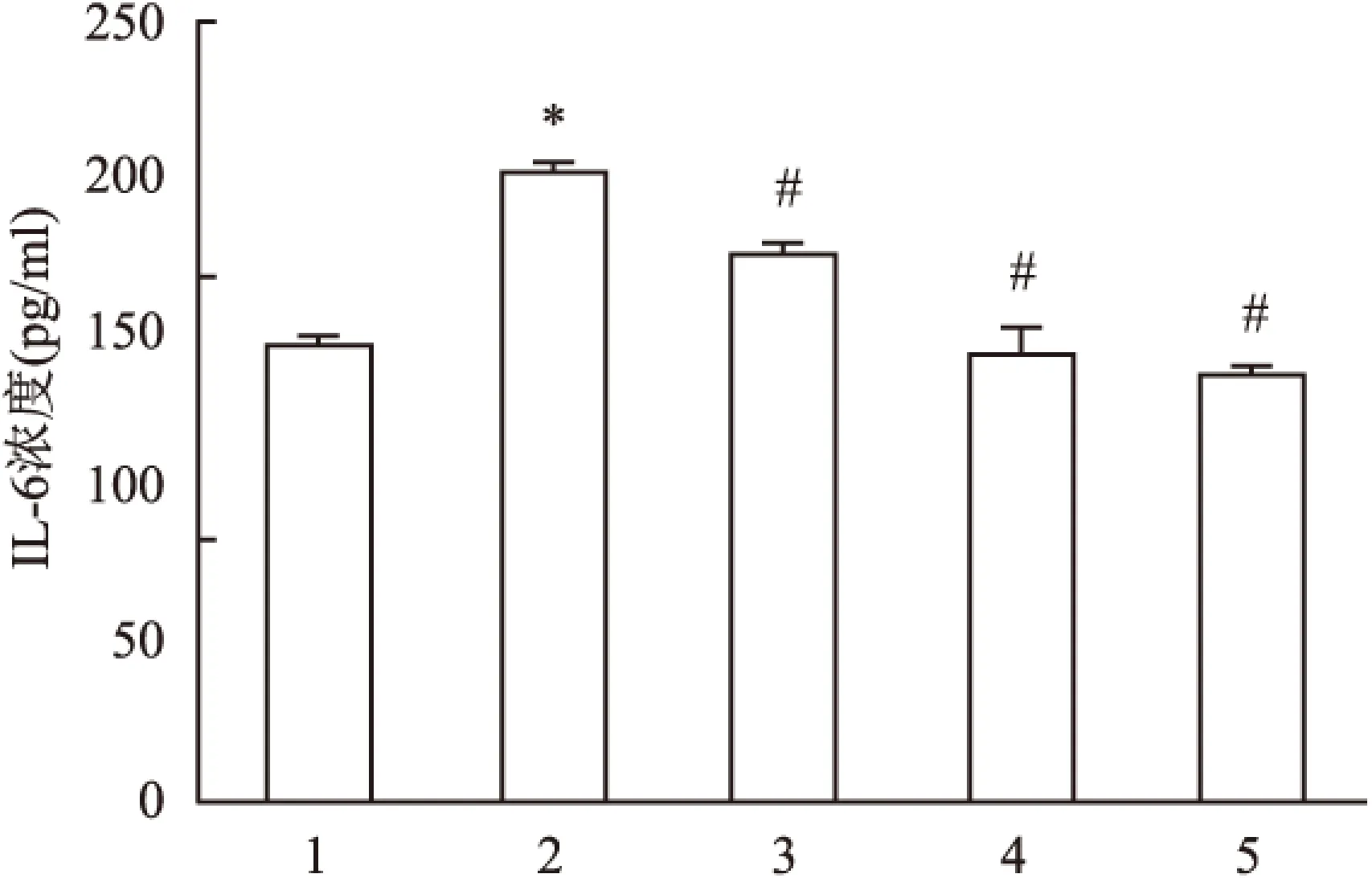
图3 ELISA法检测细胞上清液IL-6浓度
1:Mφ组;2:M1组;3:M1+0.1 ng/ml HGF组;4:M1+1.0 ng/ml HGF组;5:M1+10.0 ng/ml HGF组;与Mφ组比较:*P<0.05;与M1组比较:#P<0.05
2.3.2HGF对M2型巨噬细胞胞内Arg I蛋白表达的影响 结果显示:与Mφ组相比,M2组Arg I表达明显上升;与M2组相比,HGF各干预组Arg I表达明显上升。见图5。
2.3.3HGF对M2型巨噬细胞培养上清液IL-10水平的影响 结果显示:与Mφ组相比,M2组IL-10表达水平上升(F=1.226,P<0.05);与M2组相比,HGF各干预组IL-10表达水平明显上升(F=90.437,P<0.05),且1.0、10.0 ng/ml HGF处理组呈剂量依赖性(F=0.276,P<0.01)。见图6。
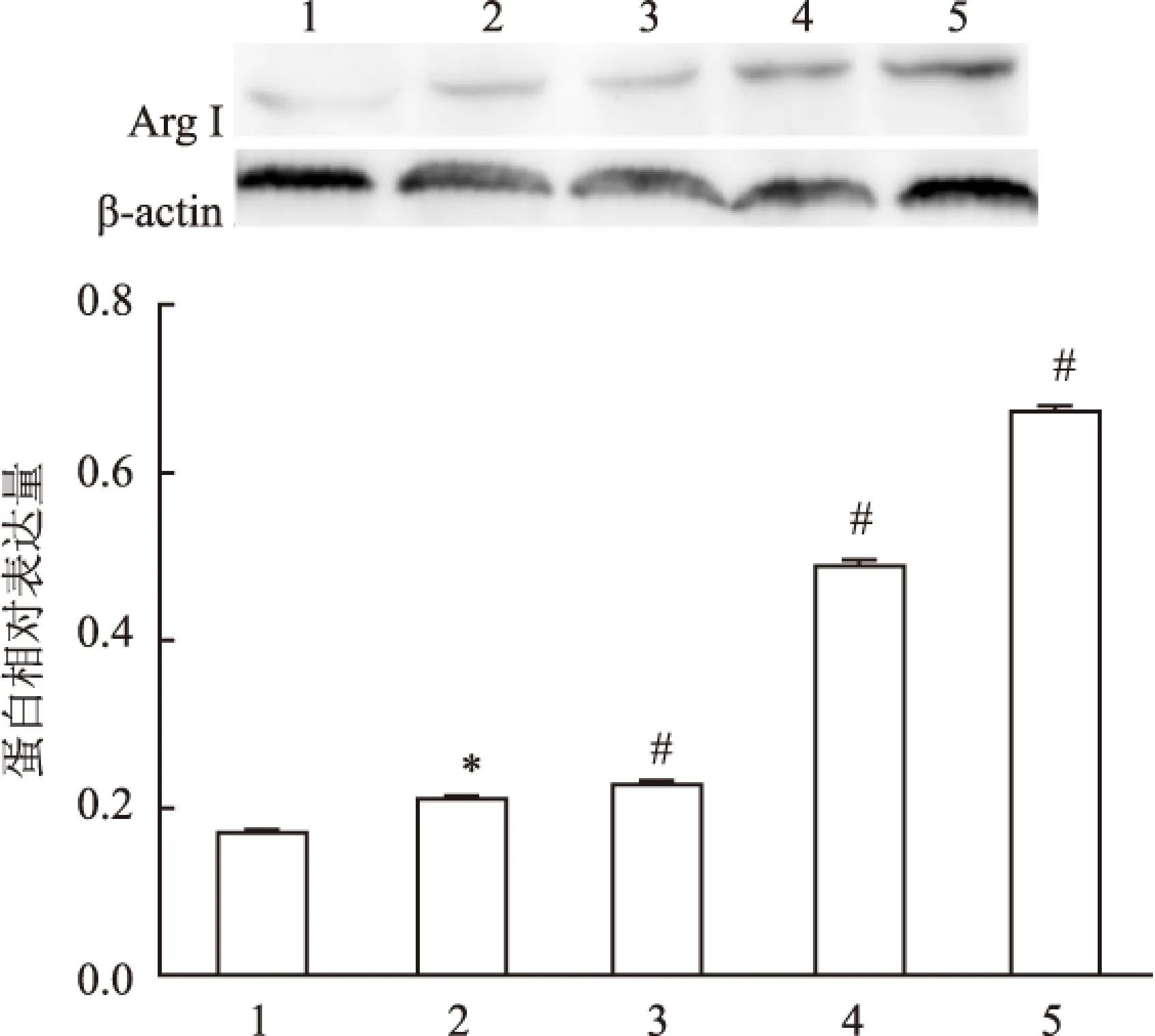
图4 Western blot 法检测Arg I蛋白表达
1:Mφ组;2:M2组;3:M2+0.1 ng/ml HGF组;4:M2+1.0 ng/ml HGF组;5:M2+10.0 ng/ml HGF组;与Mφ组比较:*P<0.05;与M2组比较:#P<0.05
3 讨论
以AS为病理基础的心脑血管疾病逐年递增,防治任务艰巨。AS的发生、发展是一个慢性炎症过程,巨噬细胞作为最具代表性的炎症细胞,其通过吞噬氧化修饰的脂质、凋亡细胞碎片,分泌炎症因子、金属蛋白酶等途径介导炎症过程[5]。由于巨噬细胞具有异质性及可塑性的特点,在AS发生、发展过程中,其可随局部微环境的改变而表现出不同的功能状态,M1、M2型正是该状态的两个极端。M1型巨噬细胞通过分泌iNOS、白介素-12(interleukin-12, IL-12)、白介素-23(interleukin-12, IL-23)、肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)等促炎因子,促进病灶内的炎症反应;M2型巨噬细胞通过分泌IL-10、转化生长因子-β(transforming growth factor α, TGF-β)等抗炎因子,促进纤维帽的形成及组织修复,抑制病灶内的炎症反应[6]。因此,调控巨噬细胞极性可能成为临床治疗以AS为病理基础的心脑血管疾病的新策略。
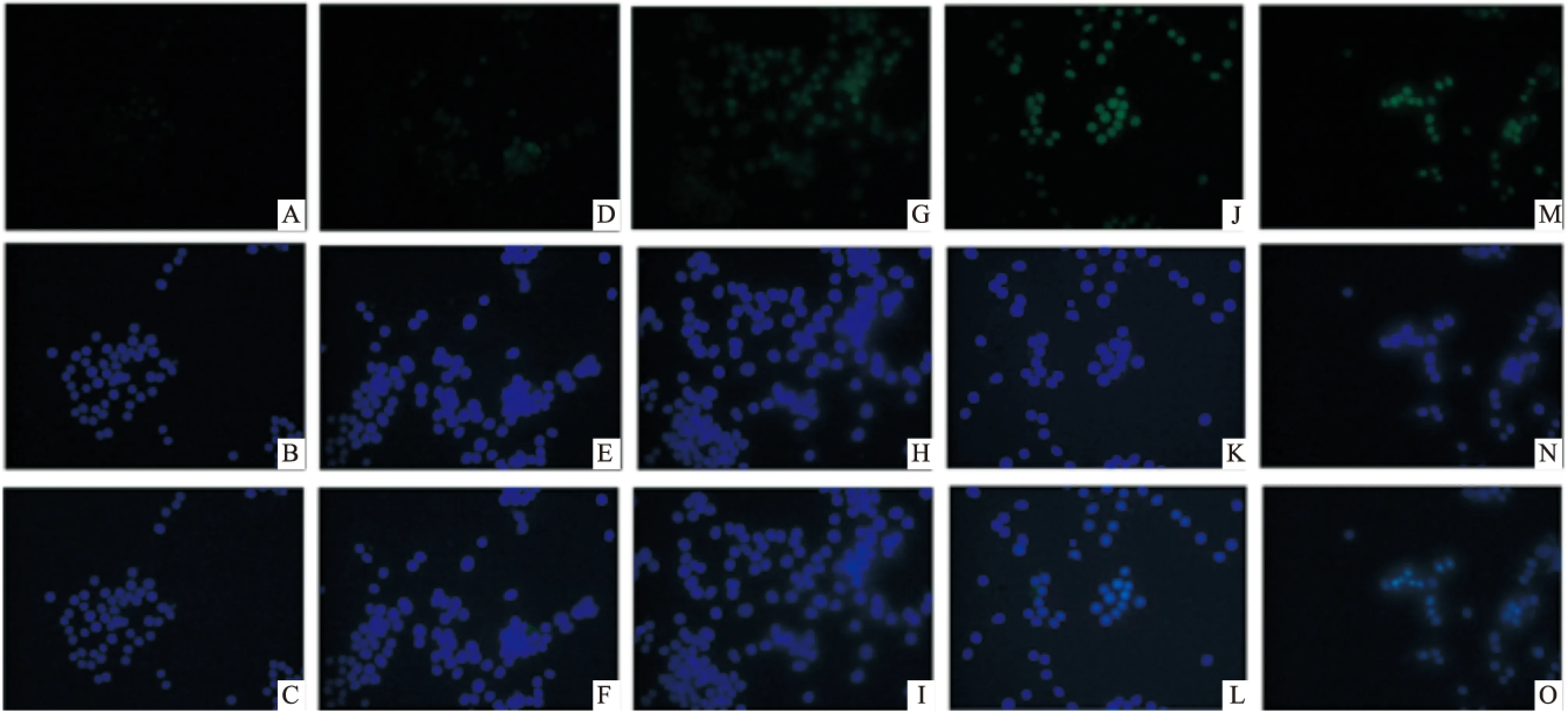
图5 细胞免疫荧光法检测Arg I蛋白表达 ×400
A:Mφ组Arg I表达;B:Mφ组细胞核染色;C:A、B合成图;D:M2组Arg I表达;E:M2组细胞核染色;F:D、E合成图;G:M2+0.1 ng/ml HGF组Arg I表达;H:M2+0.1 ng/ml HGF组细胞核染色;I:G、H合成图;J:M2+1.0 ng/ml HGF组Arg I表达;K:M2+1.0 ng/ml HGF组细胞核染色;L:J、K合成图;M:M1+10.0 ng/ml HGF组Arg I表达;N:M2+10.0 ng/ml HGF组细胞核染色;O:M、N合成图
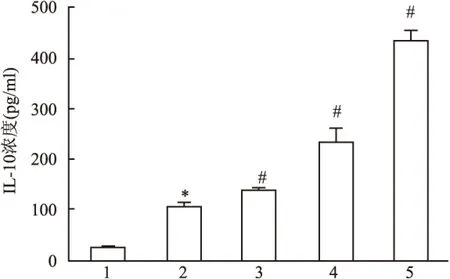
图6 ELISA法检测细胞上清液中IL-10浓度
1:Mφ组;2:M2组;3:M2+0.1 ng/ml HGF组;4:M2+1.0 ng/ml HGF组;5:M2+10.0 ng/ml HGF组;与Mφ组比较:*P<0.05;与M2组比较:#P<0.05
本研究采用小鼠单核巨噬细胞系RAW264.7细胞,在体外条件下,以IFN-γ联合LPS 诱导其向M1型极化,IL-4诱导其向 M2 型极化,诱导极化的同时加入不同浓度的HGF进行干预,探讨体外条件下,HGF对M1、M2型巨噬细胞极化的影响。结果显示:与Mφ组相比,M1组Arg II、iNOS、IL-6及M2组Arg I、IL-10的表达水平均明显升高,提示造模成功。不同浓度的HGF干预后,与M1组相比,HGF各干预组Arg II、iNOS、IL-6的表达明显降低;与M2组相比,HGF各干预组Arg I、IL-10的表达明显升高;表明HGF抑制RAW264.7细胞向M1型极化,促进其向M2型极化。
目前研究已表明,他汀类[7]、噻唑烷二酮类[8]、替米沙坦[9]及中药姜黄素[10]等能诱导M1型巨噬细胞向M2型转化,而巨噬细胞的极化受多种信号通路及转录因子的调控[11],目前比较明确的主要有:信号传导与转录激活因子(signal transducers and activators of transcription, STAT)、核因子κB(nuclear factor κB, NF-κB)、IFN调节因子(interferon regulatory factor, IRF)、过氧化物酶体增殖物激活受体-γ(peroxisome proliferator activated receptor-γ, PPAR-γ)、孤儿核受体、表观遗传调节等。不同微环境下,巨噬细胞亚型之间可相互转化[12],HGF通过何种机制抑制M1型极化而促进M2型极化,尚需进一步研究。
综上所述,巨噬细胞M1、M2亚型比例失衡促进AS的发生和发展,HGF抑制巨噬细胞向M1型极化、促进其向M2型极化,可能成为抗AS治疗的新靶点。
