Dof基因家族调节植物生长发育功能的研究进展
2018-11-06丁文杰江海燕李玉立王良桂岳远征
李 娅,丁文杰,江海燕,李玉立,王良桂,岳远征*
(1 南京林业大学 风景园林学院,南京 210037;2 南京林业大学,风景园林江苏省重点实验室,南京 210037)
基因调控是一个涉及多种调控元件的复杂过程,转录因子是基因调控过程的重要因子,可通过与不同基因启动子区段的顺式调控序列相结合来调节相应基因的转录水平[1]。转录因子也称为反式作用因子,一般由DNA结合区、转录调控区(包括激活和抑制域)、寡聚化位点及核定位信号区4个功能区组成[2]。植物生长发育过程中的许多生命活动都受转录因子的严格调控,根据转录因子与DNA结合的结构域序列特点,可以将转录因子分成不同的家族,Dof基因家族便是其中之一。
Dof基因家族是植物特有的一类转录因子,目前在果蝇、酵母和线虫等不同类型的生物体中均没有发现该家族基因的存在[1]。Dof转录因子能够与其他转录因子相互作用,也能够通过激活或者抑制靶基因来调控转录过程,从而发挥功能。研究表明,Dof基因家族成员参与到植物体的多种生命活动中,对植物生长发育、光调控、防御机制以及激素调控等过程中的相关基因有重要的调控作用[3]。基于Dof基因在植物中的重要作用,本文主要针对Dof家族成员的结构特点及其生物学功能进行了总结,为Dof家族基因的进一步研究提供信息和参考。
1 Dof基因家族的结构特点
Dof基因家族属于单锌指蛋白超家族,一般由200~400个氨基酸构成[4]。Dof蛋白具有明显的结构特征,由N-末端高度保守的Dof结合结构域、寡聚化位点、引导Dof蛋白进入细胞核的核定位区段以及负责C-末端转录调控的激活结构域4个部分组成[5](图1)。其中,Dof 结合结构域是由52个保守的氨基酸残基构成的C2-C2型单锌指结构域,在该结构域中有4个绝对保守的Cys残基[6]。Dof蛋白由于其C-末端转录调控域的氨基酸序列较为多变,不具有保守性,因此在植物中的功能具有多样性[1]。
研究表明,Dof基因家族成员可通过识别含有AAAG或者CTTT序列来与下游基因启动子序列结合,从而调控表达。如拟南芥的OBP1转录因子能特异性识别GST6基因启动子的AAAG或者CTTT序列;玉米中PBF基因可识别Zein基因的TAAAG序列[5,7];然而南瓜Dof蛋白AOBP却能特异性识别下游基因启动子中的AGTA序列[8-9]。
2 Dof基因家族成员的鉴定与分析
近年来,基因家族分析已成为了解不同物种中基因结构进化和功能的重要手段。自从玉米中克隆出第一个Dof基因(ZmDof1)以来[10],目前已有大量的Dof家族成员从不同植物的基因组数据库中得到了鉴定。前人已经对莱茵衣藻(1个Dof基因家族成员,下同)、小立碗藓(9)、岩柏草(8)、江南卷柏(8)、短柄草(27)、火炬松(8)、拟南芥(36)、大麦(24)、大豆(78)、番茄(34)、水稻(30)、小麦(31)、高梁(28)、玉米(54)、甘蔗(25)等植物基因组中的Dof成员情况进行了综述分析[1],然而关于Dof基因家族成员在不同物种中的鉴定工作一直都未停止。近年来在马铃薯、大白菜、胡椒、桃、苹果、香蕉等植物中又有大量的Dof成员通过全基因组分析或者转录组分析的策略被鉴定出来(表1)。
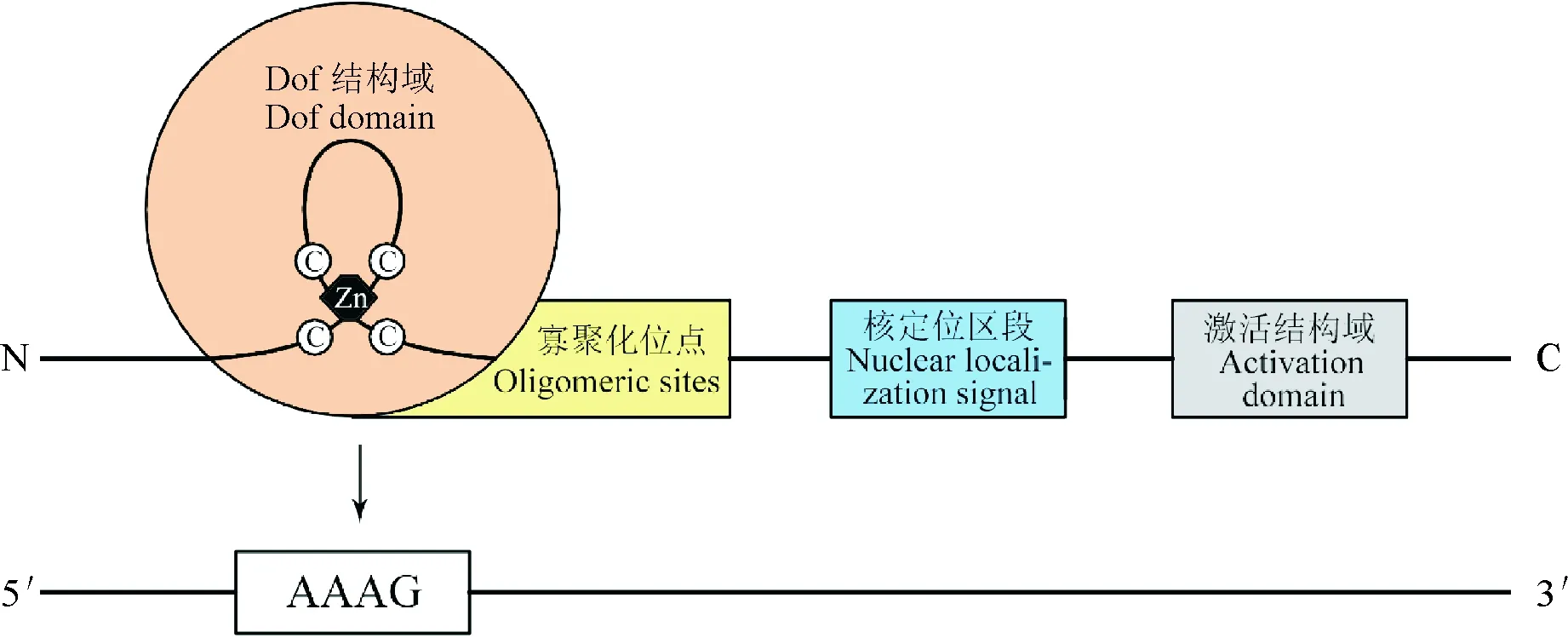
图1 Dof蛋白结构及AAAG序列识别位点示意图Fig.1 Schematic diagram of Dof protein structure and AAAG sequence identification site
3 Dof蛋白与其他蛋白的相互作用
Dof蛋白除了可与本家族的Dof蛋白成员互作外,还可与bZIP、MYB、QM、ZFP2、WRKY、TCP以及HMG蛋白等其他家族的成员相互作用[1]。目前,已有研究表明Dof蛋白主要以两种方式与其他蛋白发生相互作用。一种是由Dof结构域介导的互作,如拟南芥Dof转录因子OBP1及玉米Dof转录因子PBF均可以通过其Dof结构域与bZIP家族蛋白相互作用,从而调控目的基因的表达[30-31](图2);另一种是由Dof蛋白C末端的转录调控结构域介导的相互作用,如在大麦中,Dof家族基因BPBF和SAD可通过C端的调控结构域与HvGAMYB蛋白发生互作,从而影响种子的发育[32-33](图3)。
4 Dof基因家族的生物学功能
研究表明,与Dof蛋白结合的元件存在于多种植物特异性基因的启动子序列中[5],如近期从矮牵牛的2个花特异性表达基因PhLRR和PhGRP的启动子序列中就发现大量可与Dof蛋白结合的顺式调控元件[46]。由于Dof蛋白具有蛋白-启动子和蛋白-蛋白互作的功能,因此Dof蛋白可广泛地参与植物的组织分化、种子发育、代谢调节以及逆境胁迫等多种生物学过程[47]。本研究就不同植物中与Dof基因相互作用的蛋白及其功能进行了总结(表2)。
4.1 Dof基因与植物的组织分化
4.1.1Dof基因参与植物花药发育启动子可诱导其下游基因在花药中特异性表达,为更好地了解花药发育过程,众多花药特异性基因的启动子在拟南芥、烟草、矮牵牛、马铃薯、油菜和水稻等植物中被鉴定出来,在这些启动子中都含有大量的可与Dof转录因子结合的顺式元件。ZmDof1作为第一个发现的Dof基因,可调控玉米花粉特异性基因Zm401的表达,并且该基因在植物花粉粒中也有较高的表达水平[48];此外,玉米ZmDof30作为Zm908的转录阻遏蛋白基因,可负调控花粉萌发和花粉管生长的关键基因Zm908的启动子活性,从而影响植物花药的发育[49]。

表1 不同植物中 Dof 基因数目(2015~2018)

a. OBF蛋白与OBP1蛋白相互作用促进AtGST6表达;b. O2蛋白与PBF蛋白相互作用促进玉米cyPPDK基因表达图2 Dof与bZIP相互作用调控目的基因的表达a. OBF protein interacts with OBP1 protein to promote AtGST6 expression; b. O2 protein interacts with PBF protein promotes corn cyPPDK gene expressionFig.2 Dof proteins could regulate the target genes expression by interacting with bZIP proteins
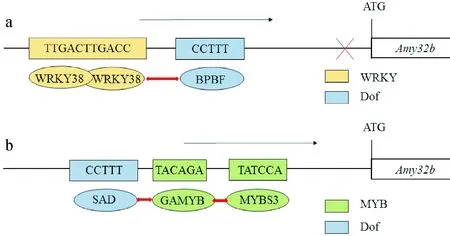
a. BPBF与WRKY38相互作用并在GA不存在的情况下抑制Amy32b表达;b. SAD与GAMYB相互作用并在GA存在下激活Amy32b表达 图3 Dof与其他转录因子相互作用调控目的基因的表达a. BPBF could inhibit the expression of Amy32b by interacting with WRKY38 when absence GA; b. SAD could activate the expression of Amy32b by interacting with GAMYB under the GA treatmentFig.3 Dof proteins could regulate the target genes expression by interacting with other transcription factors
4.1.2Dof基因参与植物的开花过程光周期是控制植物开花的重要因素,Dof 转录因子可通过调控植物光敏色素和隐花色素的信号转导通路来响应光反应。CDFs是一类参与开花调节的Dof亚家族成员,已有报道表明拟南芥中的CDFs基因对光周期调控的开花过程起至关重要的作用,如AtCDF1可通过调节CO和FT的表达水平来抑制植物开花[45];此外,在拟南芥中过表达番茄的SiCDF3基因和油菜的BnCDF1基因,能通过调节成花基因如CO和FT来推迟开花[50-51];不同的是,在番茄中过表达TDDF1基因可通过调节开花基因表达而诱导番茄早期开花[52];水稻OsDof12、OsDof4基因则受光照条件的影响从而控制植株开花[53-54]。
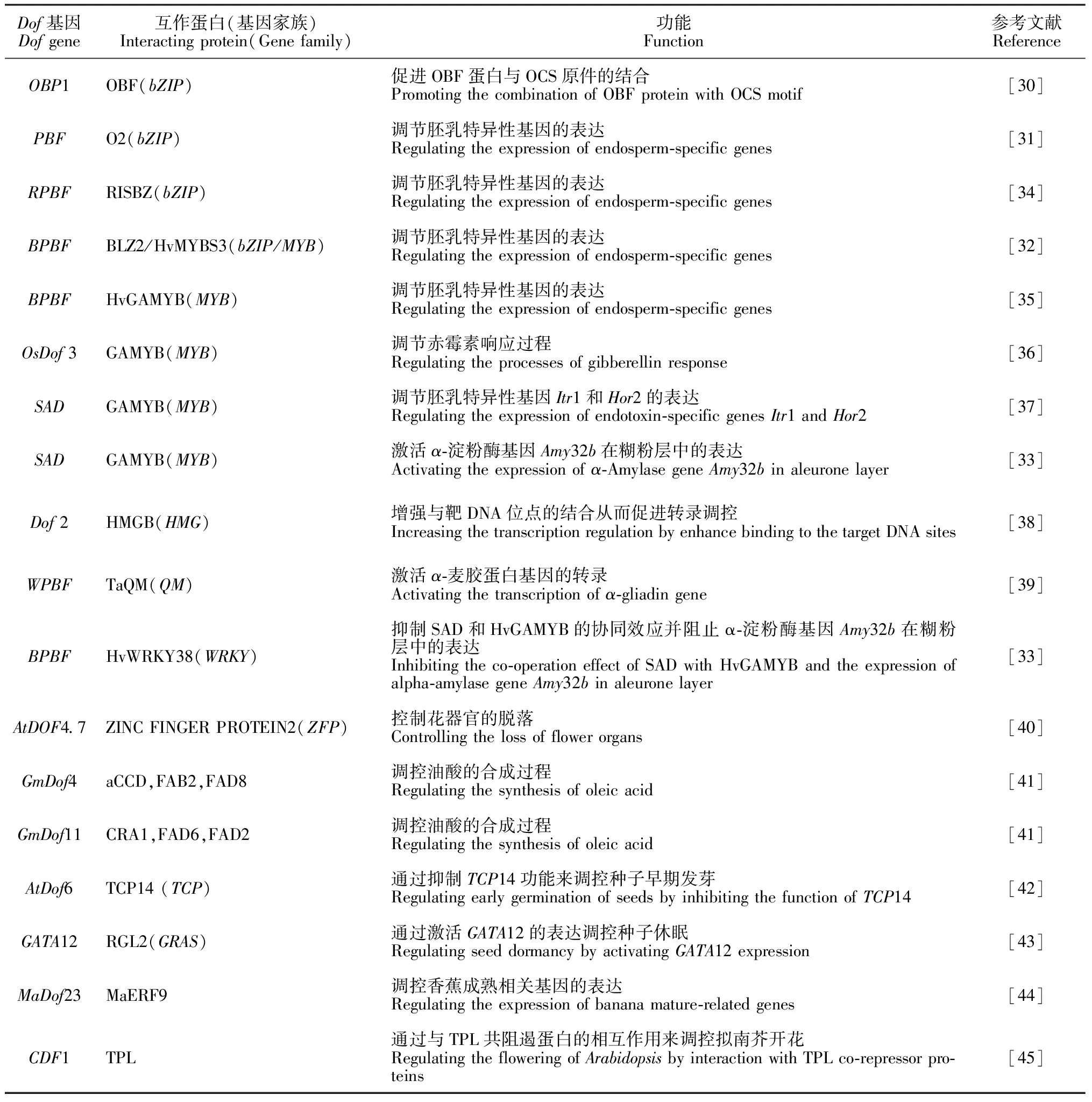
表2 Dof相互作用蛋白及其在植物生长和发育中的功能
4.1.3Dof基因参与植物保卫细胞的发育过程保卫细胞作为植物叶面表皮的重要组成成分,控制着气孔的开合,在植物气体交换与控制水分蒸腾方面发挥着重要作用。研究表明,植物Dof基因参与了保卫细胞的生长发育过程,如将拟南芥保卫细胞中特异性表达的AtMYB60基因的Dof蛋白结合位点删除后,发现AtMYB60基因的表达量发生了变化,从而影响了植物保卫细胞的发育[55];拟南芥植株AtSCAP1基因功能缺失后,导致气孔呈现不规则形状,从而缺乏控制气孔开闭的能力,进一步研究发现,SCAP1基因是通过调控GORK、AtMYB60、PYL2等下游基因的表达来调控保卫细胞的发育[56]。
4.1.4Dof基因参与植物组织分化的其他发育过程Dof基因家族成员除了参与植物的花药发育、开花响应、保卫细胞发育过程,还通过调控植物细胞周期、维管系统形成、叶片极性、花器官脱落等过程来直接或间接地影响植物的形态建成。已有研究报道,在拟南芥中过表达Dof转录因子AtOBP1,可缩短细胞周期[30];AtOBP3通过调控光敏色素和花青素来影响子叶的扩展和子叶下胚轴的伸长[47];AtDof4.1作为转录阻遏物影响着植株的开花和器官的尺寸(例如叶和拟南芥中的角果)[57];AtDof5.1通过启动REV基因的表达来调控植物器官发育[1];AtDof2.4和AtDof5.8参与了拟南芥叶和花芽维管系统的形成[47];AtDof4.7参与了花器官的脱落过程[40]。另外,毛竹Dof家族的部分基因如PheDof1、PheDof4、PheDof5、PheDof12、PheDof14、PheDof16也参与了花器官的形成发育过程[15,58-59]。
4.2 Dof基因与植物的种子/果实发育
4.2.1Dof基因参与植物种子/果实的萌发与休眠研究表明,种子萌发的过程受到赤霉素(GAs) 和脱落酸(ABA)的调控,Dof基因家族成员可通过对ABA和GA的合成代谢进行调节来调控种子的萌发。如拟南芥AtDof6基因可通过与TCP14蛋白相互作用,影响ABA的合成代谢来调控种子的萌发[42];AtDAG1基因可通过直接抑制GA生物合成基因GA3ox1和ABA分解代谢基因CYP707A2的表达来调控种子的休眠和萌发[60];AtDGA2行使与AtDAG1相反的功能参与种子的萌发过程[61];另有研究报道,桃的PpeDof基因及玉米的ZmDof3基因也在种子的萌发与休眠过程中发挥着积极的调控作用[27,62]。
4.2.2Dof基因参与植物种子/果实的成熟植物Dof蛋白一般通过调控种子/果实成熟相关基因的表达来影响果实的成熟。如草莓的FaDof2基因是一种与果实成熟相关的转录因子,由激素调控并作用于特定受体,其表达与丁香酚含量有关,在草莓成熟过程中沉默表达FaDof2基因,可抑制花托中涉及丁香酚产生的关键基因的表达,从而影响草莓的成熟[63];另外,香蕉的转录抑制因子MaDof23也可通过调控成熟相关基因(如MaEXP1/2/3/5、MaXET7、MaPG1)的表达来影响香蕉的成熟[44]。
4.2.3Dof基因参与植物种子/果实中蛋白质和脂肪的合成Dof转录因子除了影响植物种子/果实的休眠、萌发和成熟,还与蛋白质和脂肪的存储合成相关。在拟南芥中过表达GmDof4 和GmDof11,会增加种子发育期间种子的脂质含量,抑制种子贮藏蛋白基因CRA1的表达[64];在大豆中过表达GmDof11,可使转基因大豆种子的蛋白质含量降低,油脂含量增加[64];而在甘蓝型油菜中过表达GmDof4基因,可促进FAB2基因和FAD8基因的表达从而使种子中的油脂含量增加,蛋白含量降低[41]。
4.3 Dof基因与植物的代谢调节
4.3.1Dof基因参与单子叶植物的代谢调节Dof蛋白通过调控碳氮代谢相关基因的表达参与植物的代谢调节。在单子叶植物中,玉米Dof1和Dof2基因通过行使相反的功能影响C4循环中的PEPC羧化酶基因的表达,从而影响植物的碳代谢过程[65];将ZmDof1基因导入水稻,可増加水稻碳氮的积累,促进植株在低氮条件下的生长[66];此外,小麦TaDof1基因的超量表达可促进谷氨酰胺合成酶和谷氨酸酶的表达,进而影响了小麦的氮利用率[67];水稻OsDOF18基因可介导氨氮的运输和氮的分布,进而影响植物氮素的使用效率[68]。
4.3.2Dof基因参与双子叶植物的代谢调节研究表明,Dof蛋白还参与了拟南芥、番茄,茶树等双子叶植物生命活动的代谢调节过程。在拟南芥中用35S强启动子过表达水稻OsDof25基因,可促进铵转运蛋白基因AtAMT1.1和AtAMT2.1的表达,同时抑制硝酸盐转运蛋白基因AtNRT2.1的表达,从而导致总氨基酸浓度的增加[69];在番茄植株中分别超量表达拟南芥和番茄的CDF3基因,发现CDF3会引起初级代谢的变化,并促进氮同化进程[70];对茶树进行氮饥饿处理后再供给氮发现,CsCDF1基因在不同组织中对不同浓度氮的反应有上调的趋势[71]。此外,Dof基因还参与苯基丙酸、类黄酮和芥子油苷等次生代谢产物的合成过程,如在拟南芥中过表达AtDof4.2基因影响了苯丙酸的代谢途径,其黄酮类的合成受到抑制,而促进了肉桂酸的合成[72]。
4.3.3Dof基因参与苔藓类植物的代谢调节小立碗藓中的PpDof1蛋白是目前于苔藓类植物中报道的唯一一个参与代谢调节的Dof家族成员,在PpDof1基因功能缺失突变体中,小立碗藓原丝体配子托的形成延迟或者减少,并且在BCD培养基上PpDof1缺失突变体的菌落大小以及长丝侧枝的多少均受到培养基中外加碳氮源的影响[73]。
4.4 Dof转录因子与植物的逆境胁迫
4.4.1Dof基因响应植物的干旱胁迫目前已有研究表明,小麦Dof家族成员TaDof1、TaDof2、TaDof14、TaDof15是小麦在干旱、盐等逆境胁迫下的应答基因。TaDof14和TaDof15两个基因在干旱胁迫下上调[74];在 PEG脱水处理下,TaDof1、TaDof2 在小麦根和叶子中表达下调,但在干旱胁迫下,两基因在不同品种间差异表达[67,74];此外,水稻OsDof18基因以及高粱的SbDof12、SbDof19、SbDof24三个基因的表达也均受干旱胁迫的诱导[68,75]。
4.4.2Dof基因响应植物的盐胁迫Dof基因家族的许多成员能够影响转基因植株的耐盐能力。柽柳的ThDof1.4和ThZFP1基因可在体内形成一种转录调控级联,其表达可以增加脯氨酸含量,增强ROS的清除能力,从而提高柽柳对盐胁迫和渗透胁迫的耐受性[76];同样,对柽柳TheIF1A的功能研究也表明,Dof家族基因在参与植物逆境胁迫的响应过程中,能够影响转基因植株的耐盐能力[77];此外,在拟南芥中过量表达番茄的SlCDF1、SlCDF3基因,可通过激活各种胁迫响应基因(包括COR15、RD29A和RD10)的表达来增加植物的抗干旱性和耐盐性[50];另有研究报道拟南芥的部分Dof基因和小立碗藓的Dof1基因也富含NaCl敏感性,并在盐胁迫条件下具有上调表达的趋势[73]。
4.4.3Dof基因响应植物的高/低温胁迫高温和低温是植物生命活动中常遭遇的两种非生物逆境,Dof转录因子广泛参与植物的高低温胁迫响应过程。通过38 ℃高温和4 ℃低温胁迫处理茶树的3个不同品种后发现,3种茶树中的CsDof1和CsDof2基因表达量都高于对照组,且在不同茶树品种间存在差异[78];白菜受高低温胁迫处理后,其体内的Dof基因表达量会迅速升高[17];在低温条件下,过表达甘蓝型油菜Dof基因BnCDF1,植株的冷应答基因会表现出较高的表达水平[51]。
4.4.4Dof基因响应植物的激素胁迫Dof基因家族成员不仅参与干旱、脱水、高低温、NaCl等引起的非生物胁迫过程,还参与了ABA、AsA等引起的激素胁迫。通过qRT-PCR分析非生物胁迫下(包括干旱、高盐度和ABA)马铃薯Dof基因成员的表达模式,发现StDof基因在不同胁迫下的表达模式有很大差异,大部分StDof基因的表达在胁迫条件下会表现出上调的趋势[3];有研究显示,在毛果杨的Dof家族基因的启动子区域发现许多重要的应激或植物激素相关的顺式元件,进一步对其叶和根的表达谱分析发现,在渗透和ABA胁迫下,PtrDof基因家族中共有7个基因在叶和根中的表达始终表现为上调的趋势[21];除此之外,番茄中的SlDof22基因可通过与S1SOS1基因的启动子序列结合,负调控番茄中AsA的积累[79]。
4.4.5Dof基因响应植物多种非生物逆境胁迫通过对毛竹PheDof基因的表达谱进行分析发现,毛竹中的大部分PheDof基因在盐、干旱和冷处理下显示出较高的表达水平,并且这些PheDof基因在以上胁迫处理1 h后就表现为上调表达的趋势,这表明PheDof基因可能参与了毛竹的多重胁迫反应途径[59];值得注意的是,PheDof4-1基因的表达在干旱胁迫的幼茎中受到了诱导,而在叶片和根中则受到了抑制,但是在低温胁迫的根中,PheDof4-1基因的表达量则表现为急剧的增加[80]。近期研究表明,苹果Dof家族中的大部分成员对PEG、NaCl、冷胁迫以及外源ABA的处理都非常敏感[18];番茄Dof家族成员TDDF1在植物中的超量表达可以改善植物体对干旱、盐以及各种激素处理的耐受性,并增强对晚疫病的抵抗性[52];此外,在盐、脱水和伤害胁迫情况下,水稻OsDOF18基因可参与根表达基因OsRGLP2的转录激活,从而使转水稻OsRGLP2基因的烟草表现出很强的恢复能力[81]。
5 展 望
Dof基因家族成员广泛参与植物的光合调控、碳氮代谢、种子储藏蛋白的合成、次生代谢物的合成、种子发育及萌发、植物的保卫细胞调控、生物和非生物胁迫应答等过程,在植物生长发育过程中起到至关重要的作用[47]。自第一个Dof蛋白发现以来,随着基因组学和生物信息学的发展,利用插入突变、RNA干扰(RNAi)、基因瞬时表达、迁移率变动实验以及转基因技术,已经解析了大量Dof基因的生物学功能及其调控机理。但迄今为止,与该家族成员互作的基因所参与的转录调控网络尚不明确,且关于Dof 转录因子参与植物育性调控的研究仍鲜有报道。因此,今后应对 Dof 转录因子所参与的转录调控网络进行进一步解析,并尝试将具有不同功能的Dof基因家族成员应用于植物的性状改良。
(编辑:裴阿卫)
