羊草DHN3基因的克隆及其逆境响应的表达分析
2018-11-06万永青侯向阳王照兰马玉宝万其号万东莉
万永青,张 杰,侯向阳,王照兰,马玉宝,万其号,万东莉*
(1 中国农业科学院 草原研究所,农业部草地生态与修复治理重点实验室,呼和浩特 010010;2 内蒙古农业大学 生命科学学院, 内蒙古自治区植物逆境生理与分子生物学重点实验室,呼和浩特 010011)
植物在其生长的自然环境中不断地遭受各种生物和非生物逆境胁迫,为了在这样的条件下生存,植物进化出复杂的机制来感知外部信号,从而对环境刺激做出最佳的响应[1]。脱水素(dehydrins, DHNs)是2组LEA亚家族蛋白,其表达在种子发育后期大量积累,并且受缺水、盐、低温和ABA等不同逆境胁迫处理的诱导[2]。脱水素的表达能增加植物对低温、脱水、干旱、盐和渗透等胁迫的忍耐性[3-8]。脱水素最初在棉花发育的胚胎中被鉴定为“D-11”家族蛋白[9]。脱水素蛋白高度亲水,含有高比例的带电极性氨基酸和低比例的疏水性、非极性残基,且缺乏色氨酸和半胱氨酸残基[9]。根据保守序列Y-、S-和K-片段的包含方式,脱水素被分为五种类型:Kn、SKn、KnS、YnKn和YnSKn[4, 10]。其中K-片段(EKKGIMDKIKEKLPG或类似的序列)存在于所有的脱水素中,是一段高度保守的、赖氨酸富集的序列,与A2亲水性α-螺旋形成以及与一些大分子结合有关,位于接近于脱水素蛋白C末端的位置,每个脱水素含有一个或多个独特的K-片段[10-13]。Y-片段(V/TDEYGNP或类似的序列)与分子伴侣的核苷酸结合位点有部分相似性,位于接近于脱水素蛋白N末端的位置,一般有1~3个拷贝[8, 10]。S-片段(LHRSGSSSSSSSEDD 或相关的序列)是磷酸化位点,主要由5~7个连续的色氨酸残基和紧随其后的3个氨基酸组成[8, 11]。
羊草(Leymuschinensis(Trin.) Tzvel)隶属禾本科小麦族(TriticeaeDumort.)赖草属(LeymusHochst.),是欧亚大陆草原区东部草甸草原及典型草原上的重要建群种之一,在蒙古、俄罗斯和哈萨克斯坦以及中国的东北三省、内蒙古和新疆等省区广泛分布[14]。羊草具有极强的环境适应性,如极端温度、干旱和高盐碱[15]。近几年关于羊草抗逆基因的研究逐渐增多,如LcMYB1[16]、LcSAIN1[17]和LcSAIN2[18]提高了转基因拟南芥的耐盐性,LcFIN1[19]和LcWRKY5[20]分别提高了转基因拟南芥对冷和干旱的耐受能力,LcSAMDC1能同时提高转基因拟南芥对冷和盐的耐受性[21]。此外,MADS-box家族基因参与了羊草对非生物逆境胁迫的响应[22]。
本研究通过对羊草转录组数据中筛选获得的1个LcDHN3基因进行了克隆,对该基因及其蛋白编码序列进行生物信息学分析,通过荧光定量PCR(qRT-PCR)对不同逆境胁迫下LcDHN3基因的表达特性进行研究,为进一步开展LcDHN3参与逆境胁迫响应的功能研究提供基础数据。
1 材料和方法
1.1 植物材料与胁迫处理
将羊草“吉生4号”种子播种于装有蛭石和营养土(2∶1)的培养钵中,置于16 h光照/8 h黑暗、温度为23~25 ℃的温室培养。生长30 d后选取长势一致的羊草用于不同的胁迫处理。
干旱、盐、高pH、ABA和JA处理:将羊草植株从培养钵中取出并用清水清洗干净,将小苗置于滤纸进行干旱处理,将小苗根部分别浸泡在300 mmol/L NaCl溶液、200 mmol/L碳酸氢钠溶液(pH 10)、100 μmol/L ABA水溶液和100 μmol/L JA水溶液中进行盐、高pH、ABA和JA处理[23-25]。
冷、热和机械损伤处理:将羊草植株连同培养钵分别置于4 ℃和42 ℃培养箱中进行冷和热处理;将培养钵中羊草植株的每个叶片采用0.45 mm×15.5 mm的无菌针头穿刺3孔进行机械损伤处理。
在处理的不同时间点(0.5、1、3、6、12、24和48 h)取样,以0 h未处理样品作为对照。每个处理时间点取3株植物地上组织混合并迅速放入液氮速冻,于-80 ℃冰箱保存作为后续检测的样品。共进行3次生物学重复实验。
1.2 方 法
1.2.1总RNA提取及cDNA合成按照植物RNA提取试剂盒MiniBEST Plant RNA Extraction Kit(TaKaRa)的说明提取羊草地上组织总RNA。按照反转录试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser(TaKaRa)的步骤进行cDNA的合成。
1.2.2LcDHN3基因克隆将羊草转录组中筛选到的LcDHN3序列,通过NCBI的Blastx进行比对,采用DNAMAN7软件分析获得LcDHN3的ORF序列及其推导的氨基酸序列。
采用软件Primer Premier 5.0,设计LcDHN3基因的全长扩增引物LcDHN3-F/LcDHN3-R(表1)。以羊草cDNA为模板,进行RT-PCR扩增,扩增体系为:5×PrimeSTAR®缓冲液 10 μL,dNTPs(2.5 mmol/L)4 μL,正反向引物(10 μmol/L)各1 μL,cDNA 1 μL,PrimeSTAR®HS DNA 聚合酶 0.5 μL,ddH2O 32.5 μL。扩增程序为:98 ℃预变性1 min;98 ℃变性10 s,56 ℃退火10 s,72 ℃延伸40 s,30个循环;72 ℃补充延伸5 min,16 ℃保存。目的PCR产物经凝胶回收试剂盒(天根)回收后,与pEASY-BluntSimple载体(全式金)连接,将连接产物转化大肠杆菌DH5α,通过蓝白斑筛选后利用M13引物进行菌落PCR验证,将阳性克隆进行测序验证。
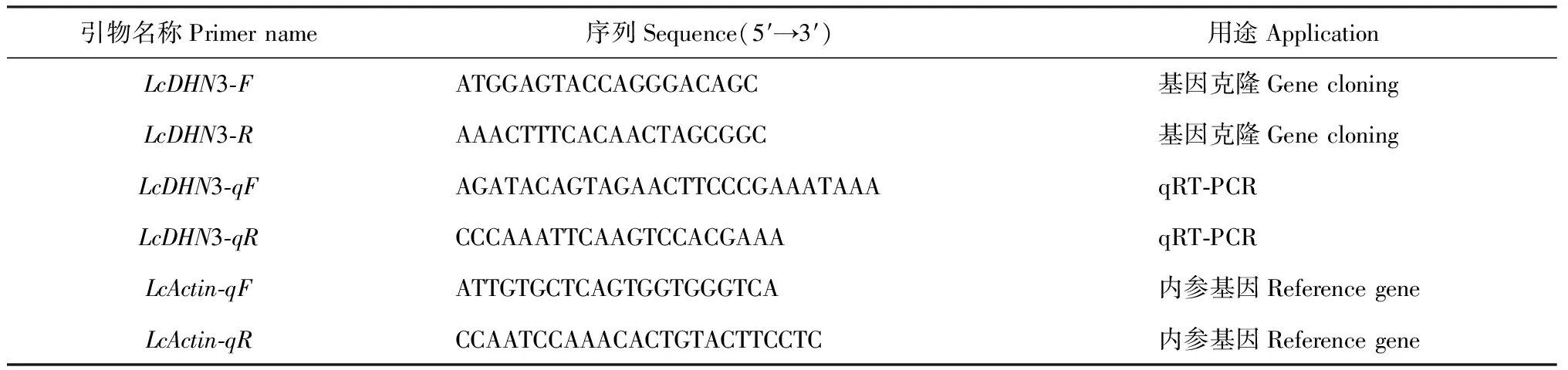
表1 引物序列
1.2.3序列生物信息学分析利用NCBI CDD(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)在线预测LcDHN3的保守结构域。
利用ExPASy数据库的在线软件ProtParam(https://web.expasy.org/protparam/)预测分析LcDHN3蛋白的等电点、分子质量、不稳定指数(instability index)、脂肪系数(aliphatic index)、平均亲水系数(grand average of hydropathicity,GRAVY)和各氨基酸的组成等。利用GOR4(https://npsa-prabi.ibcp.fr/cgi-bin/ npsa_ automat.pl?page=npsa_gor4.html)预测分析LcDHN3蛋白的二级结构。通过PSORT(https://www.genscript.com/psort.html),采用k-NN(k-nearest neighbor)算法,预测LcDHN3蛋白的亚细胞定位。
利用NCBI blastp进行在线比对分析,挑选出相似性较高的同源蛋白序列,利用DNAMAN7进行多重序列比对,结合PROSITE(https://prosite.expasy.org/)分析保守区域序列和基序。同时,从Blastp比对结果中挑取不同物种的同源序列。蒺藜苜蓿(Medicagotruncatula)和拟南芥(Arabidopsisthaliana)的同源序列分别从基因组数据库(http://www.medicagogenome.org/)和TAIR(https://www.arabidopsis.org/)中获得。运用MEGA6软件进行序列比对分析,采用邻近法(Neighbor-Joining)构建系统进化树。
1.2.4LcDHN3基因表达分析通过qRT-PCR技术对不同逆境胁迫处理下目的基因的表达量进行检测。利用罗氏 LightCycler 480 Real-Time PCR System,TaKaRa的SYBR Premix Ex Taq Ⅱ试剂盒进行qRT-PCR反应,具体参考方法[26]。以羊草LcActin为内参基因,采用2-ΔΔCT方法对LcDHN3基因的相对表达量进行分析。引物序列详见表1。
2 结果与分析
2.1 LcDHN3基因克隆与保守结构域分析
以羊草的cDNA为模板,根据转录组获得的羊草DHN3序列设计基因特异引物,PCR扩增获得的LcDHN3基因片段,经过测序验证,利用NCBI blastx进行比对分析,结果显示该基因具有完整的ORF,全长为501 bp(图1),起始密码子为ATG,终止密码子为TAG,编码167 aa,在GenBank的登录号为MH551243。
利用NCBI CDD分析显示,LcDHN3具有Dehydrin superfamily保守结构域(图2)。通过NCBI blastp比对结果显示LcDHN3与其他植物的DHNs具有较高相似性,其中与大麦(Hordeumvulgare)的DHN3相似性最高,为92%。与同属于禾本科植物小麦(Triticumaestivum)的salt-induced YSK2 dehydrin 2、长穗偃麦草(Thinopyrumelongatum)的dehydrin-/LEA group 2-like protein、粗山羊草(Aegilopstauschii)的dehydrin DHN3-like、 冰草(Agropyroncristatum)的drought acclimation dehydrin WZY2和二穗短柄草(Brachypodiumdistachyon)的dehydrin DHN3比对的相似性分别为88%、84%、83%、91%和73%。
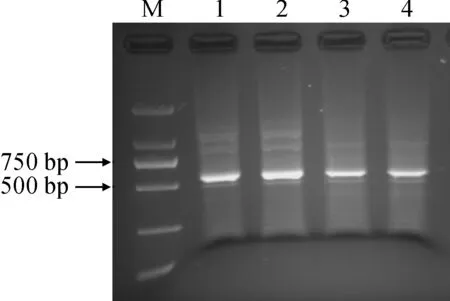
M.DL2000;1~4.LcDHN3 ORF图1 PCR克隆LcDHN3基因Fig.1 PCR cloning of LcDHN3 gene
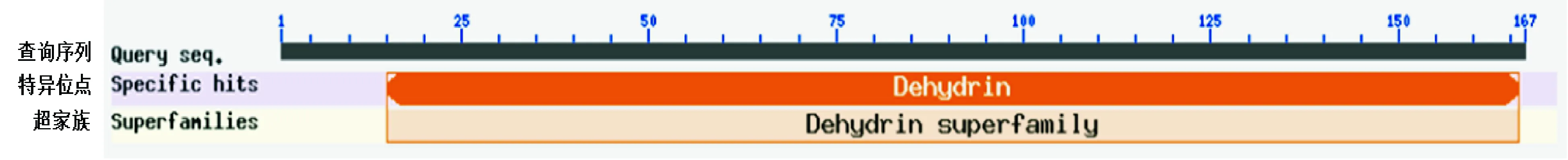
图2 LcDHN3蛋白功能位点分析Fig.2 Conserved domain analysis of LcDHN3 protein
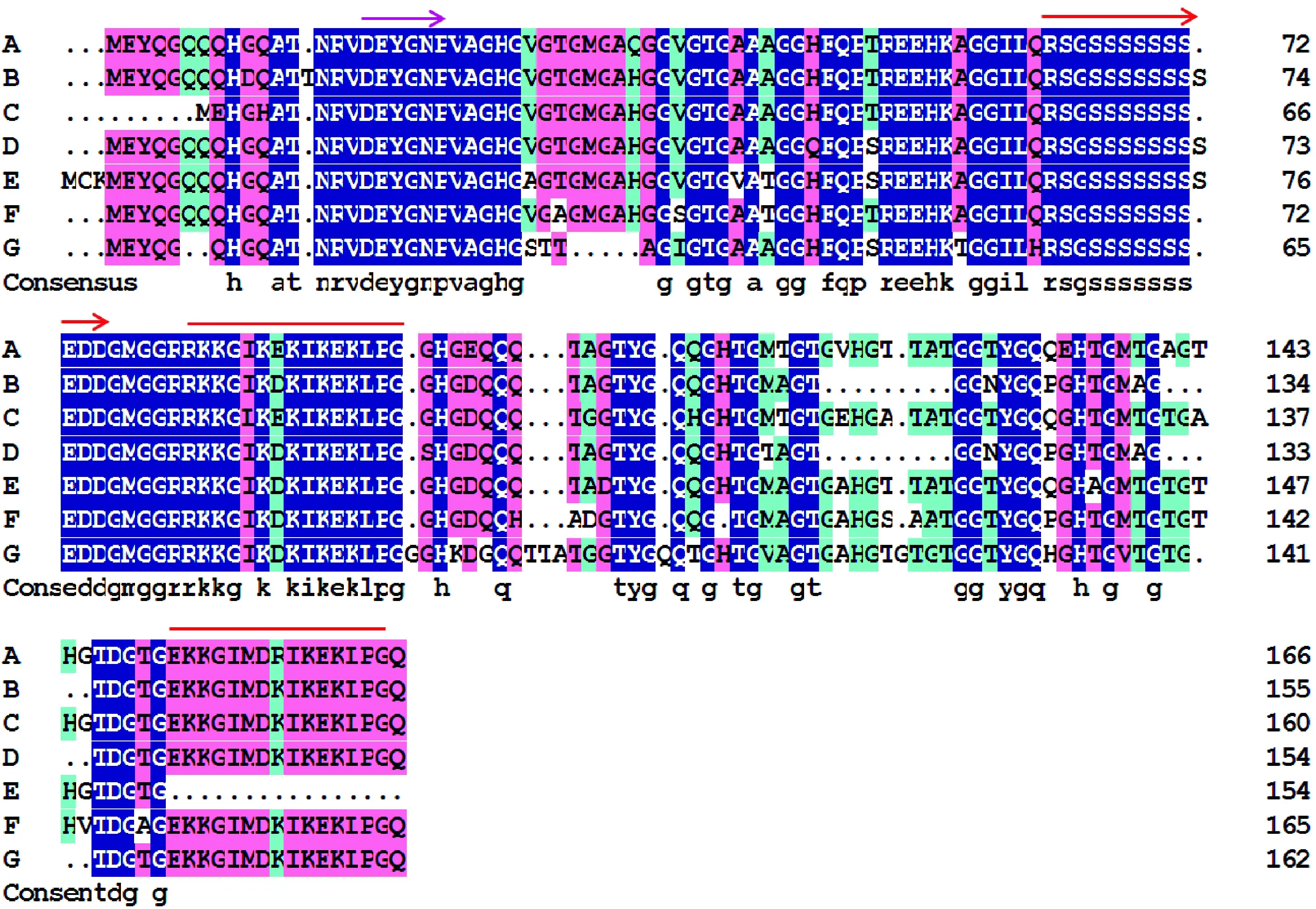
A. LcDHN3;B.长穗偃麦草(AAC05922.1);C. 大麦(ALL25871.1);D. 粗山羊草(XP_020188299.1);E. 冰草(AEJ88293.1);F. 普通小麦(AOM63238.1);G. 二穗短柄草(XP_010227582.1); 粉色箭头代表Y-片段,红色箭头代表S-片段,红色线段代表K-片段图3 LcDHN3与其他物种DHNs同源比对A. LcDHN3; B.Thinopyrum elongatum (AAC05922.1); C. Hordeum vulgare (ALL25871.1); D. Aegilops tauschii (XP_020188299.1); E. Agropyron cristatum (AEJ88293.1); F. Triticum aestivum (AOM63238.1); G. Brachypodium distachyon (XP_010227582.1); Pink arrow represents Y-segment, red arrow represents S-segment, red lines represent K-segmentsFig.3 Multiple alignment of LcDHN3 and homology sequences from other plants
2.2 LcDHN3蛋白理化特性分析
用在线软件ProtParam预测分析结果显示,LcDHN3分子量17.01 kD,理论等电点为8.05,氨基酸序列的分子式为C703H1120N234O248S6;LcDHN3蛋白的氨基酸组成中,不包含色氨酸和半胱氨酸,其中甘氨酸所占的比例最高为25.1%,苯丙氨酸所占的比例最低为0.6%。亲疏水性分析显示LcDHN3蛋白的总平均疏水指数小于0,为-1.085,表明属于亲水性蛋白。脂肪系数为33.35,不稳定指数为21.45,低于40,因此认为LcDHN3是稳定的蛋白质[27]。
GOR4在线工具预测结果显示,LcDHN3蛋白含有3种结构:其中无规则卷曲比例最多为59.28%,其次为延伸链比例为24.55%,α螺旋的比例最少为16.17%。通过PSORT对LcDHN3蛋白的亚细胞定位进行预测,结果显示LcDHN3在不同亚细胞定位的k-NN指数分别为:细胞质39.1%,细胞核34.8%,线粒体21.7%,高尔基体4.3%;NNCN(Reinhardt’s method)[28]预测结果为LcDHN3定位于细胞质,因此推测LcDHN3优先定位于细胞质和细胞核。
2.3 LcDHN3同源比较和系统进化分析
图3显示,LcDHN3与其他植物的DHNs氨基酸序列的整体相似性为84.27%。进一步结合PROSITE对LcDHN3的保守基序进行分析,结果显示LcDHN3含有1个Y-片段(位于N 端)、1个S-片段和2个K-片段(位于C端)(图3)。
聚类分析结果(图4)显示,LcDHN3蛋白与大麦的DHN蛋白聚为一个小的分支,然后与长穗偃麦草和粗山羊草的DHNs共同聚在一个较大的分支,表明LcDHN3蛋白与大麦的DHN亲缘关系最近,其次为长穗偃麦草和粗山羊草的DHNs,而与蒺藜苜蓿和拟南芥的DHNs关系较远。
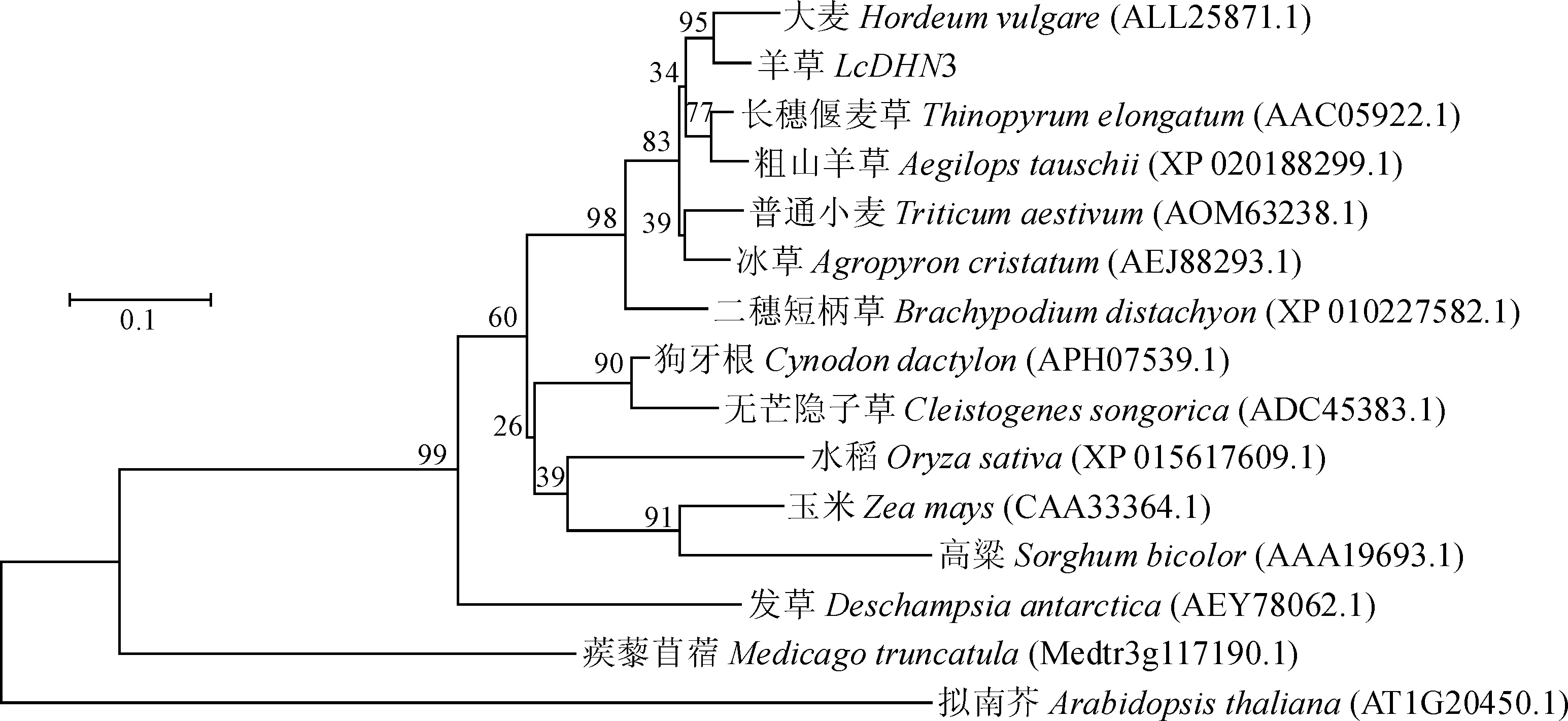
进化树采用邻近法构建,Bootstrap值设为1 000次图4 LcDHN3的系统进化树The phylogenetic tree is constructed using the neighbor joining method, Bootstrap values based on 1 000 replications.Fig.4 The phylogenetic tree of LcDHN3
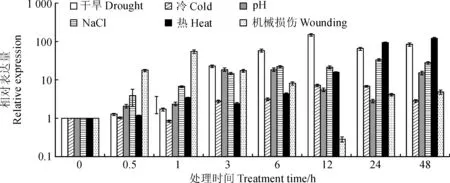
图5 不同逆境胁迫下LcDHN3的表达Fig.5 The expression patterns of LcDHN3 under different stress treatments
2.4 逆境胁迫下LcDHN3的表达分析
2.4.1非生物逆境胁迫下LcDHN3的表达图5表明,不同逆境胁迫处理均能强烈诱导LcDHN3基因表达。干旱和冷胁迫下,LcDHN3基因在处理3 h开始被诱导表达,12 h达到峰值,分别是对照的152和7倍。在NaCl胁迫下,LcDHN3基因在处理0.5 h被诱导表达,在24 h表达量达到最高,是对照的34倍。在热胁迫下,LcDHN3基因表达在处理1 h被诱导表达,随着处理时间呈递增趋势,在48 h时表达量最高为对照的121倍。高pH(10)处理下,LcDHN3基因表达在0.5 h开始被诱导表达,在3 h表达量达到峰值并持续到6 h,是对照的18倍,之后表达量开始下降,但是在处理48 h时,表达量又开始增加,达到对照的15倍。机械损伤胁迫0.5 h后,LcDHN3基因表达被迅速诱导,并在1 h时达到峰值,是对照的56倍。
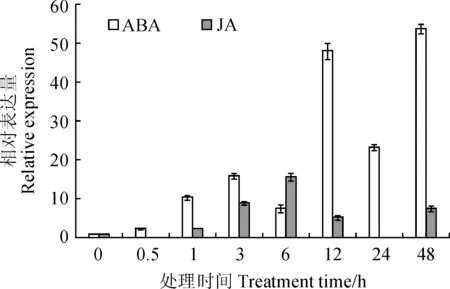
图6 ABA和JA处理下LcDHN3的表达Fig.6 The expression patterns of LcDHN3 under ABA and JA treatments
2.4.2相关激素胁迫下LcDHN3的表达图6显示,LcDHN3基因表达被ABA处理强烈诱导,在处理0.5 h时被诱导表达,是对照的2倍,在48 h达到峰值,是对照的54倍。同时,LcDHN3基因表达也受JA诱导,在处理1 h时被诱导表达,6 h时达到峰值,是对照的16倍。
3 讨 论
脱水素是研究最广、最具有特征的一类LEA蛋白[2],存在于已经研究的所有高等植物中[13],在大麦[29]、拟南芥[30]和水稻[31]中分别鉴定了13、10和8个DHNs。此外,DHNs也存在于藻类植物、苔藓类植物、酵母和蓝细菌等生物中[13, 32-33]。
本研究从羊草中克隆得到一个LcDHN3基因。通过同源蛋白序列比对显示其与大麦等6种植物同源序列的整体相似性为84.27%,表明具有较高的保守性。系统发育树显示LcDHN3与大麦的DHN亲缘关系最近,同时和长穗偃麦草和粗山羊草的DHN亲缘关系也较近。脱水素最显著的特征就是所有的DHN都含有至少一个拷贝的、保守的K-片段[33],保守基序分析显示LcDHN3含有2个K-片段(RKKGIKEKIKEKLPG和EKKGIMDRIKEKLPG),1个Y-片段(VDEYGNP)和1个S-片段(LQRSGSSSSSSSEDD),因此为YSK2型脱水素。理化特性分析显示LcDHN3是亲水蛋白,不含有色氨酸和半胱氨酸,这与脱水素所具有的特性一致[9]。
研究表明,DHN蛋白在植物生长发育过程中分布于不同的组织,亚细胞定位于不同的细胞器,包括细胞质、细胞核、质膜、线粒体和液泡,但是主要定位于细胞质和细胞核[33]。例如,玉米ABA响应蛋白rab17是一个YSK2型脱水素,亚细胞定位于细胞核和细胞质[34]。本研究通过NNCN(Reinhardt's方法根据氨基酸组成来判断细胞核或细胞质的倾向)分析LcDHN3优先定位于细胞质,同时在LcDHN3蛋白序列中预测到了一个YnSKn型脱水素特有的核定位信号“RRKK”,且拥有与核定位有关的S-片段[33],结合K-NN指数(细胞质39.1%,细胞核34.8%),推测LcDHN3可能同时定位于细胞质和细胞核。
脱水素在参与植物对逆境胁迫响应的信号途径中具有重要作用。例如,番茄(Solanumhabrochaites)的1个SK3型脱水素基因ShDHN在根、茎、叶、花和果实中具有组成型表达,同时在番茄耐冷品种(S.habrochaites)中的表达高于易感品种(S.lycopersicum)[3]。此外,ShDHN的表达受干旱、盐和渗透胁迫调节,过量表达ShDHN后增加了番茄耐受冷和干旱胁迫的能力,与野生型相比,转基因植物积累了脯氨酸,维持了超氧化物歧化酶和过氧化氢酶的较高酶活性,减少了膜的损伤[3]。在大麦和普通小麦中大多数的脱水素都属于YnSKn型,并且基因的表达受脱水胁迫(干旱、盐和霜)和ABA处理等的诱导[35]。黄瓜(Cucumissativus)CsLEA11蛋白是一个Y3SK2型脱水素,CsLEA11基因的转录受热和冷胁迫的显著诱导,在大肠杆菌中过量表达CsLEA11后能增强细胞的活力和对冷和热的耐受能力[36]。此外,CsLEA11蛋白可在高温胁迫下保护乳酸脱氢酶(lactate dehydrogenase)的活性[36]。高粱YSK2型脱水素基因SbDhn1的表达受高温和渗透胁迫的诱导,在烟草中过量表达SbDhn1后,转基因株系通过减少膜损伤和降低MDA含量,提高对逆境胁迫的耐受能力[37]。本研究中,YSK2型脱水素LcDHN3的表达受不同非生物逆境胁迫(干旱、盐、冷、热、高pH和机械损伤)以及植物激素ABA和MeJA的强烈诱导,表明LcDHN3参与了羊草对非生物逆境胁迫的响应,预示其在羊草响应非生物逆境胁迫中具有重要作用。但是LcDHN3在非生物逆境胁迫响应信号途径中如何作用以及处于什么位置还不清楚,亟待展开进一步的研究对其功能进行验证。
