食品和饲料中鹅源性成分微滴式数字PCR检测与定量分析
2018-11-06王强蔡一村张扬潘良文
王强,蔡一村,张扬,潘良文
(1.上海出入境检验检疫局动植物与食品检验检疫技术中心,上海 200135)
(2.扬州大学动物科学与技术学院,江苏扬州 225009)
肉类产品的种类鉴定和定量在食品安全监测当中具有重要作用,在一些欧洲国家,所有肉类产品均需要明确标注动物源性成分和所占比例[1],即便如此,肉类掺假事件仍然时有发生[2~5],极大的增加了消费者的不信任感,损害消费者利益,对食品安全带来挑战[6~8]。不同的定性或相对定量检测技术尤其是实时荧光PCR(real-time PCR)检测技术已经广泛的应用于食品和饲料的动物源性成分检测中[9~15]。与实时荧光PCR技术相比,数字PCR(digital PCR,dPCR)是近几年兴起的依据DNA拷贝数直接对成分进行精确定量的检测技术[16~20],可以不需要对照标准样本的标准曲线来实现精确定量分析[21,22]。因此,数字PCR相较于实时荧光PCR具有更准确、更灵敏、抗干扰等多种优势[23~26]。
由于现实生活中肉类产品的定义相对广泛,其组成成分也相对复杂,如皮肤、肌肉组织、脂肪和内脏等均可用作食品和饲料的原料,且在同一物种中不同的成分所包含的DNA含量也不尽相同[7],给定量检测带来较大困难。相较于其他形式的肉类成分,肌肉组织更常用作食品及饲料的原材料,用于直接烹饪和加工[27]。另外,线粒体基因作为靶基因在物种的定性检测中得到了广泛的应用,但由于线粒体基因在同一物种的不同组织中的含量差异巨大,不利于定量检测,而单拷贝核基因相较于线粒体基因具有拷贝数少且数量相对恒定等特点,具有准确且稳定的定量检测优势[24,28,29],有利于对肉类产品的定量检测。因此本项目利用微滴式数字PCR(droplet digital PCR,ddPCR)技术对食品和饲料中鹅源性成分的精确定量方法进行研究,通过建立单拷贝核基因的拷贝数与样品质量之间的线性关系对鹅源性成分进行精确定量。
1 材料与方法
1.1 材料与试剂
本实验使用的中国家鹅(Anser cygnoides domesticus)和欧洲家鹅(Anser anser domesticus)均取自扬州大学动物科学与技术学院,牛、绵羊、山羊、猪、鸡、鸭、兔子、鸽子、鲑鱼、鹅肉丸、烧鹅、酱鸭、五香鸭脖、鸭血、鸡肉香肠、鸡肉狗粮和鸡肉罐头为市售商业化肉类产品;水牛、马、驴、鹿、骆驼、猫、狗、狐狸、火鸡、野鸡、鹌鹑和小鼠样品均为本实验室留存的样品。选取动物肌肉组织切碎,利用烘箱80 ℃干燥72 h,使用液氮粉碎仪粉碎成超细粉末。
苯酚/氯仿/异戊醇、引物和探针,上海 Sangon Biotech公司;DNA提取裂解液、蛋白酶K溶液,北京Tiangen公司;醋酸钠上海Beyotime公司;超纯水美国Invitrogen公司;无水乙醇上海国药集团化学试剂有限公司;扩增预混液(ddPCRTMSupermix for Probes)、微滴生成专用油美国Bio-Rad公司。
1.2 仪器与设备
UFE500AO烘箱,德国Memeert公司;BSA224s电子天平,北京Sartorius公司;SPEX 6870液氮研磨仪,美国SamplePrep公司;Vortex Genius 3震荡仪,德国IKA公司;Thermomixer comfort恒温震荡孵育器、4515冷冻离心机,德国Eppendorf公司;NanoVue分光光度计,英国Biochrom公司;QX100数字PCR微滴生成仪、T100 PCR仪、QX200数字PCR微滴分析仪,美国Bio-Rad公司。
1.3 方法
1.3.1 引物与探针设计
选取中国家鹅单拷贝核基因序列(GenBank序列号:NW_013185870.1)[30]在NCBI中进行同源性比对,使用Primer Express® Software version 3.0设计引物和探针,引物及探针序列见表 1。再通过提取中国家鹅和欧洲家鹅共9个品系及其他21种动物物种的基因组DNA(表2),利用实时荧光PCR检测技术对所设计的引物和探针的种间特异性和种内保守性进行验证。

表1 引物及探针序列Table 1 Primers and probe sequences
1.3.2 样品DNA提取
使用苯酚/氯仿抽提法[31]对 10份质量分别为10~100 mg的鹅肉粉,每份样品3次重复,以及其他肉粉样品(各100 mg)进行DNA提取:加800 μL裂解液和10 μL蛋白酶K,65 ℃恒温震荡孵育60 min加入等体积苯酚/氯仿/异戊醇混匀后12000 r/min离心10 min,取上清液再进行一次酚/氯仿纯化后加入2倍体积的无水乙醇和1/10体积的3 M醋酸钠(pH 5.2)混匀,置于-20 ℃沉淀30 min后,12000 r/min离心30 min,使用75%乙醇漂洗两次并置于室温干燥后加100 μL超纯水复溶备用。
1.3.3 数字PCR检测
ddPCR反应体系为:上、下游引物各1.8 μL(900 nmol/L),探针 0.5 μL(250 nmol/L),ddPCRTMSupermix for Probes 10 μL,DNA 模板 4 μL,加水至20 μL。利用Bio-Rad QX100数字PCR微滴生成仪将20 μL体系混合物生成微滴,再利用 Bio-Rad T100 PCR仪进行扩增。ddPCR反应条件为:95 ℃预变性10 min,94 ℃变性30 s,60 ℃退火1 min,40个循环,98 ℃微滴固化10 min后,4 ℃保存。PCR反应结束后利用Bio-Rad QX200微滴分析仪读取DNA拷贝数。
1.3.4 样品DNA含量与靶基因拷贝数关系
将提取的鹅基因组DNA系列稀释至50、40、30、20、10、5、1 ng/μL共计7个浓度,并对上述7个浓度样品进行ddPCR检测,每个浓度3个重复。3次平行实验后,以平均值建立样品核酸含量与靶基因拷贝数之间的关系式。
1.3.5 LOD和LOQ
将ddPCR定量后的DNA稀释至100、50、10、5、1、0.1、0.01 copies/μL共计7个浓度,并对上述7个浓度样品进行ddPCR检测,每个浓度8个重复。通过3次平行实验,明确该方法的LOD和LOQ。
1.3.6 准确性与适用性
提取10份质量分数分别为 10%~100%的鹅肉粉混合样本和鹅肉丸、烧鹅、酱鸭、五香鸭脖、鸭血、鸡肉香肠、鸡肉狗粮、鸡肉罐头共8种市售商品(各100 mg)的基因组DNA,稀释后进行ddPCR检测,利用建立的定量检测方程,对鹅源性成分含量进行检测,通过3次平行实验,验证该方法的准确性和适用性。
2 结果与讨论
2.1 特异性
所选取的目标基因片段在NCBI中进行同源性比对,没有发现与其它物种存在任何交叉情况出现。利用实时荧光 PCR检测技术对所设计的引物和探针的特异性进行验证,结果显示只有中国家鹅和欧洲家鹅有特异性扩增,其他物种均无特异性扩增(表2),表明所设计的引物和探针在理论和实践中均具有良好的种间特异性和种内保守性。
2.2 样品质量与DNA含量关系

图1 鹅肉粉质量(mg)和核酸含量(ng/μL)间的线性关系Fig.1 Linear relationship between goose quantity (mg) and nucleic acid content (ng/μL)
使用NanoVue分光光度计将3次提取的各10份不同质量的鹅肉粉样品的基因组DNA进行浓度测定,每个样品检测3次。
结果表明鹅肉粉质量(mg)和相应的核酸含量(ng/μL)间存在线性关系,相关系数(R2)为0.998(图1)。

表2 引物及探针种间特异性检测结果Table 2 Exclusive specificity test results of the primer and probe
2.3 样品DNA含量与靶基因拷贝数关系
三次平行检测实验的统计结果显示,在浓度梯度范围内,鹅的核酸含量与靶基因拷贝数间存在线性关系,相关系数(R2)为0.998(图2)。

图2 DNA含量(ng/μL)与靶基因拷贝数(copies/μL)间的线性关系Fig.2 Linear relationship between target DNA content (ng/μL)and target DNA copy number (copies/μL)
2.4 建立定量检测方程
根据样品质量与DNA含量之间的线性关系以及DNA含量与靶基因拷贝数之间的线性关系两个关系式,建立样品质量与靶基因拷贝数之间的关系式如下:M goose=0.00136×C+0.856,其中C代表靶基因拷贝数(copies/μL),M代表样品的质量(mg)。在实际的检测过程中,由于数字PCR的检测范围有限,需要对所提取的样品基因组DNA进行稀释至图2所示的范围内,N代表稀释倍数,则样品质量与靶基因拷贝数之间的关系式转化为:M goose=N×0.00136×C+0.856。
2.5 LOD和LOQ
标准规定,当检出率≧95%时为最低检测下限,当相对标准偏差RSD≦25%时为定量检测下限[32]。三次平行检测实验的统计结果显示,靶基因拷贝数在 1 copy/μL 时的检出率≧95%,在 5 copy/μL 时的RSD≦25%,因此,该检测方法的LOD95%和LOQ分别为1 copy/μL 和 5 copies/μL(表 3)。

表3 LOD和LOQ检测结果Table 3 Results of the LOD and LOQ tests
2.6 准确性和适用性

表4 鹅肉粉已知含量检测结果Table 4 Quantification of samples with known concentrations of goose material
对10份已知质量分数的鹅肉粉混合样品检测结果显示,鹅肉粉混合样品定量检测结果与肉粉实际质量相对标准偏差均小于5%,相对误差均低于±5%(表4),符合定量检测要求,表明该ddPCR检测方法具有较高准确性。另外,对鹅肉丸、烧鹅、酱鸭、五香鸭脖、鸭血、鸡肉香肠、鸡肉狗粮和鸡肉罐头共8种市售商品的检测结果显示,鹅肉丸和烧鹅中鹅源性成分含量分别为43.44%和56.27%,其余6种商品未检出鹅源性成分(表5),即未发现鹅肉掺假其他肉类产品,表明该方法具有良好的适用性。
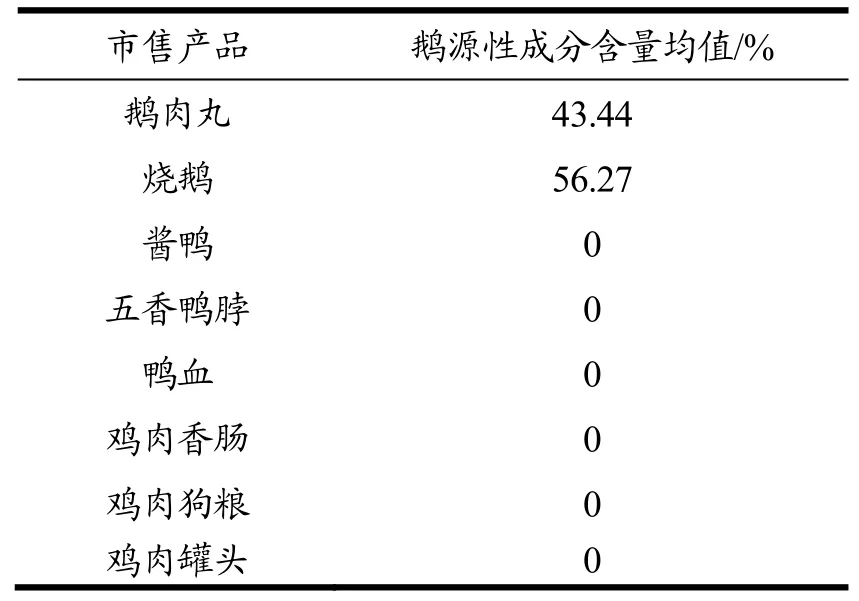
表5 市售商品定量检测结果Table 5 Quantification results of the commercial products
3 结论
本研究选择单拷贝核基因作为靶基因利用微滴式数字 PCR技术对食品和饲料中鹅源性成分进行检测与精确定量,通过构建鹅源性成分靶基因拷贝数与样品质量之间的线性关系对鹅源性成分进行精确定量检测,实现了从靶基因拷贝数到样品实际质量间的一步转化,无需利用相对质量分数来定义检测下线和定量检测下限,简化了定量过程。并对该方法的特异性、检测下限(LOD)和定量检测下限(LOQ)分别进行了验证,结果表明该方法具有良好的种间特异性和灵敏度,检测下限和定量检测下限分别为1 copy/μL和5 copies/μL;利用已知成分含量样品和市售商品对该方法的准确性和适用性进行了验证,结果显示鹅肉粉混合样品定量检测结果与肉粉实际质量相对标准偏差小于5%,相对误差低于±5%,且实验中的市售商品除明确已知的鹅源性商品外其余商品未发现鹅肉掺假其他肉类产品,说明该方法具有良好的准确性和适用性,可用于对食品和饲料中鹅源性成分进行检测和精确定量。该定量检测方法的建立,也可以应用于其他肉类食品和饲料的定量检测,为我国食品和饲料安全的市场监管和相关执法提供技术保障。另外,该方法还存在一定的不足之处,本研究以动物的肌肉组织为取样材料,未能对其他动物组织如皮肤、脂肪及内脏等进行全面的适用性验证,今后也将对上述问题进行进一步的研究和探索。
