剪切波弹性成像联合CEUS校正乳腺影像报告和数据系统3~5类乳腺病变
2018-11-06姜学忠王颖彦沈会明高亚琴胡中倩
戚 敏,姜学忠,李 嘉*,王颖彦,沈会明,高亚琴,胡中倩
(1.东南大学医学院,江苏 南京 210009;2.东南大学附属中大医院超声科,江苏 南京 210009;3.江苏省老年医院超声科,江苏 南京 210846)
超声是目前乳腺癌诊断中应用最广泛的影像学方法之一[1],现多采用美国放射学会(American College of Radiology, ACR)推荐的乳腺影像报告和数据系统(breast imaging reporting and data system,BI-RADS)作为定性诊断的标准[2],但此标准仍以形态学改变为观察指标,缺少诸如组织硬度、微血管分布等更多反映肿瘤特性的客观指标。而剪切波弹性成像(shear wave elastography, SWE)和CEUS可提供上述诊断信息[3]。本研究拟联合应用此两种新技术,用于乳腺肿瘤常规超声BI-RADS分类的校正,探讨其在鉴别诊断乳腺良恶性肿瘤中的价值。
1 资料与方法
1.1一般资料 选取2016年1月—12月于我院就诊的50例乳腺病变患者,均为女性,年龄24~82岁,平均(47.2±12.5)岁;共57个病灶,最大径0.56~4.00 cm,平均(1.86±0.83)cm。入组标准:常规超声BI-RADS分类为3~5类病灶;均获得病理结果;术前均接受常规超声、SWE和CEUS检查,且超声检查前未接受穿刺或任何治疗。排除标准:妊娠期或哺乳期女性;其他器官或全身严重疾病不适宜接受检查者;乳腺内有植入物者。
1.2仪器与方法 常规超声检查采用GE Logiq E9超声诊断仪,M6-15探头,频率9~16 MHz;SWE采用SuperSonic Aixplorer声蓝超声诊断仪,SuperLinear 15-4探头,频率4~15 MHz;CEUS采用百胜Mylab Twice超声诊断仪,LA523探头,频率3~9 MHz。造影剂采用声诺维(SonoVue),将5 ml生理盐水注入干粉内,反复震荡后形成微泡悬液备用。
嘱患者仰卧,充分暴露两侧乳房、锁骨上下及腋窝。以常规超声扫查双侧乳腺,以乳头为中心进行放射状序贯扫查,记录病灶大小、方位、形态、边缘、回声、血流等特征,进行BI-RADS分类。行SWE检查时,于乳腺病灶最大直径平面放置2个圆形ROI,1个置于包括相邻组织的病灶最硬处,另1个置于相同深度的正常脂肪组织处作为参照,测量病灶的最大弹性杨氏模量值(Emax)、最小值(Emin)、平均值(Emean)和标准差(SD),重复测量3次。行CEUS时,嘱患者平静呼吸,经肘正中静脉弹丸式注射微泡悬液2.4 ml,实时动态观察肿块内造影剂的灌注情况,动态图像采集时间均为120 s。观察以下征象并评分:增强后造影剂分布情况(均匀1分、不均匀2分),增强后病灶边缘(完整1分、模糊或不完整2分),增强后病灶大小改变(变小或不变1分、变大2分),增强后充盈缺损(无1分、有2分),增强后周围穿入血管(无1分、有2分),增强后造影剂进入时间(同进或慢进1分、快进2分)。每项评分相加即为病灶的最终得分。
1.3诊断方法
1.3.1常规超声BI-RADS分类方法 BI-RADS 3类和4a类病灶认为良性,4b、4c及5类病灶为恶性。
1.3.2SWE校正常规超声BI-RADS分类方法 采用ROC曲线获得鉴别诊断乳腺良恶性肿瘤的最佳参数及其临界值,以此为标准对病灶重新进行BI-RADS分类,将大于临界值者升级为5类,否则降级为3类。
1.3.3CEUS校正常规超声BI-RADS分类方法 采用ROC曲线获得CEUS诊断乳腺良恶性肿瘤的评分临界值,将大于临界值者升级为5类,否则降级为3类。
1.3.4SWE联合CEUS校正常规超声BI-RADS分类方法 采用多因素Logistic回归模型,获得回归方程,计算回归预测概率,将P>0.5病灶升级为5类,否则降级为3类。
1.4统计学分析 采用SPSS 22.0统计分析软件。计量资料以±s表示,采用独立样本t检验比较良恶性病灶的杨氏模量值。绘制ROC曲线评价各指标诊断乳腺良恶性病变的价值,获得AUC和诊断临界值。采用多因素Logistic回归,以逐步分析法获得SWE联合CEUS诊断乳腺良恶性病变的回归方程。P<0.05为差异有统计学意义。
2 结果
本组50例患者共发现57个病灶,病理结果显示良性病灶28个,其中乳腺纤维腺瘤15个,乳腺腺病5个,乳腺导管内乳头状瘤3个,乳腺炎性病变3个,良性纤维上皮性肿瘤、硬化性腺病各1个;恶性病灶29个,其中乳腺浸润性导管癌21个,乳腺导管原位癌4个,乳腺髓样癌、乳腺化生性癌、乳腺浸润性小叶癌、乳腺黏液癌各1个。
表1 乳腺良恶性病灶间杨氏模量值的比较(kPa,±s)
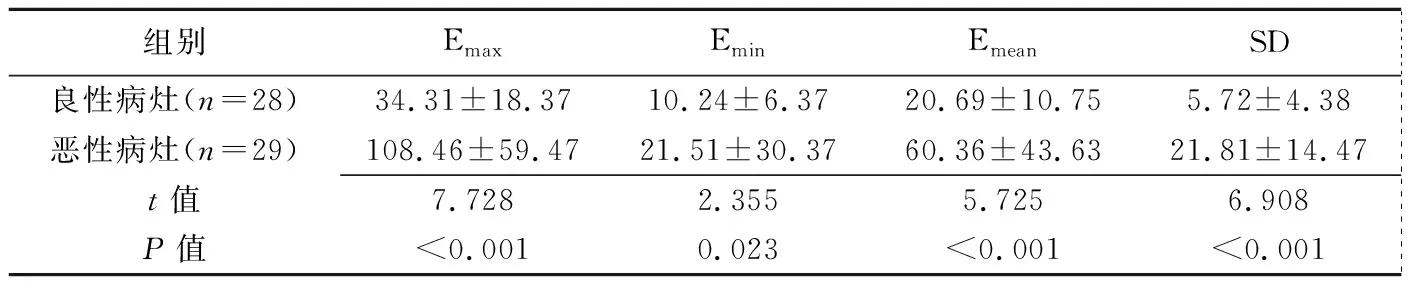
表1 乳腺良恶性病灶间杨氏模量值的比较(kPa,±s)
组别EmaxEminEmeanSD 良性病灶(n=28)34.31±18.3710.24±6.3720.69±10.755.72±4.38 恶性病灶(n=29)108.46±59.4721.51±30.3760.36±43.6321.81±14.47 t值7.7282.3555.7256.908 P值<0.0010.023<0.001<0.001
乳腺恶性病灶的Emax、Emin、Emean和SD值均高于乳腺良性病灶(P均<0.05),见表1。ROC曲线结果显示Emax、Emin、Emean和SD值诊断乳腺良恶性病灶的AUC分别为0.796、0.571、0.758和0.757(P均<0.05),其中Emax的AUC最大,临界值为87.2 kPa;CEUS评分诊断乳腺良恶性病灶的AUC为0.786(P<0.05),其诊断临界值为8.5分。以乳腺良恶性病灶为因变量,以SWE的弹性模量值Emax和CEUS的6项指标为自变量,进行多因素Logistic回归分析,最终纳入的变量为Emax(X1)和增强后病灶大小改变(X2),获得回归方程为Y(P)=-18.785+0.161X1+11.822X2。对该回归模型进行似然比检验,差异具有统计学意义(χ2=56.31,P<0.001),遂以上述模型诊断乳腺肿瘤良恶性,回归预测概率P>0.5为恶性。
常规超声BI-RADS分类及SWE、CEUS、SWE联合CEUS校正BI-RADS分类结果与病理结果对照见表2、图1、2,4种方法诊断乳腺良恶性病灶的效能见表3。
3 讨论
ACR制定的超声BI-RADS分类主要建立在形态学基础上,而一些良性增生性疾病在不同时期的病变特征不同,声像图表现差异较大,特别是形成局灶性结节时,常显示恶性病灶征象,如形态不规则、边缘不完整等[4],使得常规超声往往将这类肿块定义为4类或以上,导致其诊断敏感度高而特异度低[5]。本研究结果显示,常规超声BI-RADS分类诊断乳腺良恶性肿瘤的敏感度达89.66%,而特异度仅为39.29%,误诊率较高。在诊断指标中纳入其他组织特征,如肿块组织硬度和内部微血管情况[6-7],可能是改善其诊断效能的重要措施。本研究采用SWE联合CEUS,评价其对常规超声BI-RADS分类的校正意义。
SWE通过计算病灶组织的弹性模量值定量评价病灶的硬度[8-9]。本研究中,SWE将常规BI-RADS分类中4b类的9个病灶、4c类的3个病灶和5类的2个病灶正确降级为3类,但将2个4b类病灶、3个4c类病灶及2个5类病灶误降为3类,导致漏诊。考虑漏诊原因如下:①病灶较小,最大径均<1 cm,可能影响弹性值测定[10];②导管扩张积液,病灶呈沿管壁生长,呈狭长病灶,可能会影响弹性值的测定;③导管原位癌早期无明显间质反应,而化生性癌组织成分较复杂,弹性纤维和胶原纤维少,弹性值较低[11-12]。与常规超声相比,SWE在一定程度上提高了乳腺病灶的诊断特异度[13],本研究SWE的特异度为100%(28/28),但漏诊率也较高。

表2 SWE、CEUS及SWE联合CEUS校正常规超声BI-RADS分类及病理结果(个)

表3 常规超声BI-RADS分类、SWE、CEUS及SWE联合CEUS对乳腺良恶性病灶的诊断效能[%(个)]
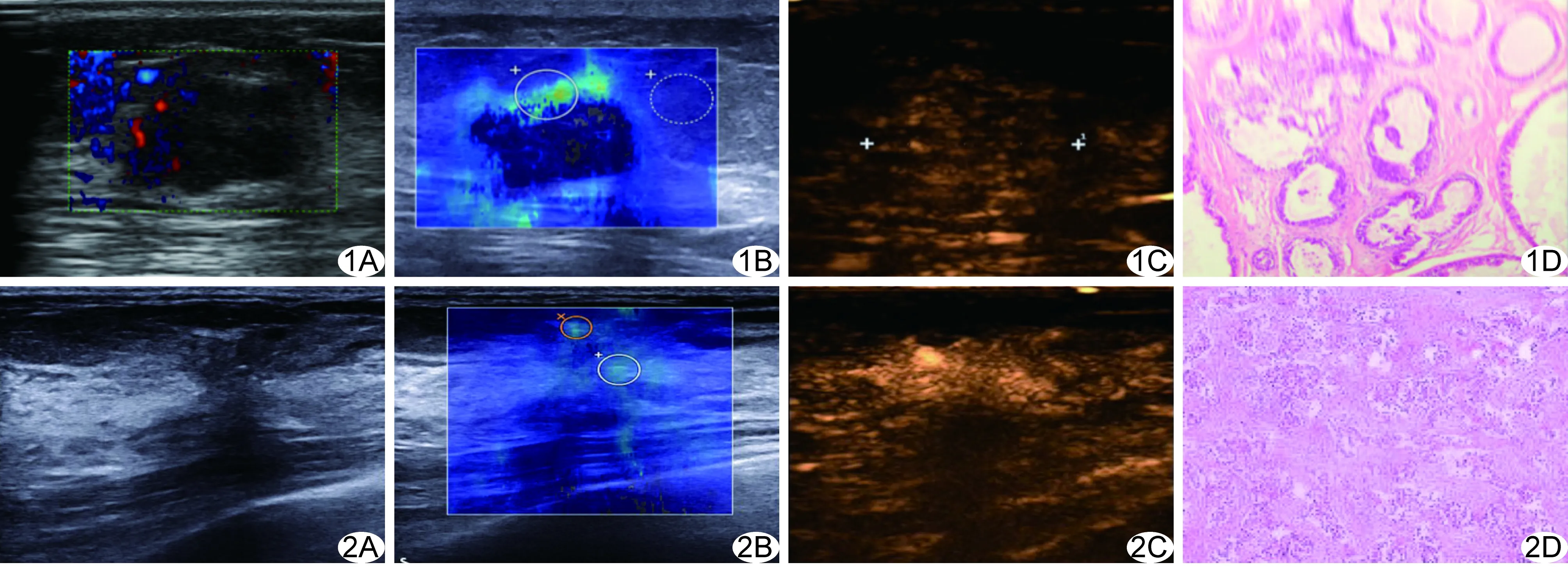
图1 患者39岁,左侧乳腺纤维腺瘤 A.常规超声BI-RADS分类为4b类; B.SWE图像,Emax为77.9 kPa,将BI-RADS分类降为3类; C.CEUS评分为8分,BI-RADS分类降为3类; D.病理图(HE,×400) 图2 患者34岁,右侧乳腺导管原位癌 A.常规超声BI-RADS分类为4c类; B.SWE图,Emax为60.2 kPa,BI-RADS分类降为3类; C.CEUS评分为11分,BI-RADS分类升为5类; D.病理图(HE,×200)
CEUS通过实时动态观察病灶组织的微血管灌注信息对良恶性病灶进行鉴别[14-15]。恶性病灶CEUS表现通常为高增强,强化不均,边缘不完整,增强后病灶变大,可伴有充盈缺损等[16]。本研究中,CEUS将常规BI-RADS分类中4b类的9个病灶(图1)、4c类的2个病灶正确降级为3类,诊断正确率达91.22%(52/57)。本组中有3个炎性病灶因CEUS表现为恶性、被错误升级为5类而误诊,究其原因,炎性病灶亦存在丰富新生血管,其周围炎性细胞浸润,而中心存在坏死[17],CEUS表现为快速高增强、增强后体积变大和充盈缺损等恶性表现,使其很难与恶性肿瘤鉴别。
本研究SWE联合CEUS诊断乳腺良恶性病灶的敏感度、特异度、诊断准确率为100%(29/29)、85.71%(24/28)和92.98%(53/57),为4种方法中最高。本研究中,通过建立多因素Logistic回归分析模型,将SWE漏诊的2个乳腺导管原位癌(图2)及1个化生性癌正确诊断为恶性,另将CEUS误诊的3例炎性病灶正确诊断为良性,表明二者联合应用可得出更准确的诊断。在联合诊断中有4个病灶(炎性病变3个,硬化性腺病1个)被误诊,可能原因如下:①炎性病灶部分伴钙化,因病灶组织硬度增加和血流灌注丰富而被误诊;②病灶体积较小,SWE和CEUS结果不准确[18];③硬化性腺病是一种病理学特征与乳腺癌极其相似的癌前病变,易于误诊。
综上所述, SWE联合CEUS增加了乳腺病灶的组织硬度和血管信息,能弥补常规超声仅根据病灶形态信息作出诊断的局限性,可用于校正乳腺病灶BI-RADS分类,尤其对BI-RADS 4类病灶意义更大。SWE联合CEUS,不仅可保持常规BI-RADS分类的高敏感度,还能显著提高诊断特异度,有望成为术前超声BI-RADS分类的有效辅助手段,有利于避免不必要的活检和手术。
