三江源区退化高寒草甸土壤微生物群落季节特征研究
2018-11-01尹亚丽王玉琴李世雄刘燕赵文马玉寿王宏生温灏宇
尹亚丽 ,王玉琴 ,李世雄 *,刘燕 ,赵文 ,马玉寿 ,王宏生 ,温灏宇
1. 青海大学/三江源生态与高原农牧业国家重点实验室,青海 西宁 810016;2. 青海大学畜牧兽医科学院,青海 西宁 810016;3. 青海省畜牧兽医科学院,青海 西宁 810016;4. 西北农林科技大学,陕西 杨凌 712100
高寒草甸是三江源区的代表性草地类型,其草层低矮,草质柔软,营养丰富,适口性好,是优良的牦牛和藏羊放牧场地(杨有芳等,2017)。然而,在草场超载过牧、全球气候变化、人类采挖沙金、旅游区的开发及一些大型工程的建设等人为因素和自然因素的共同影响下(Xue et al.,2009),三江源区高寒草甸出现不同程度的退化,其中约16%的草地严重退化为次生裸地“黑土滩”(杨永胜等,2017),这给当地农牧民生产生活带来了巨大影响,同时由草地退化引致的水土流失日趋严重,物种多样性减少,对三江源生态环境造成严重威胁(Ren et al.,2007;Yang et al.,2016)。
草地退化,更深层次的表现在其土壤环境的退化(牛磊等,2015)。土壤微生物作为草地地下生态系统最大的资源库,可推动整个环境中物质和能量的流动和转移(Yang et al.,2013;苟燕妮等,2015),是生物地球化学循环的主要驱动者,它们在调节有机质分解和营养物质循环等生态系统功能方面发挥着重要作用(付刚等,2017)。微生物生命周期短,对生存的微环境十分敏感,能对土壤生态变化和环境胁迫作出快速反应。土壤微生物群落结构的变化可作为衡量草地生态环境功能的指标,可较好地指示草地生态系统的健康变化(牛磊等,2015;付刚等,2017;Royertardif et al.,2010),并能够反映某个地区土壤退化或恢复的程度(曹成有等,2011)。因此,分析微生物对不同碳源利用能力的差异,开展不同退化程度高寒草甸土壤微生物群落功能多样性研究,对草地健康状况评价、生态环境保护、草地恢复重建与可持续利用具有重要理论和实践意义。
目前,国内外学者已开展了一些关于退化高寒草甸在放牧干扰、围栏封育、人工施肥及气候变化等人为和自然因素扰动下土壤微生物生物量及微生物数量等变化的研究工作(苟燕妮等,2015;付刚等,2017;胡雷等,2014),但有关不同程度退化高寒草甸土壤微生物群落功能多样性季节变化的研究报道较少。微生物对环境的作用主要是通过群落代谢功能的差异来实现的,Biolog-ECO法通过检测微生物对不同碳源的代谢强度来判断微生物活性和多样性大小,进而反映微生物群落功能的多样性,是目前被广泛应用的研究微生物代谢功能多样性的方法之一。鉴于此,本研究以三江源区不同退化程度高寒草甸为研究对象,采用Biolog-ECO法解析草地土壤微生物群落时空变化特征,明确不同土层土壤微生物群落在不同季节的变化规律,为草地可持续利用和退化草地恢复重建提供理论基础。
1 材料与方法
1.1 试验地概况
试验地位于青海省果洛州玛沁县大武镇(34°27′56.9″N,100°13′6.5″E,海拔约 3700 m)三江源国家自然保护区。该区昼夜温差大,日照时间短,太阳辐射强,寒冷、多风,属典型高原大陆型气候。年均气温为-3.9 ℃,最冷月平均气温为-12.6 ℃,最热月平均气温为 9.7 ℃;年降水量为513.2~542.9 mm,多集中在 6—9月,年蒸发量为2471.6 mm。牧草生长季约156 d,全年无绝对无霜期。草地为高寒矮嵩草草甸,土壤为高山草甸土,土壤pH为6.4~8.3,土壤含水量为19.7%~49.7%,土壤有机质为48.0~140.0 g·kg-1(尹亚丽等,2017)。
1.2 样地设置与样品采集
依据草地生产力、植被盖度、可食牧草比例和草场质量等指标(马玉寿等,2002),在水热及地形状况基本一致的高寒草甸设置未退化(ND)、轻度退化(LD)、中度退化(MD)、重度退化(SD)和极重度退化-黑土滩(ED)草地等5个处理,各4次重复。各重复样地面积约80 m2,重复样地间隔3~5 m。分别于2016年5月(返青期)、8月(生长期)和11月(枯黄期)(宛敏渭等,1979;丁明军等,2011;赵雪雁等,2016)用直径为3.5 cm的土钻采集0~10 cm和10~20 cm土样,每试验地沿对角线取5~8点土壤混合为1个土样,共120份土样。新鲜土样过2 mm筛,去除枯物、石粒及根系等,分装入自封袋,夹棉塞封口,置于冰盒中,带回实验室于4 ℃冰箱中保存,并在一周内进行检测。
1.3 研究方法
土壤微生物群落功能多样性采用 Biolog-ECO法测定(党雯等,2015;高晓奇等,2014),文中数据为培养168 h的测定值。
平均颜色变化率(AWCD)是表征土壤微生物群落活性和多样性大小的一个重要指标,AWCD值的大小反映了土壤微生物群落利用单一碳源的能力(党雯等,2015;高晓奇等,2014):

式中,Ci为第i孔反应孔在590 nm下的吸光值;R为对照孔吸光值;n为碳源种类数,为31;若Ci-R小于0,则在计算中将其记为零,即Ci-R的值均大于或等于0。
McIntosh指数(U)是基于群落物种多维空间上的 Euclidian距离的多样性指数(邹春娇等,2016),用来衡量群落均一性程度:

式中,ni为31种碳源的平均值。
1.4 数据分析
运用Excel 2016和SPSS 19.1软件对数据进行差异显著性和主成分分析。采用单因素(One-way ANOVA)、Duncan和Kruskal-Wallis进行方差分析和秩和检验(P=0.05)。运用Excel 2016软件作图,图表中数据均为平均值±标准差。
2 结果与分析
2.1 土壤微生物群落活性及群落多样性的季节特征
表1数据显示,培养168 h后不同生育期各试验地0~10 cm土层土壤AWCD值均高于10~20 cm土层,返青期各草地0~10 cm和10~20 cm土层间均无显著差异;生长期除重度退化草地外,其他草地0~10 cm和10~20 cm土层均存在显著差异;枯黄期,未退化、轻度和中度退化草地 0~10 cm 和10~20 cm土层间差异显著,重度和黑土滩退化草地两土层间无显著差异。同一生育期,在0~10 cm和10~20 cm土层,AWCD值随草地退化程度的加重未表现一致的变化规律,但两土层均以中度退化草地为最低(表1)。返青期,在0~10 cm和10~20 cm土层,AWCD值在不同退化程度草地间均无显著差异。生长期,在0~10 cm土层,仅未退化和中度退化草地间差异显著;在10~20 cm土层,未退化和轻度退化草地 AWCD值显著高于中度退化和黑土滩退化草地,黑土滩退化草与和中度退化草地和重度退化草地间差异均不显著。枯黄期,在0~10 cm土层,未退化与中度退化和黑土滩草地间差异显著,其他草地间无显著差异;在10~20 cm土层,中度退化草地 AWCD值显著低于其他草地,未退化、轻度退化、重度退化和黑土滩草地间差异不显著(表 1)。高寒草甸在返青期、生长期和枯黄期0~10 cm土层土壤微生物AWCD值分别为0.72、0.97和0.78,返青期和枯黄期显著低于生长期,且二者间无显著差异;在10~20 cm土层,AWCD值在不同生育期间均无显著差异。三因子交互作用分析显示,季节×土层对土壤微生物AWCD值具有显著影响(表2)。

表1 退化高寒草甸土壤微生物平均颜色变化率AWCD季节特征Table 1 Seasonal characteristics of soil microbial AWCD at degraded alpine meadows
从表 3可见,U指数在各试验地 0~10 cm和10~20 cm间变化规律不一致,返青期各草地0~10 cm和10~20 cm土层间均无显著差异;生长期和枯黄期均呈上高下低变化趋势,其中生长期,中度退化和黑土滩草地0~10 cm和10~20 cm土层间差异显著,未退化、轻度退化和重度退化草地未见显著差异;枯黄期,中度退化草地0~10 cm 土层U指数显著高于10~20 cm,其他草地差异不显著。同一生育期,在0~10 cm和10~20 cm土层,均以中度退化草地U指数为最低(表3)。返青期,在0~10 cm和10~20 cm土层,U指数在不同退化程度草地间均无显著差异;生长期,在0~10 cm土层,未退化和中度退化草地间差异显著,其他草地间差异不显著,在10~20 cm土层,未退化、轻度退化和重度退化草地U指数显著高于中度退化草地,黑土滩退化草地与中度退化和重度退化草地间差异不显著;枯黄期,在0~10 cm土层,未退化与中度退化草地间差异显著,其他草地间无显著差异,在10~20 cm土层,中度退化草地显著低于其他草地,未退化、轻度退化、重度退化和黑土滩草地间差异不显著(表 3)。高寒草甸在返青期、生长期和枯黄期土壤微生物群落U指数分别为4.69、5.92和4.97,返青期和枯黄期显著低于生长期,且二者间无显著差异;在10~20 cm土层,U指数在不同生育期间差异不显著。三因子交互作用分析显示,季节×土层对土壤微生物U指数具有显著影响(表2)。
2.2 土壤微生物群落碳代谢指纹时空分异特征
2.2.1 0~10 cm土壤微生物群落对6类碳源相对利用率分析
依据 Biolog-ECO板碳源化学基团的性质,将土壤碳源分为糖类、氨基酸类、酯类、醇类、胺类和羧酸类。由图1可知,培养168 h后,不同退化程度草地0~10 cm土层土壤微生物群落在不同生育期对6类碳源的相对利用率不同。返青期,0~10 cm土层土壤微生物对糖类的相对利用率在中度退化草地最低,与未退化和轻度退化草地间差异显著;未退化草地土壤微生物对氨基酸类的相对利用率显著低于中度和重度退化草地,其他草地间差异不显著;轻度退化草地对酯类的相对利用率最低,与其他草地相比差异显著;土壤微生物群落对醇类的相对利用率在不同草地间差异不显著;中度退化草地对胺类的相对利用率显著低于未退化、轻度退化和黑土滩退化草地,其他草地间差异不显著;轻度退化草地对羧酸类的相对利用率显著低于中度退化草地,未退化、中度退化、重度退化和黑土滩退化草地间差异均不显著(图1)。
生长期,土壤微生物群落对酯类的相对利用率在轻度退化草地中最高,与中度和重度退化草地间差异显著;微生物群落对其他5类碳源的相对利用率在不同草地间差异不显著(图1)。
枯黄期,土壤微生物群落对糖类、氨基酸类、酯类和羧酸类碳源的相对利用率在不同草地间无显著差异;轻度退化草地对醇类的相对利用率最高,与中度退化草地相比差异显著,其他草地间均无显著差异;中度退化草地对胺类的相对利用率最高,显著高于轻度和黑土滩退化草地,其他草地间差异不显著(图1)。
0~10 cm土层土壤微生物群落对6类碳源的利用情况随着生育期的延长而表现各异。返青期,土壤微生物对氨基酸类和酯类的相对利用率显著高于其对糖类、醇类、胺类和羧酸类的利用率,其他碳源间差异不显著;生长期土壤微生物群落对氨基酸类和糖类的相对利用率最高,显著高于醇类、胺类和羧酸类;枯黄期,土壤微生物对氨基酸的相对利用率最高,与其他碳源相比差异显著,对羧酸类碳源的相对利用率最低,显著低于对氨基酸类、酯类和胺类碳源的相对利用率。不同生育期土壤微生物群落对 6类碳源的相对利用率差异主要体现在酯类和醇类碳源,对其他碳源的相对利用率差异不显著。
2.2.2 10~20 cm土壤微生物对6类碳源利用率分析
由图2可知,返青期,10~20 cm土层土壤微生物群落对糖类、氨基酸类、酯类、醇类和羧酸类的相对利用率在不同退化程度草地间均无显著差异;微生物群落对胺类的相对利用率在中度退化草地中最低,显著低于未退化和黑土滩退化草地,其他草地间差异不显著。
生长期,除胺类碳源外,10~20 cm土层土壤微生物群落对碳源的相对利用率在不同草地间均无显著差异。未退化草地对胺类碳源相对利用率显著高于其他草地,轻度、中度、重度和黑土滩退化草地间差异均不显著(图2)。

图1 退化高寒草甸不同季节0~10 cm土壤微生物对6类碳源的相对利用率Fig. 1 Seasonal relative utilization rates of 6 groups of carbon sources by 0~10 cm soil microbes at degraded alpine meadows Ch: Carbohydrates; Aa: Amino acids; Es: Esters; Al: Alcohols; Am: Amines; Ca: Carboxylic acids. The same below

图2 退化高寒草甸不同季节10~20 cm土壤微生物对6类碳源相对利用率Fig. 2 Seasonal relative utilization rates of 6 groups of carbon sources by 10~20 cm soil microbes at degraded alpine meadows
枯黄期,重度退化草地土壤微生物群落对糖类相对利用率最高,与黑土滩草地相比差异显著;黑土滩退化草地对氨基酸类碳源的相对利用率最高,且显著高于重度退化草地;土壤微生物群落对酯类的相对利用率在中度退化草地中最高,与重度退化草地相比差异显著;土壤微生物群落对醇类和羧酸类碳源相对利用率在不同草地间差异不显著;黑土滩退化草地对胺类的相对利用率最高,显著高于未退化草地(图2)。
图2数据显示,返青期,10~20 cm土层土壤微生物群落对氨基酸类和酯类的相对利用率显著高于其对糖类、醇类、胺类和羧酸类的相对利用率,其他类碳源间未表现出显著差异;生长期土壤微生物群落主要利用氨基酸类、酯类和胺类碳源,其次是醇类和羧酸类碳源,对糖类碳源的相对利用率最低;枯黄期土壤微生物群落对氨基酸类碳源相对利用率显著高于其他碳源,对糖类碳源的相对利用率最低,显著低于其他碳源。不同生育期土壤微生物群落对6类碳源的相对利用率差异主要体现在糖类和胺类碳源,而对其他碳源的相对利用率差异不显著。
2.3 土壤微生物群落功能主成分分析
对不同退化程度草地土壤微生物培养168 h后各碳源的AWCD值进行主成分分析。由图3A可知,返青期0~10 cm土层第1、2主成分得分贡献率分别为 49.4%和 21.8%,累计贡献率为 71.2%。未退化、轻度退化、中度退化、重度和黑土滩退化草地分散于4个不同象限,即随草地退化程度加重,土壤微生物对碳源利用能力出现较大差异,未退化草地土壤微生物对碳源具有较好的利用能力,重度和黑土滩退化草地土壤微生物对碳源的利用能力相似(图3A)。氨基酸类在PC1的权重较大,是PC1分异的主要碳源;糖类在 PC2有较大的载荷,是PC2分异的主要碳源(表 4)。经 Kruskal-Wallis检验,在 PC1和 PC2,各草地间差异均不显著(P=0.40,P=0.08)。
10~20 cm土层第1、2主成分得分贡献率分别为 65.1%和 16.9%,累计贡献率 82.0%。未退化、中度、轻度和重度退化、黑土滩退化草地依次分散于第一、第二、第三和第四象限,未退化草地土壤微生物对碳源的利用能力较强(图3B)。羧酸类和胺类在PC1具有较大的载荷,是PC1分异的主要碳源;醇类在PC2有较大的载荷,是PC2分异的主要碳源(表4)。在PC1和PC2,不同草地间差异均不显著(P=0.43,P=0.27)。
生长期0~10 cm土层两个主成分贡献率累计为67.3%,其中第1主成分得分贡献率为48.2%。未退化草地土壤微生物群落对碳源利用能力在 PC1轴与其他草地间差异较大,重度和黑土滩退化草地,轻度和中度退化草地对于碳源的利用能力较为相似(图 3C)。醇类、羧酸类、氨基酸类和酯类在PC1的权重较大,是PC1分异的主要碳源;胺类在PC2有较大的载荷,是PC2分异的主要碳源(表4)。在 PC1和 PC2轴上,不同草地间均无显著差异(P=0.26,P=0.53)。
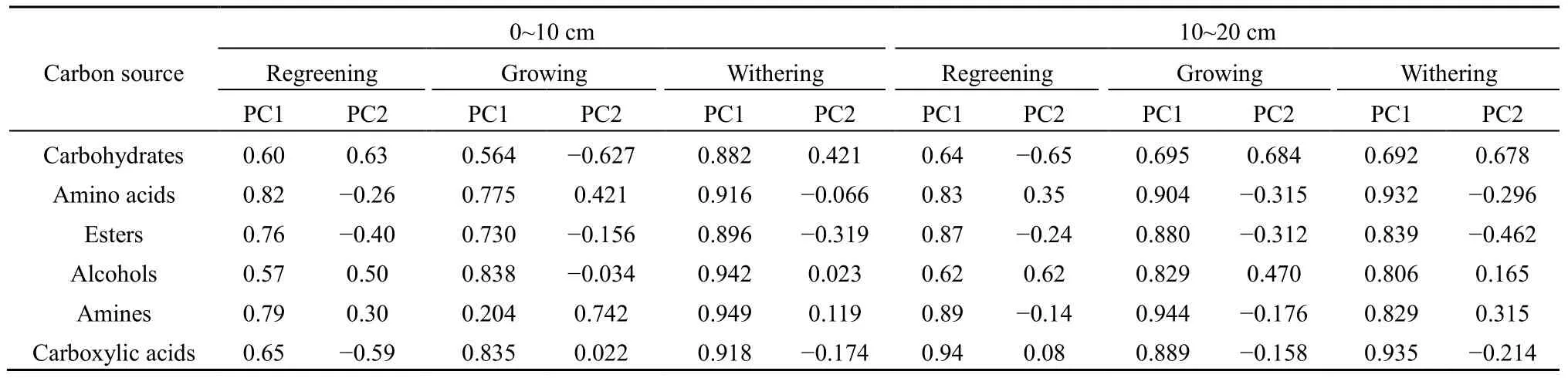
表4 六类碳源在PC1和PC2上的载荷值Table4 6 Carbon substrates loaded on the 1st and 2nd principal components in analysis of ECO microplate data
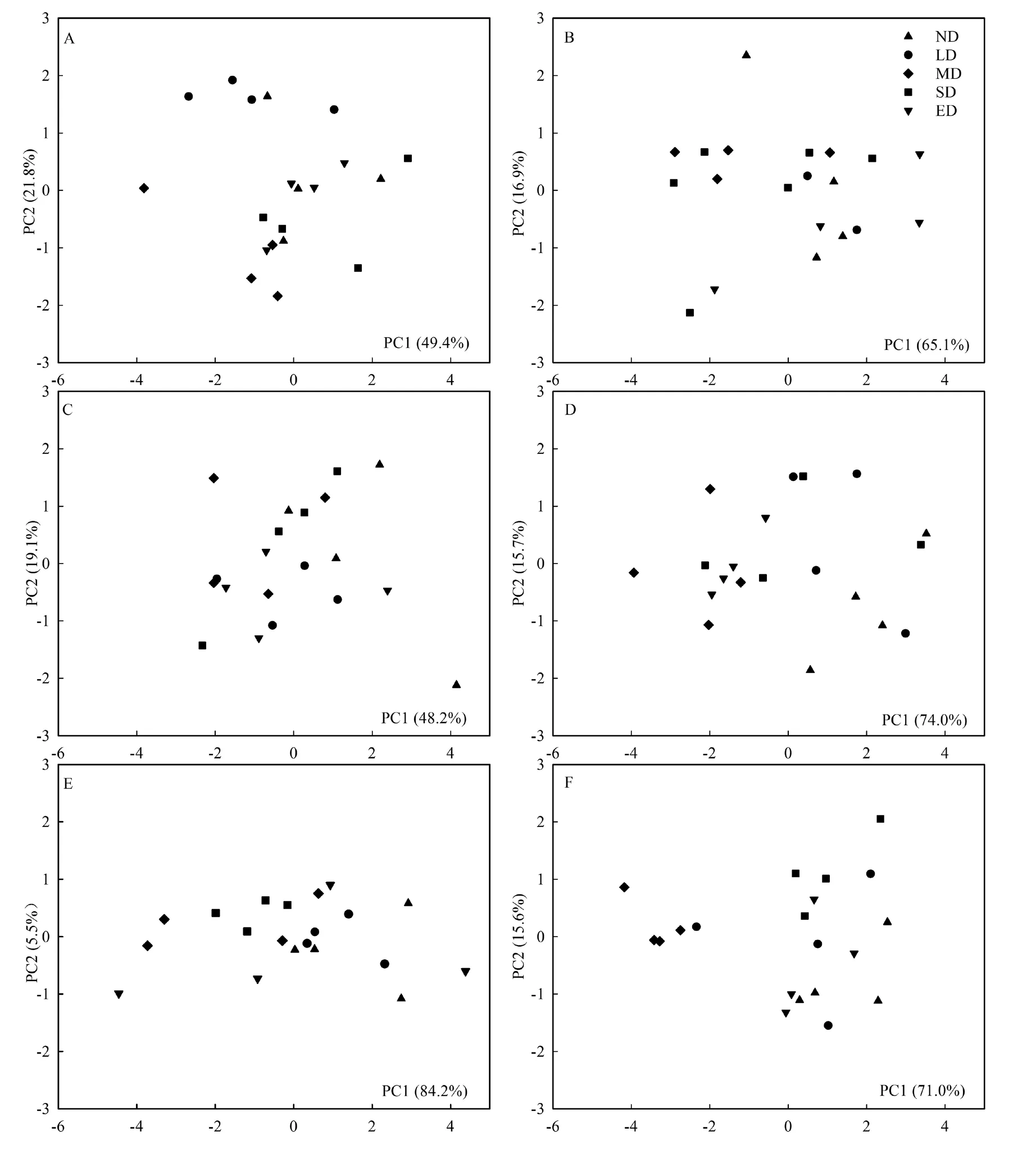
图3 退化高寒草甸返青期不同土层土壤微生物功能多样性主成分分析Fig. 3 Principal component analysis (PCA) of soil microbial community at degraded alpine meadows
在10~20 cm土层,两个主成分贡献率累计达89.7%,其中第1主成分得分贡献率为74.0%。不同草地土壤微生物群落对碳源的利用差异主要表现在PC1轴,未退化草地在PC2上与其他草地有较大分异(图 3D)。氨基酸类、胺类、羧酸类和酯类是PC1分异的主要碳源;糖类是PC2分异的主要碳源(表 4)。中度退化与未退化和轻度退化草地在PC1轴差异显著(P=0.01,P=0.04),在PC2轴上,不同草地间无显著差异(P=0.38)。
枯黄期 0~10 cm 土层两个主成分因子分别为84.2%和5.5%,累计达89.7%。中度与重度退化草地,未退化与轻度退化草地土壤微生物群落对碳源的利用能力较为相似(图3E)。醇类、胺类和羧酸类碳源是PC1分异的主要碳源,糖类是PC2分异的主要碳源(表4)。Kruskal-Wallis检验显示,在PC1和 PC2,各草地间差异均不显著(P=0.27,P=0.12)。
在10~20 cm土层,两个主成分因子贡献率分别为 71.0%和 15.6%,累计达86.6%。中度退化草地与其他草地在PC1轴有较大分异,未退化、轻度退化和黑土滩退化草地对碳源的利用能力相似,重度退化草地对碳源的利用能力较强(图3F)。氨基酸类和羧酸类是PC1分异的主要碳源;糖类是PC2分异的主要碳源(表 4)。中度退化草地与未退化和重度退化草地在PC1差异显著(P=0.01,P=0.05),在PC2轴上,不同草地间均无显著差异。
对退化高寒草甸不同生育期土壤微生物群落碳源利用情况进行主成分分析,抽取两个主成分,在0~10 cm土层,第1、2主成分得分贡献率分别为70.6%和9.5%,累计贡献率为80.1%;在10~20 cm土层,其得分贡献率分别为66.1%和15.0%,累计贡献率为81.1%。表5数据显示,退化高寒草甸不同生育期0~10 cm土壤微生物群落对碳源的利用能力差异较大,生长期草地土壤微生物群落对碳源的利用能力较强。糖类、氨基酸类、醇类、羧酸类和胺类是PC1分异的主要碳源,酯类在PC2具有较大的载荷,是PC2分异的主要碳源;在10~20 cm土层,返青期和生长期土壤微生物群落对碳源的利用较为相似,且二者与枯黄期土壤微生物群落在PC1有较大差异,氨基酸类、酯类、胺类和羧酸类是PC1分异的主要碳源(表5)。在0~10 cm土层,生长期土壤微生物群落与返青期和枯黄期在 PC1轴均表现出显著差异,在PC2轴,枯黄期与返青期和生长期间差异显著;在10~20 cm土层,不同生育期土壤微生物群落差异不显著(表6)。

表5 退化高寒草甸不同生长期土壤微生物功能多样性主成分分析Table 5 Principal component analysis (PCA) of soil microbial community at three phenological periods in different degraded alpine meadows
3 讨论
土壤微生物 AWCD值反映了土壤微生物利用碳源的能力和代谢活性的大小,其值越高,土壤微生物群落代谢活性越高(覃潇敏等,2015)。微生物多样性是维持某一生态系统稳定性及生态服务功能的关键因子,土壤微生物多样性指数用以表征和衡量微生物群落多样性和均一性程度,可以揭示土壤微生物种类和功能的差异(覃潇敏等,2015;田春杰等,2003)。本研究中,不同生育期各试验地0~10 cm土壤微生物AWCD值均高于10~20 cm,说明0~10 cm土壤微生物代谢活性较强,具有更加稳定的群落结构和更加丰富的功能多样性,此结果与前人研究结果一致(尹亚丽等,2017;Li et al.,2016;文东新等,2016)。U指数在返青期0~10 cm和10~20 cm土层间无明显变化规律,在生长期和枯黄期呈上高下低变化趋势。同一生育期,在0~10 cm和10~20 cm土层,AWCD值和U指数均以中度退化草地最低,且在生长期和枯黄期,中度退化草地10~20 cm土壤微生物AWCD值和U指数显著低于未退化、轻度和重度退化草地,即在草地退化初期土壤微生物群落活性或多样性随退化程度加重而下降,在退化后期微生物群落活性则呈相反变化趋势。不同退化程度草地中起主导作用的微生物种类不同(刘世贵等,1994)。Li et al.(2016)研究指出,与未退化和中度退化草地相比,重度退化草地土壤细菌组成发生明显改变,其细菌多样性显著提高;重度退化提高了土壤中病原菌的相对丰富度;草地退化明显改变了真菌的物种组成,增加了真菌的多样性。尹亚丽等(2017)研究结果显示,不同退化程度高寒草甸AWCD、U、H和D指数在上下两层土壤中均以中度退化草地最低,与本研究结果一致。分析其原因,认为在高寒草甸从未退化到极重度退化过程中,由于地上植被的变化导致微生物可分解利用物质发生改变,加之土壤中鼠兔类排泄物的增加,土壤微环境发生巨大变化,由此导致土壤微生物区系发生相应变化,形成新的微生物群落结构并逐渐趋于稳定(尹亚丽等,2017)。高寒草甸返青期和枯黄期0~10 cm土壤微生物AWCD值和U指数均显著低于生长期,10~20 cm土壤微生物AWCD值和U指数在不同生育期间差异不显著。微生物的生命活动受环境温度和湿度影响较大,8月的高寒草甸气候温暖湿润,是一年中最适宜生物体生长的季节。卢虎等(2014)、张俊忠等(2008)和丁玲玲等(2007)研究结果显示,草地土壤三大类微生物数量在不同季节呈单驼峰变化曲线,7—9月达到顶峰,随后逐渐下降。

表6 退化高寒草甸不同生长期土壤微生物功能多样性主成分Nemenyi检验Table 6 Nemenyi test for soil microbial functional diversity at degraded alpine meadows in different phenological periods
微生物的分解是将动植物遗体及其分泌物、排遗物等所含的蛋白质、多糖及脂类等大分子营养物质降解成为氨基酸、单糖及脂肪酸等小分子物质的过程。本研究土壤微生物对6类碳源的相对利用能力表明,同一生育期,随草地退化程度加重,0~10 cm和10~20 cm土壤微生物群落对碳源相对利用率变化趋势不同。同一时期,不同草地同一土层土壤微生物群落对单一碳源利用率因草地退化程度的不同而表现差异,即土壤微生物群落组成因草地退化而发生改变,不同微生物种类对碳源代谢能力不同。不同退化程度草地其地上植被物种组成和群落结构不同,由此导致其向土壤中输入的植物残体及分泌物存在差异,这些植物残体及分泌物能够为土壤微生物提供丰富的碳源,也能改变土壤的理化环境,从而对微生物种群产生重大影响(黄玉茜等,2015)。不同植被类型能够影响土壤微生物活性和功能组成格局(Fisk et al.,2003)。曲晓华等(2015)研究指出,植物根系通过主动释放和淀积多种有机物质,为微生物提供碳源、能量和生长因子;不同的作物对土壤微生物群落的影响不同,作物通过根系分泌物在塑造土壤微生物群落中起着重要的作用,不同作物根系分泌物的成分和含量不同,从而改变了土壤微生物群落的生长代谢(Büenemann et al.,2004;Nayyar et al.,2009);根系分泌物的种类繁多,不同植物的根系分泌物种类和数量也有一定的差异(陈悦等,2018)。以上报道均与本研究结果一致,导致差异的原因与草地植被组成、植物残体、根系分泌物和土壤理化性质等生态因子有关(Kowalchuk et al.,2002;陈悦等,2018)。不同生育期土壤微生物群落对碳源的利用强度不同,返青期土壤微生物群落主要利用氨基酸和酯类碳源,生长期主要利用氨基酸类和糖类碳源,枯黄期则主要利用氨基酸类碳源,说明不同生育期草地土壤微生物种群数量和结构存在较大差异,生长期植物通过根系分泌物对土壤微生物进行调控,从土壤中吸收更多的能量物质以满足自身生长需要。糖类和氨基酸类是细菌群落相对利用率最高的碳源,而真菌群落相对利用率最高的碳源为羧酸类和糖类(朱珂等,2018),糖类和氨基酸类类碳源属于易于代谢的高能量底物,最容易被农田土壤细菌所利用(Brackin et al.,2013)。不同生育期土壤微生物对6类碳源的利用差异主要体现在酯类和醇类,对其他碳源利用率差异不显著。不同季节下的土壤微生物群落功能多样性差异显著(曹永昌等,2017),不同草地植被群落组成存在差异,同时 7—9月是草地植物生长旺盛的季节,为土壤微生物提供了丰富的营养物质,加之适宜的温湿度条件为微生物的生长和繁殖提供了有利的环境。根际土壤细菌和真菌对不同碳源的相对利用率随生长时期变化而不同(朱珂等,2018)。陈悦等(2018)研究表明,植物根际土壤微生物功能多样性不仅与植物类型有关,在不同生长阶段也依然存在差异,具有一定时空特征;Kaiser et al.(2001)和Smalla et al.(2001)也发现同一地区不同植被类型、同一植物不同基因型或同一基因型不同发育阶段的根际土壤微生物多样性均有不同。糖类、氨基酸类和羧酸类是植物根系分泌物的主要成分,糖类是微生物代谢利用最广的碳源(董艳等,2013;张明莉等,2017)。
主成分分析能较好地描述不同土壤微生物群落对碳源的利用状况及其代谢特征(石贤辉,2012),用以分析不同种类植物对土壤微生物碳源的利用是否存在差异(Juliet et al.,2001;Cookson et al.,2008)。样本在主成分上的得分和微生物对碳源底物的利用能力相关(Garland et al.,1991)。本研究主成分分析结果表明,0~10 cm和10~20 cm土层土壤微生物群落对碳源的利用能力随草地退化程度加重均出现较大差异,未退化草地对碳源具有较好的利用能力,重度和黑土滩退化草地对碳源利用能力较为相似,中度退化草地与其他草地差异较大;各生育期对土壤微生物群落起分异作用的碳源主要是氨基酸类、糖类、胺类和羧酸类。其原因可能是未退化草地植被物种组成丰富、植被盖度大、土壤含水量高,同时具有须根发达、地下生物量大等特征,加之地表腐殖层较厚故其土壤微生物群落功能多样性丰富;中度退化草地,与未退化草地相比物种多样性减少,优良牧草比例下降,地上、地下生物量降低,而与重度和黑土滩退化草地相比,地上植被物种组成差异较大,且未受草地鼠兔类活动干扰及排泄物等影响,由此导致其土壤微生物群落功能多样性与其他草地出现较大差异。糖类、氨基酸类和羧酸类是微生物利用的主要碳源,可作为区分不同种植模式下微生物碳源利用类型的依据(陈慧等,2007;周泉等,2018)。土壤微生物与地表植被类型关系密切,土壤微生物群落结构可用于检测不同荒漠植物根际微环境土壤退化状况(李欣玫等,2018);毕江涛等(2009)认为在一定空间尺度具有相似环境的条件下,随着植物类型不同,土壤微生物活性和群落结构表现出一定的差异,以上报道均与本研究结果一致。不同生育期退化高寒草甸不同土层土壤微生物对碳源利用能力差异较大,生长期草地土壤微生物对碳源利用能力较强。
4 结论
高寒草甸0~10 cm土层土壤微生物活性显著高于10~20 cm土层。不同退化演替阶段高寒草甸土壤微生物对碳源利用能力不同,中度退化草地土壤微生物群落活性最低,季节和土层交互作用对土壤微生物群落影响较大。不同季节草地土壤微生物群落对6类碳源的相对利用率不同,在0~10 cm土层碳源利用差异主要体现在酯类和醇类碳源,在10~20 cm则主要体现在糖类和胺类碳源。未退化草地土壤微生物群落对碳源具有较好的利用能力,重度和黑土滩退化草地对碳源利用能力较为相似,中度退化草地与其他草地分异较大;氨基酸类和羧酸类碳源对土壤微生物起主要分异作用。牧草生长期土壤微生物对 31种碳源的利用能力高于返青期和枯黄期。
