黄梨渣多糖的提取、分离纯化和结构鉴定
2018-10-31陈树俊李佳益王翠连张君梅
陈树俊,李佳益,王翠连,张君梅,李 乐,石 玥
(山西大学生命科学学院,山西 太原 030006)
高平黄梨是山西著名特产,高平素有梨乡之称,距今已有1 500 a的栽培历史,其个大、味浓、味香、香甜适口,味道鲜美,各种维生素、矿物质含量高,水分大、耐贮运且含糖量很高[1]。随着梨汁加工产业的发展,势必会产生越来越多的梨渣,梨渣中含有丰富的多糖,而多糖是生物体重要的生物活性物质,具有调节免疫力[2-3]、抗氧化[4-5]、抑菌[6]、抗肿瘤[7]、降血脂、降血糖[8-9]等作用,因此梨渣可作为提取多糖的主要来源。国内多采用水浴醇沉[10]、超声[11]等方法提取多糖,利用Sevag法[12]、三氯乙酸法[13]等脱除多糖中的杂质蛋白质,采用H2O2法[14]、活性炭法[15]等方法对多糖进行脱色,采用凝胶渗透色谱法、超高效液相色谱法[16]测定多糖的相对分子质量,气相色谱法测定其单糖组成以及用红外光谱法对多糖的结构进行初步分析。杨江涛[17]用凝胶渗透色谱法测定刺梨多糖的相对分子质量为52 000,卫强等[18]用气相色谱分析法确定红豆杉多糖中含有鼠李糖、甘露糖、葡萄糖、木糖和半乳糖,并通过红外光谱法鉴定其为一种具有β糖苷键的吡喃型多糖。
目前,国内关于高平黄梨的研究鲜见报道。本实验以高平黄梨渣为原料,利用水浴醇沉法和超声辅助法提取梨渣多糖,比较Sevag法、酶法、Sevag法和酶法结合3 种方法确定脱蛋白工艺,比较H2O2法、活性炭法、反胶束溶液法3 种方法确定脱色工艺,采用DEAE-52纤维素柱层析方法对多糖进行分级,乌氏黏度法测定黄梨渣多糖的黏均分子质量,超高效液相色谱法对单糖的组成及含量进行分析,并通过红外光谱对黄梨渣多糖的结构进行初步鉴定。旨在为高平黄梨资源的综合利用提供一定参考。
1 材料与方法
1.1 材料与试剂
高平黄梨渣 山西夏普赛尔食品饮料股份有限公司。
牛血清白蛋白 美国Roche公司;DEAE-52纤维素、葡萄糖、半乳糖、甘露糖、阿拉伯糖、鼠李糖、木糖、岩藻糖、半乳糖醛酸、葡萄糖醛酸标准品、三氟乙酸、乙腈(色谱纯)、磷酸盐缓冲溶液(pH 7.0)北京Solarbio公司;Sephadex G-100 美国Sigma公司。
1.2 仪器与设备
WFZ UV-2100型紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;电热恒温水浴锅 佳明仪表公司;电子分析天平 上海卓精公司;超声波清洗机、真空冷冻干燥箱 宁波新芝生物科技股份有限公司;SENCO旋转蒸发仪 上海申生有限公司;SC-3610低速离心机、HC-2518高速离心机 安徽中科中佳科学仪器有限公司;恒流泵 上海青浦沪西仪器厂;乌氏黏度计 上海良晶玻璃仪器厂;1525高效液相色谱仪 美国Waters公司;傅里叶变换红外光谱仪 日本岛津公司。
1.3 方法
1.3.1 梨渣多糖的提取及测定
1.3.1.1 多糖含量的测定
参考文献[19],以葡萄糖浓度为横坐标、吸光度为纵坐标,得标准曲线方程:y=12.08x-0.039 2,R2=0.999 2。
1.3.1.2 超声辅助提取工艺优化
精密称取1 g,适当料液比混匀,超声辅助热水浸提,4 000 r/min离心15 min得上清液,旋转浓缩,加入3 倍体积95%乙醇溶液使得最终乙醇体积分数为80%以上,4 ℃醇沉过夜,4 000 r/min离心15 min得沉淀,干燥后即得粗多糖样品。
单因素试验:选取料液比(1∶10、1∶20、1∶30、1∶40、1∶50(g/mL));超声功率(110、120、130、140、150 W);超声温度(30、40、50、60、70 ℃);超声时间(40、50、60、70、80 min)进行单因素试验,考察对梨渣多糖提取量的影响。
响应面法优化试验:根据Box-Behnken试验设计原理,以多糖提取量为响应值,结合上述单因素试验结果,设计4因素3水平响应面试验。试验因素与水平见表1。
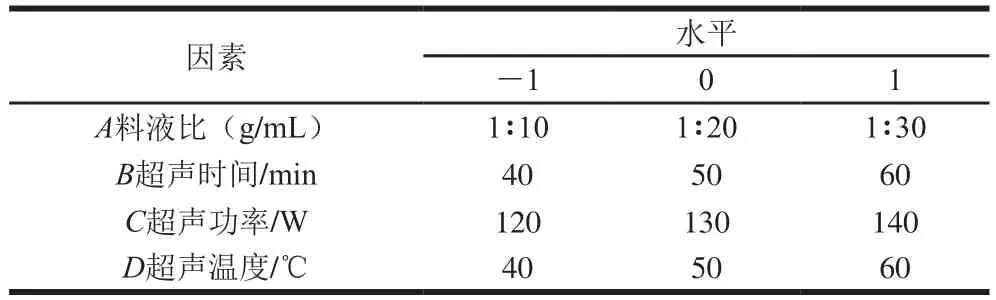
表1 Box-Behnken试验因素与水平Table 1 Coded levels and corresponding actual levels of independent variables used in response surface analysis
1.3.2 梨渣多糖脱蛋白
1.3.2.1 蛋白含量的测定
参考文献[20],以牛血清白蛋白浓度为横坐标、吸光度为纵坐标,得标准曲线方程为y=6.345x+0.126 7,R2=0.999 6。
1.3.2.2 脱蛋白方法
Sevag法:取一定量的粗多糖溶液,向其中加入1/5体积的正丁醇-氯仿混合液(正丁醇-氯仿体积比1∶4),磁力搅拌器高速搅拌30 min,8 000 r/min离心20 min,去除沉淀,重复13 次,直至无沉淀产生。测定多糖含量和蛋白含量,按公式(1)、(2)计算蛋白脱除率和多糖损失率:

酶法:向100 mL粗多糖溶液中加入1%木瓜蛋白酶,调节pH 6.0,于50 ℃水浴中加热保温2 h,然后4 000 r/min离心15 min得上清液,并按公式(1)、(2)计算蛋白脱除率和多糖损失率。
酶法和Sevag法结合:将酶法所得上清液再用Sevag法脱蛋白,重复操作5 次至无蛋白沉淀,并按公式(1)、(2)计算蛋白脱除率和多糖损失率。
1.3.3 梨渣多糖脱色方法的确定
对梨渣粗多糖溶液进行可见-紫外全波长扫描,根据互补色原理[21]确定检测波长为450 nm,测定溶液脱色前后吸光度,分别按公式(3)、(4)计算脱色率和多糖损失率:

H2O2法:用2 mol/L的NaOH溶液将脱蛋白后的梨渣多糖溶液调至pH 8.5,缓慢搅拌加入1/5体积的30% H2O2溶液,50 ℃保温脱色2 h,直至颜色不再改变,取出后冷却到室温,调节pH值至7.0左右,并检测其脱色前后的吸光度和多糖含量。
活性炭法:将活性炭用蒸馏水清洗并过滤,在100 ℃烘箱中干燥20 h备用。取100 mL 5 mg/mL粗多糖溶液,加入3%活性炭,60 ℃水浴脱色2 h,至颜色不再改变,检测其脱色前后的吸光度和多糖含量。
反胶束溶液法[18]:取脱蛋白后的多糖配制成5 mg/mL的粗多糖溶液50 mL,置于沸水浴中加热30 min,冷却至室温,4 000 r/min离心5 min,取0.234 g NaCl加入20 mL上清液中备用。将1 mL正己醇、4 mL异辛烷和0.274 g十六烷基三甲基溴化铵混合制成反胶束溶液。移取3 mL粗多糖溶液和1 mL反胶束溶液,振荡3 min后静置30 min,取下层液体检测其脱色前后色素吸光度和多糖含量。
1.3.4 梨渣多糖的透析
经过脱蛋白、脱色的梨渣多糖,还会存在单糖、低聚糖和盐等小分子杂质需要除去,故将脱色后的多糖溶液装入透析袋于蒸馏水中透析36 h,中间隔断换水。
1.3.5 梨渣多糖的分级
参考王雪艳[21]采用DEAE-52纤维素柱层析的方法对多糖进行分级。将经过脱蛋白、脱色、透析的多糖溶液浓缩至适当体积,上DEAE-52纤维素柱(2.6 cm×30 cm)进行分级纯化,先以20 mL蒸馏水洗脱,然后以0~1 mol/L NaCl的Tris-HCl溶液进行线性洗脱,流速为1 mL/min,每3 min收集一管,于490 nm波长处以苯酚-浓硫酸法测定吸光度,绘制洗脱曲线,横坐标为接收管数,纵坐标为吸光度。洗脱液经浓缩、透析、真空冷冻干燥制得精制多糖。
1.3.6 梨渣多糖的纯度鉴定
Sephadex G-100凝胶柱层析:称取10 mg的精制多糖溶于5 mL 0.1 mol/L NaCl溶液中,加到预先用0.1 mol/L NaCl溶液平衡的Sephadex G-100凝胶柱上,用0.1 mol/L NaCl溶液进行洗脱,流速为1 mL/min,每3 min收集一管,在490 nm波长处以苯酚-硫酸法测定吸光度,绘制洗脱曲线,横坐标为接收管数,纵坐标为吸光度。
紫外吸收光谱法:将质量浓度为1.0 mg/mL纯化后的多糖溶液于200~500 nm范围内进行全波长扫描,观察在260 nm、280 nm波长附近的特征吸收峰。
冻融实验法:取冷冻过夜后的精制多糖在室温下融化,12 000 r/min离心15 min,观察离心管底部沉淀产生情况。
1.3.7 相对分子质量的测定
参照金婷[22]方法。精确称取梨渣精制多糖样品0.25 g,用蒸馏水溶解并定容至25 mL容量瓶中,将乌氏黏度计置于25 ℃的恒温水浴锅中,在C管和B管的上端套上干燥清洁的橡皮管,从A管沿管壁加入10 mL多糖溶液,恒温10 min后,测定其流出时间t1。然后依次从A管分别加入10、5、15、10 mL水,将原浓度的溶液稀释成不同的浓度,分别测定不同浓度时的流出时间t。在检测样品的黏度前,先以同样的方法测定蒸馏水的流出时间t0。每个数据重复测定3 次,偏差应小于0.2 s,取其平均值。分别计算相对黏度ηr、增比黏度ηsp和比浓黏度ηsp/c。横坐标为多糖溶液的质量浓度c,纵坐标为ηsp/c绘制标准曲线,以外推法求得特性黏度[η]。根据Mark-Houwink公式([η]=KMηα)求得梨渣多糖的黏均分子质量。
1.3.8 单糖组成的测定
酸水解:称取冻干的多糖样品2 mg,加入2 mol/L三氟乙酸溶液0.5 mL,在120 ℃条件下水解120 min,氮吹仪吹干。
标准品处理:首先配制10 mg/mL单糖标准品置于-20 ℃,用时取出融化,在可以密封的玻璃管中加入上述单糖标准品各5 μL,混匀。然后加入2 mol/L三氟乙酸溶液0.5 mL,与样品同时在120 ℃条件下水解120 min,空气泵吹干。
1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)衍生化:向水解干燥后得到的单糖样品中加入溶于无水甲醇的0.5 mol/L的PMP溶液和0.3 mol/L的NaOH溶液各0.5 mL,充分混匀后,水浴70 ℃反应30 min。冷却至室温,加入0.3 mol/L HCl溶液0.5 mL,充分混匀。平均分成两份到EP管中,其中一份备用,在备用样品中滴入一滴氯仿置于4 ℃冰箱。另外一份加入0.5 mL氯仿,充分振荡萃取,离心(5 000 r/min,5 min)去除氯仿层,共萃取3 次。水层(不低于0.4 mL)用0.22 μm滤膜过滤后,待上机。
仪器条件:色谱柱:T h e r m o O D S-2 C18柱(4.6 mm×250 mm,5 μm);流动相:0.1 mol/L pH 7.0磷酸盐缓冲溶液-乙腈82∶18(V/V);流速:1.0 mL/min;柱温:25 ℃;进样量10 μL;波长:245 nm。
1.3.9 红外光谱分析
称取多糖干燥样品1 mg和KBr混合研磨压片后在波长范围为4 000~500 cm-1采用红外光谱仪扫描分析,观察吸收峰,对多糖的构型进行初步分析。
1.4 数据处理
本实验应用Origin 6.0和Excel软件进行分析作图,各组实验均重复3 次,以 ±s表示,响应面试验设计与分析采用Design-Expert V 8.0.6软件。
2 结果与分析
2.1 超声辅助法提取梨渣多糖优化结果
2.1.1 单因素试验结果
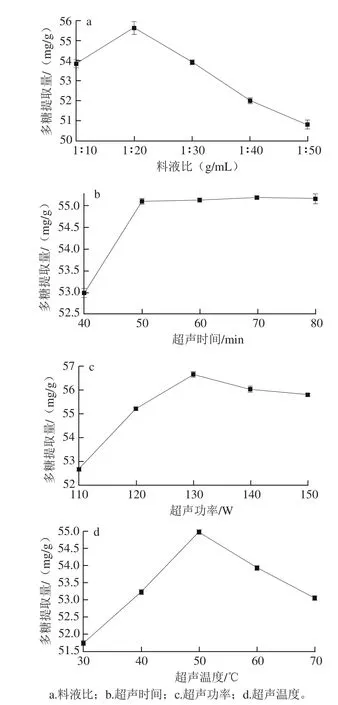
图1 单因素试验结果Fig. 1 Results of one-factor-at-a-time experiments
由图1a可以看出,多糖提取量在料液比为1∶20(g/mL)时达到最大,超过1∶20(g/mL)后,多糖提取量下降,推测是由于增加溶剂,有利于多糖溶出,而溶剂用量过大会影响提取体系的传热和传质,使多糖提取量降低[25];由图1b可知,多糖提取量随超声时间的延长而增加,至50 min时达到最大,之后随着时间的延长多糖提取量趋于平缓,可能由于超过50 min后,提取时间的延长使杂质溶出增多,多糖提取量增加缓慢[26];多糖提取量随着超声功率的增加也逐渐上升,130 W时提取量达到最大,随后,超声功率的升高不再增加多糖提取量,反而有所下降(图1c),这可能是因为超声功率增加,超声热效应变大,使多糖降解,提取量降低[25];由图1d可以看出,多糖提取量在超声温度为50 ℃时达到最大,低于或高于50 ℃时提取量都显著下降,可能由于温度过高,溶剂挥发使溶液黏度增大,不利于多糖溶解,从而使多糖提取量下降[26]。所以,在料液比1∶10~1∶30(g/mL)、超声时间40~60 min、超声功率120~140 W、超声温度40~60 ℃范围内进行Box-Behnken试验。
2.1.2 Box-Behnken试验结果

表2 Box-Behnken试验设计与结果Table 2 Box-Behnken design with experimental values of polysaccharide yield

表3 Box-Behnken试验结果方差分析Table 3 Analysis of variance (ANOVA) for the effect of extraction conditions on polysaccharide yield
对表2梨渣多糖提取量的试验数据进行多元回归拟合后,由统计软件Design-Expert V 8.0.6分析,建立二次多元回归方程:Y=61.81+0.96A+1.24B+1.50C-0.51D-7.04AB+1.95AC-1.27AD-1.07BC+2.60BD+3.93CD-4.88A2-3.2B2-4.75C2-2.64D2。
从表3可以看出,建立的模型F值为27.63(P<0.000 1),说明该模型极显著,失拟项P值为0.296 9大于0.05,不显著,说明该模型可以很好地拟合试验的真实情况,可以用于梨渣多糖提取工艺的优化。其中R2值为0.965 1,校正后决定系数R2Adj值为0.930 1,说明该模型能够解释93.01%试验数据响应值的变化。此外,AB、CD、A2、B2、C2、D2对多糖的提取量影响差异极显著,B、C、AC、BD对多糖提取量影响高度显著,A对多糖提取量影响显著,D、AD、BC项不显著(P>0.05),需将此3 项从回归模型中删除。因此,回归模型方程最终为Y=61.81+0.96A+1.24B+1.50C-7.04AB+1.95AC+2.60BD+3.93CD-4.88A2-3.2B2-4.75C2-2.64D2。
2.1.3 交互作用分析
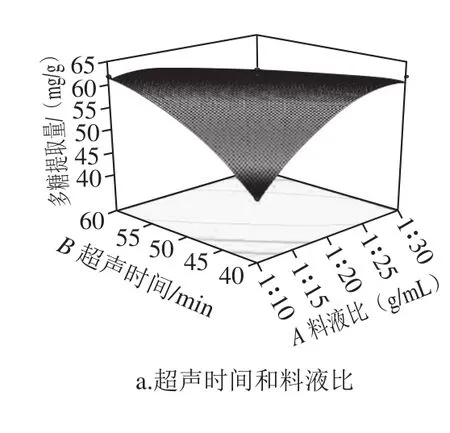

图2 各因素交互作用对梨渣多糖提取量影响的响应面图Fig. 2 Response surface plots showing the interactive effects of various factors on the extraction efficiency of polysaccharides
由图2a可知,多糖提取量分别随着超声时间和溶剂用量的增加呈现升高的趋势之后趋于平缓,两者的交互作用显著。由图2b可知,超声功率和料液比对多糖提取量的影响均呈抛物线趋势,即随超声功率和溶剂用量的增加,多糖提取量呈先升高后降低的趋势,两者交互作用曲面较陡,即对多糖提取量影响显著。由图2e可知,多糖提取量随超声温度的升高和时间的延长先升高最后趋于平稳,且多糖提取量随超声时间的延长大于超声温度的变化,说明超声时间对多糖提取量的影响较大。由图2f可知,多糖提取量随超声功率的增加先上升后下降,呈现抛物线的趋势,而随超声温度的升高先上升后趋于平缓,两因素的交互曲面较陡,说明两因素的交互作用显著。
2.1.4 验证实验结果
经Design-Expert优化后得到的最优条件为料液比1∶13.26(g/mL)、超声时间60 min、超声功率131.99 W、超声温度57.08 ℃,此时多糖提取量的理论值最高为62.680 1 mg/g。为验证最优条件的准确性,考虑到实际操作的可行性,设定最优条件为料液比1∶13(g/mL)、超声时间60 min、超声功率132 W、超声温度57 ℃,在此条件下进行3 次重复实验后测得多糖提取量的平均值为62.375 mg/g,与理论值接近,说明该工艺稳定可靠,具有一定的应用价值。
经前期实验测定,水浴醇沉法在Design-Expert优化后得到的最优条件(料液比1∶35(g/mL)、温度67 ℃、时间3.7 h)下,测得多糖提取量的最大值为56.879 9 mg/g,低于62.375 mg/g,且超声辅助提取法具有省时、高效、便于操作等优点,故综合考虑选取超声辅助法提取黄梨渣多糖。
2.2 梨渣多糖脱蛋白结果
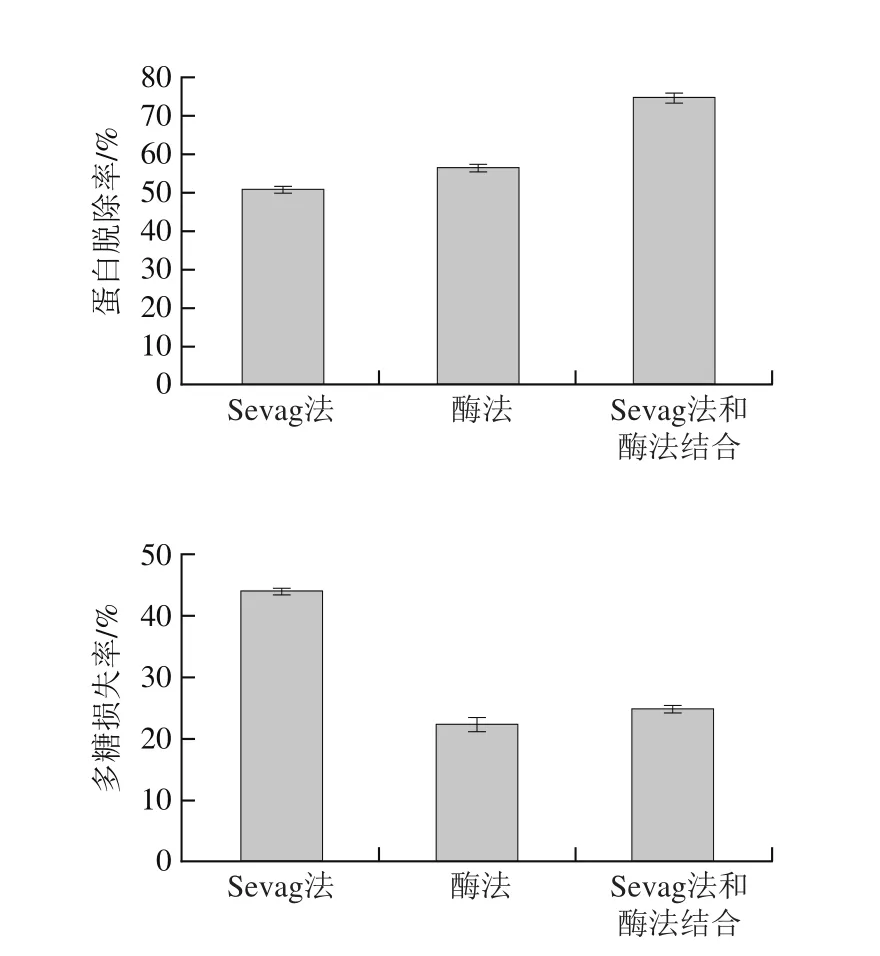
图3 脱蛋白方法对多糖的影响Fig. 3 Effects of deproteinization methods on protein removal and polysaccharide loss
由图3可以看出,单独使用Sevag法脱蛋白,可以去除51.16%蛋白质,此方法使用次数多、耗时长、有机试剂用量大、多糖损失率高;单独使用木瓜蛋白酶法脱蛋白,多糖损失率降低到22.39%的同时可去除56.82%的蛋白质,这是由于木瓜蛋白酶可以起到降解蛋白质的作用;在酶法基础之上再进行5 次Sevag法脱蛋白后,蛋白脱除率为75%且多糖损失率仅为24.71%。故用酶法和Sevag法联合除蛋白可达到简化操作工艺、省时、最大限度去除蛋白质[22]的同时保证多糖得率的目的。因此,该方法是一种去除蛋白较为理想的方法。
2.3 梨渣多糖的脱色结果
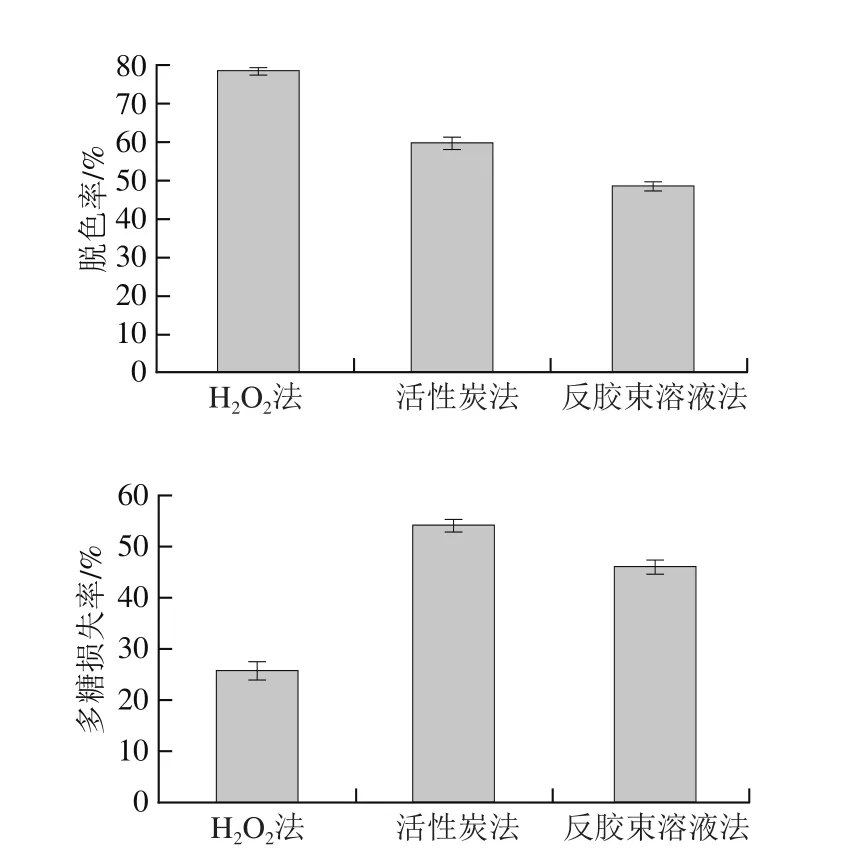
图4 脱色方法对多糖的影响Fig. 4 Effects of decolorization methods on decoloraization rate and polysaccharide loss
由图4可以看出,H2O2法脱色率最高,可达78.56%,且多糖损失率最低,仅25.86%。由于活性炭对色素吸附具有特异性,所以活性炭脱色率较低,多糖损失率高达54.35%,用反胶束溶液法脱色时,脱色率仅47.69%且多糖损失率较高。H2O2法脱色通过氧化色素来达到脱色目的,脱色效果好,操作简单,能最大限度地降低多糖损失率[14],因此,选用H2O2法对多糖进行脱色。
2.4 多糖的分级结果
用苯酚-硫酸法测定90 管样品溶液的多糖含量,以试管数目为横坐标,以吸光度为纵坐标作洗脱曲线图。从图5可以看出,脱蛋白、脱色、透析后的梨渣多糖经DEAE-52纤维素柱层析分离得到3 个峰,表明梨渣多糖由3 种不同组分构成,分别为LPB-A、LPB-B和LPB-C,结果如图5所示,第23~32管为LPB-A,第33~38管为LPB-B,第50~60管为LPB-C,三组分峰形对称较好,说明以0~1 mol/L NaCl的Tris-HCl溶液进行线性洗脱能较好地分离梨渣多糖。经DEAE-52柱分离后LPB-A、LPB-B含量较少,故后续实验仅对LPB-C进行继续研究。
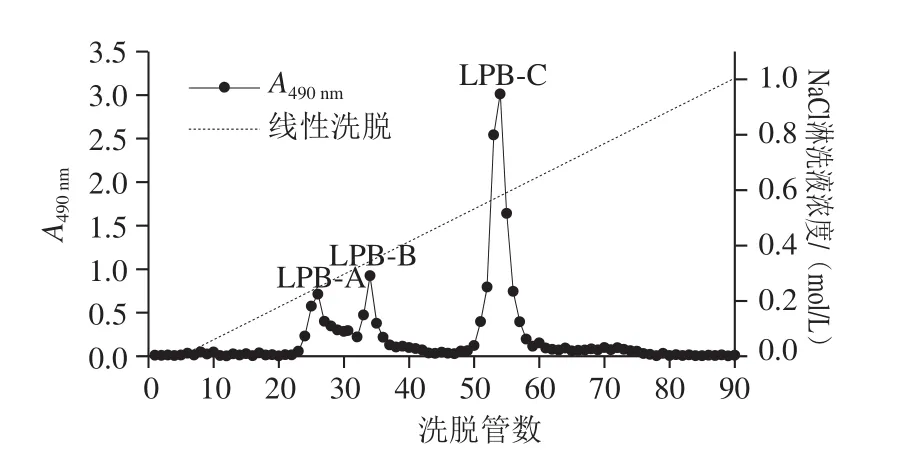
图5 多糖DEAE-52纤维素柱洗脱曲线Fig. 5 Elution profile of polysaccharides by DEAE-52 cellulose column chromatography
2.5 纯度鉴定结果
2.5.1 Sephadex G-100凝胶柱层析
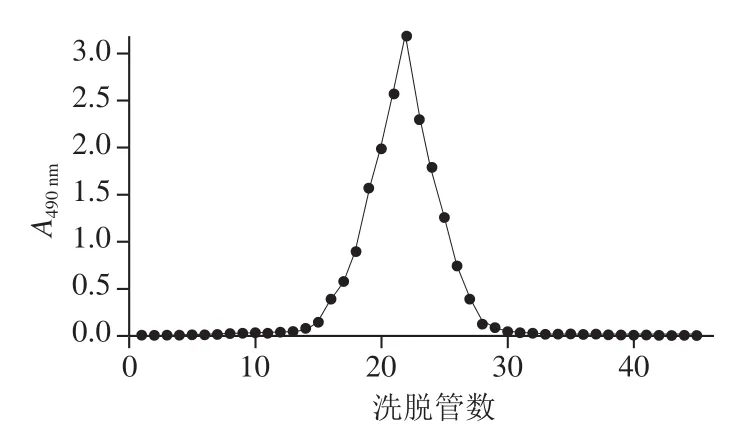
图6 LPB-C的Sephadex G-100凝胶柱洗脱曲线Fig. 6 Elution profile of LPB-C on Sephadex G-100 column
如图6所示,多糖LPB-C经过Sephadex G-100凝胶柱流出的曲线呈单一对称峰,说明经过一系列处理后多糖LPB-C已经被纯化,且为相对分子质量分布均一的组分,是一种较纯的多糖。
2.5.2 紫外吸收光谱结果
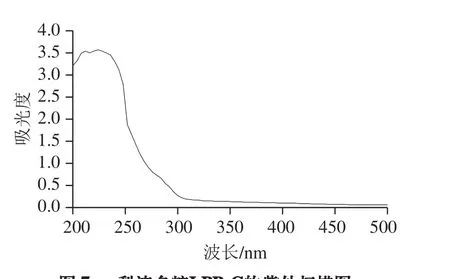
图7 梨渣多糖LPB-C的紫外扫描图Fig. 7 UV absorption spectrum of LPB-C
如图7所示,多糖的特征吸收峰出现在225 nm波长处,260 nm和280 nm波长处没有出现吸收峰,表明经DEAE-52纤维素柱层析纯化后的多糖不含核酸和蛋白质等杂质,说明LPB-C是一种较纯的多糖。
2.5.3 冻融实验结果
LPB-C经冻融离心后没有沉淀出现,表明LPB-C为一种较纯的多糖。
综上可知,3 种方法都证明LPB-C为相对分子质量分布单一的组分,是一种较纯的多糖。
2.6 相对分子质量的测定结果
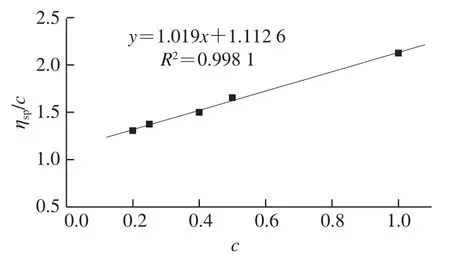
图8 梨渣精多糖LPB-C的ηsp/c-c图Fig. 8 ηsp/c versus c plot of LPB-C
多糖分子的不均一性导致其分子质量的测定比较困难,通常所测得的分子质量是一种统计平均值,只代表一定分子质量范围的平均分布而不是确切大小。本实验测定经分离纯化后分子质量分布比较均一的梨渣多糖LPB-C组分的相对分子质量。如图8所示,经测定,其特性黏度[η]为1.11 cm3/g,已知在25 ℃时,K值为2×10-4,α值为0.76,根据Mark-Houwink公式可求得梨渣多糖LPB-C的黏均分子质量为8.47×104g/mol。
2.7 单糖的组成
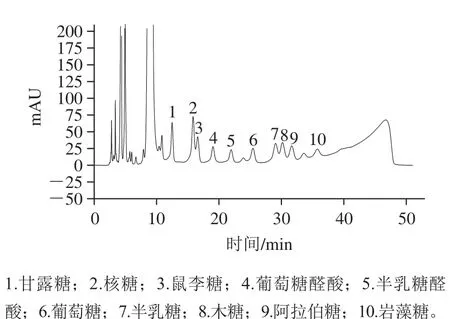
图9 混合标准单糖衍生物的超高效液相色谱图Fig. 9 UPLC chromatogram of derivatives of standard monosaccharide mixture

图10 黄梨渣多糖衍生物的超高效液相色谱图Fig. 10 UPLC chromatogram of derivatives of LPB-C
将黄梨渣多糖衍生物的超高效液相色谱图与混合标准单糖进行对比(图9和图10)可知,7~12 min的色谱峰为PMP溶剂峰,根据其出峰时间可以确定黄梨渣多糖中含有甘露糖、鼠李糖、葡萄糖和木糖,根据峰面积计算出4 种单糖的物质的量比为3.3∶2.3∶10.6∶23.2。
2.8 红外光谱分析

图11 LPB-C的红外光谱图Fig. 11 IR spectrum of LPB-C
由图11可知,LPB-C具有多糖的特征吸收峰:3 376.54、3 234.76 cm-1处为氢键的—OH伸缩振动吸收峰,说明存在分子内或分子间氢键;2 979.18 cm-1处为糖类的C—H伸缩振动吸收峰;1 629.92、1 552.76 cm-1处为C=O伸缩振动吸收峰;1 464.03 cm-1处的吸收峰为CH3、CH2、CH等的C—H面内弯曲振动;1 400、1 297 cm-1为—COOH中C—O伸缩振动,说明存在糖醛酸结构;1 135 cm-1为多糖中糖的醚键C—O—C伸缩振动吸收峰;1 040 cm-1处为吡喃环的变形振动,说明该多糖可能为吡喃型多糖;908 cm-1处为β-D-吡喃葡萄糖的特征吸收峰,说明此多糖级分中含有β糖苷键;经比对,663、595 cm-1处可能为鼠李糖的特征吸收峰[18],说明LPB-C中含有鼠李糖。
3 结 论
本实验研究黄梨渣中多糖的提取、分离纯化的方法,并对其相对分子质量、单糖组成以及基本结构进行分析。最终确定采用超声波辅助提取法提取梨渣多糖的最佳提取工艺条件为料液比1∶13(g/mL)、超声时间60 min、超声功率132 W、超声温度57 ℃,多糖提取量可达到62.38 mg/g,比水浴醇沉法的提取量(56.9 mg/g)高,且大大节省了时间[27-28]。Sevag法与酶法联合除蛋白的方法效果最佳,蛋白脱除率和多糖损失率分别为75%和24.71%,此法简化了操作工艺,省时,最大限度去除蛋白质的同时可保证多糖得率。H2O2法脱色率最高,可达78.56%,且多糖损失率最低,仅25.86%。脱蛋白、脱色、透析后的梨渣多糖经DEAE-52纤维素柱层析分离得到LPB-A、LPB-B和LPB-C三个不同的组分,其中LPB-A、LPB-B含量较少,故仅对LPB-C进行结构鉴定。对于同一种物质,不同方法测定出的相对分子质量也有所差别,经乌氏黏度计法测定,LPB-C的黏均分子质量约为8.47×104g/mol。用高效液相色谱法[29-31]测得黄梨渣多糖是由甘露糖、鼠李糖、葡萄糖和木糖组成,且物质的量比为3.3∶2.3∶10.6∶23.2,经红外光谱法分析进一步得出其是一种含有β糖苷键的吡喃型多糖,这为高平黄梨进一步研究和综合开发利用提供了一定参考价值。
