超高效合相色谱对植物油中角鲨烯的快速测定及方法比较
2018-10-31陆秀云谢跃杰任贵礼刘倩倩
王 强,陆秀云,谢跃杰,任贵礼,刘倩倩,王 波
(1.重庆第二师范学院生物与化学工程学院,重庆 400067;2.西北师范大学地理与环境科学学院,甘肃 兰州 730070;3.重庆江源油橄榄开发有限公司,重庆 404100;4.甘肃出入境检验检疫局检验检疫综合技术中心,甘肃 兰州 730000)
角鲨烯又名鲨烯、三十碳六烯,是一种高度不饱和的直链三萜类化合物,角鲨烯是重要的天然活性物质。角鲨烯最初是从鲨鱼的肝油中发现的,是一种脂质不皂化物,其生理功能主要包括抗氧化作用,抗辐射作用,提高体内超氧化物歧化酶活性、增强机体免疫能力、抗衰老等;同时因为抗肿瘤、抗癌活性而应用于药物和保健品中,是一种无毒性的具有防病治病作用的活性物质[1-3]。大豆油、菜籽油、棉籽油等植物油中含有少量角鲨烯,但在橄榄油中含量较多[4-6]。
目前,文献报道的角鲨烯检测方法主要是气相色谱[7-10]、气相色谱-质谱法[11-16]和液相色谱法[17-23]。采用的预处理方法除了皂化法外,还有溶剂稀释法、溶剂分级重结晶法。国际上仅有的官方发布的测定角鲨烯含量的方法是AOAC[24],该方法包含样品皂化,用大量溶剂萃取不皂化物,通过柱色谱分离以及滴定前的其他处理步骤,整个检测过程繁琐、费时费力、误差较大。因此,建立一种快速的检测方法在实际样品检测中具有广泛的应用前景。
超高效合相色谱(ultra-performance convergence chromatography,UPC2)是将传统超临界流体色谱与超高效液相色谱(ultra-performance liquid chromatography,UPLC)的技术特点相互补充,相比传统超临界流体色谱而言,在精密度及稳定性上得到大幅度提高,此外,由于UPC2以CO2超临界流体为流动相主体,在色谱保留特性及原理与传统反相或正相色谱有着很大区别[25-28]。理论上讲,UPC2不仅可分析气相色谱不适应的高沸点、低挥发、热不稳定的样品,还能够对结构类似物、脂溶性化合物以及热不稳定化合物等多种物质进行分离[29-32]。
本实验主要采用UPC2测定植物油中角鲨烯的含量,在2.5 min内实现了分离。实验证明,此法快速、样品预处理简便、实用性强。实现了植物油中角鲨烯的快速检测。
1 材料与方法
1.1 材料与试剂
植物油样品均购自本地超市,样品编号及名称见表1。为防止所取样品变质而影响数据的准确性,样品均避光冷藏保存。
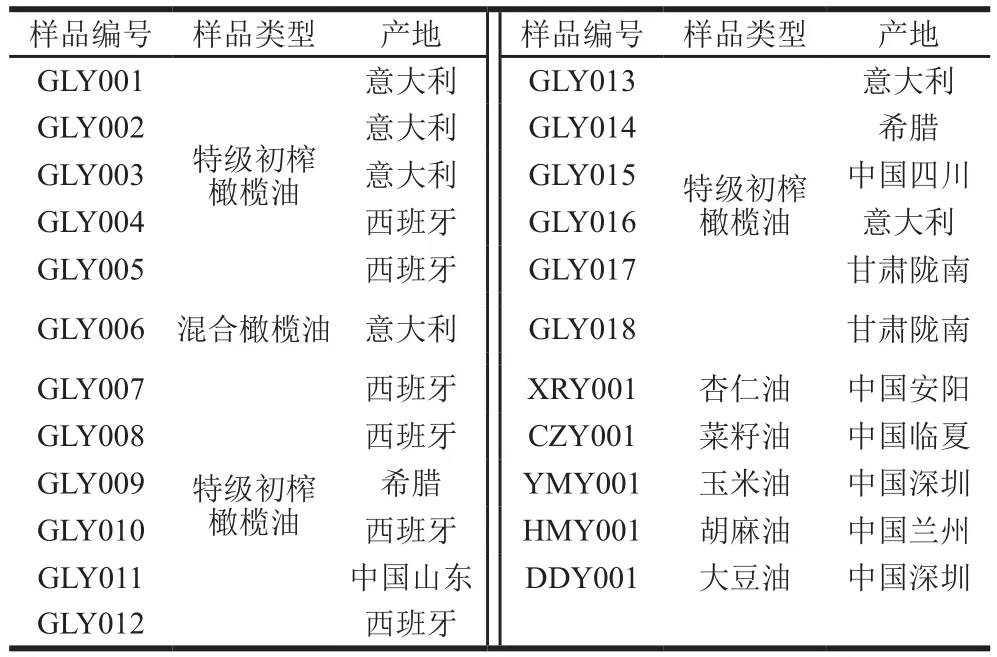
表1 实际样品Table 1 List of actual samples
角鲨烯(纯度>98%) 德国Dr. Ehrenstorfer GmbH公司;乙腈、甲醇(均为色谱纯) 德国Merck公司;CO2(纯度>99.997%) 兰州汇能公司;其余试剂如无特殊说明则均为分析纯。
1.2 仪器与设备
Acquity UPC2仪、Acquity UPLC仪 美国Waters公司;电子天平(±0.01 g) 常熟双杰测试仪器厂;分析天平(±0.1 mg) 德国Sartorius公司;3K30冷冻离心机 美国Sigma公司;MS3涡旋仪 德国IKA公司;移液枪(100~1 000、20~100 μL) 美国Thermo Electron公司。
1.3 方法
1.3.1 标准溶液配制
标准贮备液:分别精确称取角鲨烯0.21 g,用乙腈溶液准确定容至100 mL容量瓶中,配制成2 100 mg/L的标准储备液,4 ℃冷藏待用。
标准工作液:分别准确转移适量标准贮备液至100 mL容量瓶中,乙腈准确定容,配制成相应的标准工作液,4 ℃冷藏待用。
1.3.2 样品处理
方法1(直接稀释法):准确称取0.10 g植物油样品于10 mL容量瓶中,正己烷定容至10 mL,混匀后取1.5 mL经0.22 μm有机相膜过滤后装入进样小瓶中,直接进行检测。
方法2(皂化法):称取0.10 g植物油于50 mL试管中,加入10 mL石油醚,摇匀。再加入20 mL 0.3 mol/L的氢氧化钠-甲醇溶液,振摇,在常温下放置至溶液澄清无油滴,加饱和氯化钠水溶液至刻度,静置分层,取上清液1.5 mL经0.22 μm有机相膜过滤后进样。
方法3(滴定法):除样品称样量稍作改动外,其余步骤均按照AOAC Hicial Method 943.04[11]方法进行处理。
1.3.3 色谱条件
1.3.3.1 UPLC条件
采用Acquity UPLC BEH柱(3.0 mm×50 mm,1.7 μm)进行定量分析。流动相选用乙腈溶液。检测波长215 nm,流速0.3 mL/min,柱温30 ℃,进样量2.0 μL;使用Empower软件进行数据处理。
1.3.3.2 UPC2条件
采用Acquity UPC2HSS C18SB柱(3.0 mm×100 mm,1.7 μm)进行定量分析。流动相A选用CO2,助溶剂B为乙腈溶液。洗脱梯度为:0~0.2 min,助溶剂B,初始1%,0.2~4.0 min助溶剂B比例由1%变为20%,4.0~5.0 min助溶剂B比例回到1%,平衡2.0 min。流速1.5 mL/min,检测波长215 nm,动态背压12.4 MPa,柱温50 ℃,进样量1.0 μL;数据处理使用Empower 3软件。
2 结果与分析
2.1 色谱柱的优化
在实际分离过程中,为了在较短时间内使目标物获得良好的分辨率和峰形,比较HSS SB C18和CSH Fluorophenyl柱对目标物分离的影响。当色谱柱为CSH Fluorophenyl时,样品经皂化后的某一杂质与角鲨烯未能分离,影响其定量的准确性。当使用HSS SB C18色谱柱时,角鲨烯与此杂质能够较好地分离,且峰形尖锐,分析时间仅2.5 min,故本实验选用HSS C18SB柱为分析色谱柱。
2.2 分离条件的优化
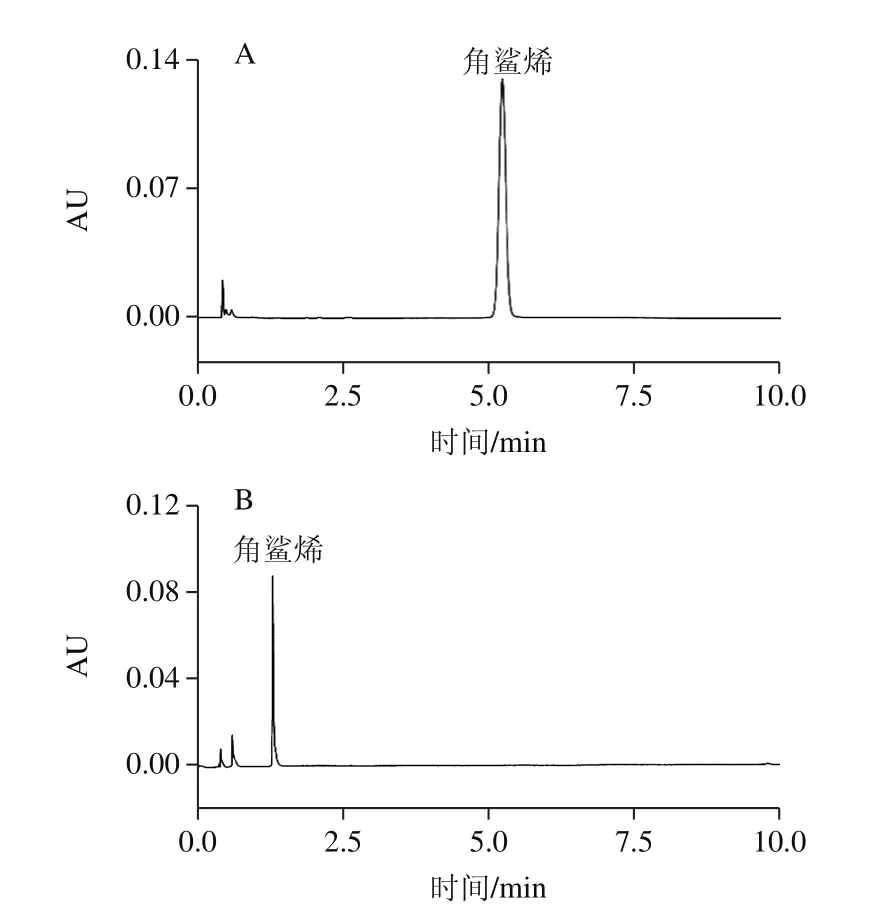
图1 角鲨烯标准的UPLC(A)和UPC2(B)图Fig. 1 UPLC (A) and UPC2 (B) chromatograms of squalene standard
为达到快速分离角鲨烯的目的,本实验分别优化了流速(1.0~2.0 mL/min)、动态背压(10.3~13.8 MPa)、进样量(0.5~3.0 μL)、助溶剂(乙腈、甲醇)以及柱温(40~60 ℃)对角鲨烯分离的影响。通过综合考虑系统最高压力的限制以及样品中杂质与目标化合物的分离度,实验最终结果为流速1.5 mL/min,动态背压12.4 MPa,进样量1.0 μL,乙腈作为助溶剂,柱温为50 ℃时,角鲨烯与杂质完全分离。最佳条件下的角鲨烯标准色谱图见图1。
2.3 样品前处理优化及比较
液相色谱对于角鲨烯的测定原理基本相同,均使用紫外检测器在210~215 nm波长处进行检测。此外,目前主要的前处理方法主要包括3 类,具体描述见表2,关于角鲨烯的前处理方法,方法1为溶剂直接稀释法,此法虽然只需两步即可完成检测,但是此法对于反相色谱而言,易对色谱柱造成损害,基质效应较高,而且过多的杂质峰对角鲨烯的峰形产生干扰;方法2为通过对植物油经皂化后提取进行检测,此法增加了皂化,基质效应明显降低,并且能够很好地适应于UPLC的检测,但是前处理时间较长,不能完成快速检测要求;其次为AOAC的滴定方法,此法操作繁琐,不仅样品前处理的时间较长;而且实验重复性较差,对实验人员操作技能要求较高。综合以上前处理的优缺点可知,方法1和方法2均适合使用UPC2对植物油中的角鲨烯进行检测,且方法1具有更快的前处理速率;方法2则适用于液相色谱对角鲨烯的检测;在没有仪器的前提下,可用方法3对植物油中的角鲨烯进行检测。
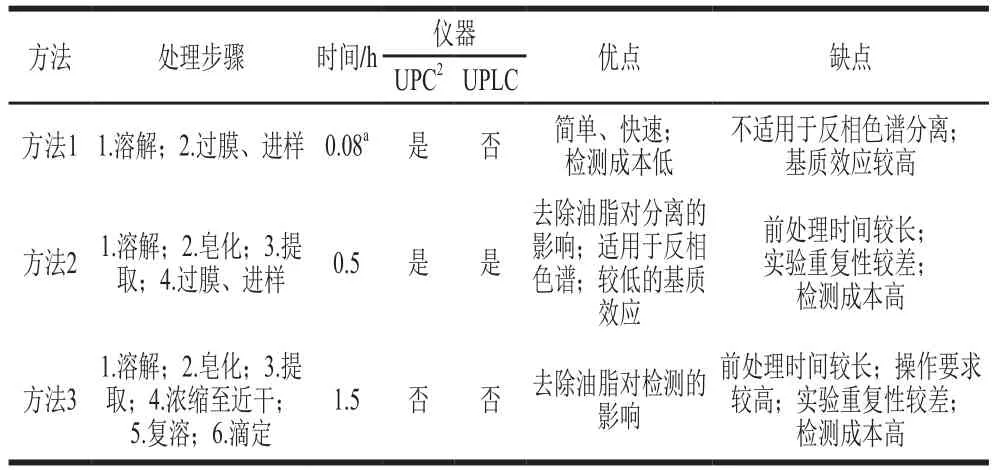
表2 角鲨烯检测方法的优缺点比较Table 2 Comparison of the advantages and disadvantages of squalene detection methods
2.4 方法学考察结果
2.4.1 线性范围和最低检出限
取标准储备液,稀释成5 个质量浓度梯度,按1.3.3节优化后色谱条件进行测定,并绘制样品质量浓度(横坐标x,mg/L)与峰面积(纵坐标y,AU)标准曲线,进行线性回归分析,且当信噪比为3和10时,该方法的最低检出限及定量限如表3所示。结果表明,使用该方法对目标物的检测,在线性范围内具有良好的线性(r>0.999 1),均能满足对植物油中的角鲨烯进行检测的要求。
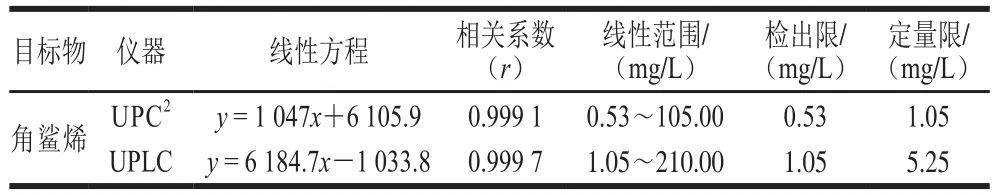
表3 角鲨烯的线性范围及检出限Table 3 Linear ranges and limits of detection for squalene
2.4.2 样品加标回收率和精密度实验结果
在空白样品中添加高、中、低水平的角鲨烯标准溶液,涡旋2.0 min后静置10 min,按2.3节样品处理进行前处理操作后,按1.3.3节色谱条件进行加标回收实验,计算回收率。每加标水平的样品重复测定8 次。结果显示,加标回收率在86.97%~102.41%之间,相对标准偏差在1.3%~4.1%之间。
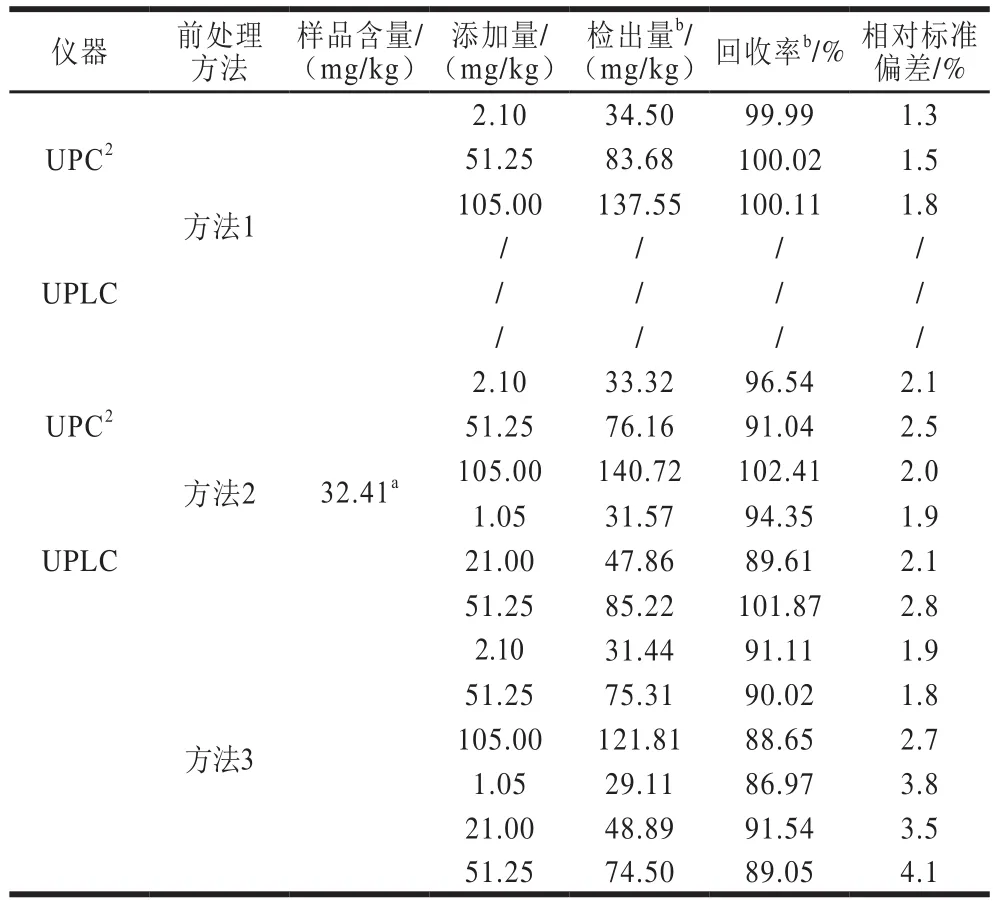
表4 加标回收率实验结果(n=8)Table 4 Recoveries of UPC2 and UPLC (n= 8)
2.4.3 UPC2与UPLC检测方法的比较
为进一步确定方法的准确性,本课题组随机抽取3 个植物油样品对不同的检测方法进行比对实验,按2.3节样品处理进行前处理操作后,按1.3.3节色谱条件进样测定,结果如表5所示。
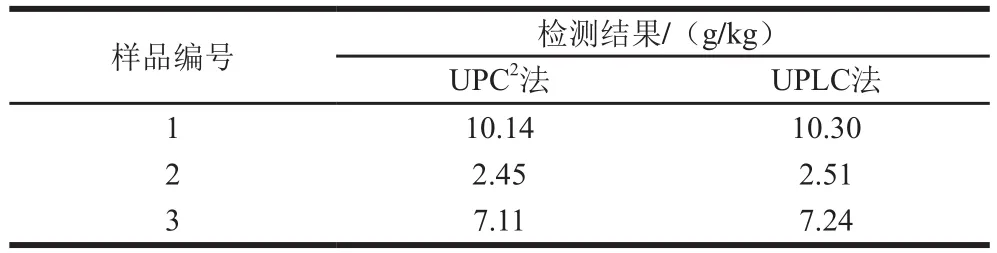
表5 不同检测方法的比对结果(n=3)Table 5 Comparison of squalene determination in vegetable oils by UPC2 and UPLC (n= 3)
由表5可知,UPC2实验结果与UPLC实验结果基本一致,由此可以证明UPC2与UPLC均能满足检测要求,检测方法可靠,相对于UPLC法,UPC2不但可以节约检测时间与检测成本,还可大大提高检测效率,可认为是一种全新的检测方法。
2.5 实际样品的检测结果
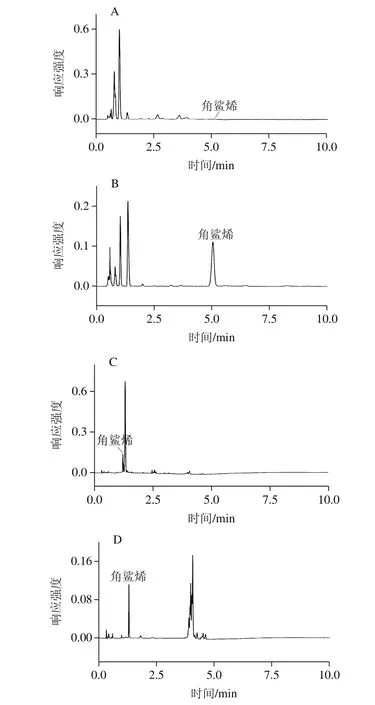
图2 皂化后菜籽油样品(A)、橄榄油样品(B)的UPLC图和UPC2图(C)以及直接稀释后橄榄油样品的UPC2图(D)Fig. 2 UPLC chromatogram of saponified rapeseed oil (A), olive oil (B), UPC2 chromatogram of saponified olive oil (C) and UPC2chromatogram of diluted olive oil sample (D)
本实验在实际样品检测过程中,采用3 种前处理方法分别对不同种类的植物油进行检测。首先,不同植物油样品(编号:CZY001、GLY018)使用传统检测方法2进行处理的UPLC见图2A、B;其次,同一样品(编号:GLY018)使用不同前处理方法(方法1、方法2)的UPC2见图2C、D,可以看出,UPC2因为超临界流体作为流动相而使得色谱保留的性质与传统反相液相色谱不同,不仅适用于传统的方法2,而且同样适用于简单快速的方法1。由表6可知,除橄榄油中角鲨烯含量较高以外,菜籽油、花生油等植物油中角鲨烯含量较少;且UPLC和UPC2均能较为准确地检测出橄榄油中角鲨烯的含量,而滴定法测得角鲨烯含量均较高,且处理时间长,稳定及重复性较差。
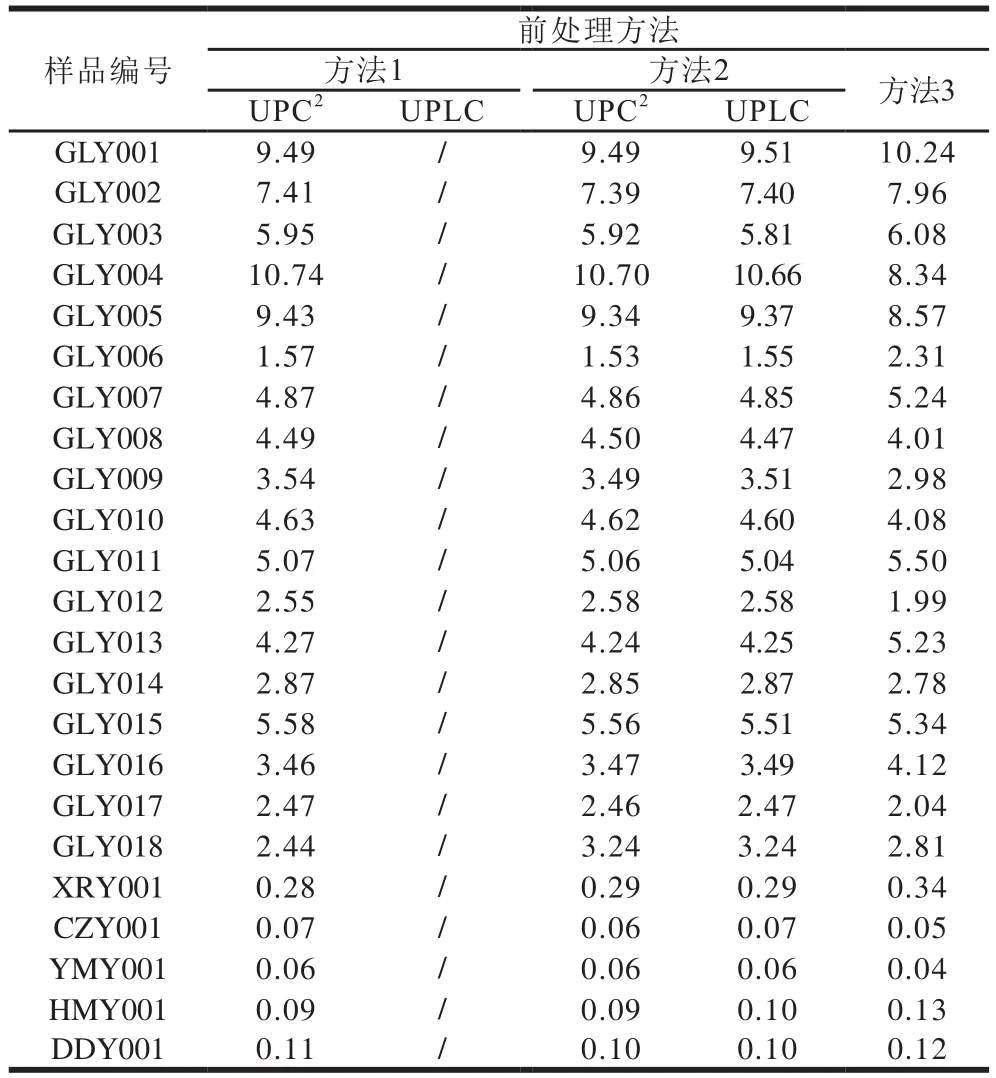
表6 实际样品检测结果(n=3)Table 6 Squalene contents of real samples determined by UPC2 and UPLC with different sample pretreatments (n= 3)g/kg
3 结 论
综上所述,使用UPC2以及UPLC对植物油中角鲨烯的检测结果比较可以看出,由于分离原理以及流动相的不同,对植物油中角鲨烯的检测具有独特的分离优势。而滴定法准确度不高,重复性不好,且操作过程繁杂,不适应大批量样品的快速检测。通过3 种前处理方法的比较,UPC2可兼容样品经正己烷稀释后直接进样,且分离过程中对目标物基本无干扰,检出限低,分离速率快,适合对植物油中角鲨烯进行高通量检测;并对未来的分析提供新的方向及思路。
