3 种优势微生物对宝泉酱挥发性香气的影响
2018-10-31庞惟俏郭德军
庞惟俏,郭德军*
(1.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319;2.钦州学院食品工程学院,广西 钦州 535000)
优质大豆酱多鲜艳光泽、黏度适中、味鲜醇厚、咸甜适口,可用作烹制各种菜肴。同时,大豆酱富含赖氨酸和不饱和脂肪酸,发酵过程中可产低聚肽类,可均衡饮食结构,促进血液循环,并具有降血脂、调节胰岛素、预防癌症等保健功能,备受广大消费者关注[1-2]。
大豆酱中存在丰富的微生物资源,这些微生物均对大豆酱的香气、品质发挥重要作用[3]。宏基因组结合传统微生物分离技术研究表明:鲁氏酵母、耐盐表皮葡萄球菌和解淀粉芽孢杆菌是宝泉酱中的优势菌,鲁氏酵母经18S rDNA测序的序列丰度为97.38%,两株细菌经16S rDNA测序的序列丰度分别为57.43%、1.57%。故预测大豆酱中的挥发性成分可能来源于这些优势微生物,利用优势菌接种发酵,可在不失传统风味的基础上缩短大豆酱的发酵周期。因此研究优势微生物对大豆酱风味的影响十分有意义。
顶空固相微萃取(h e a d s p a c e s o l i d p h a s e microextraction,HS-SPME)结合气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)技术目前已广泛应用于发酵食品的挥发性成分的研究中,应用在大豆酱中香气成分的测定也有报道[4]。康旭等[5]利用GC-MS技术证实黄豆中不同类别氨基酸含量与豆酱风味物质存在相关性。庞惟俏等[6]利用GC-MS分析工厂酱和农家酱挥发性成分的种类和含量的区别,工厂酱更优。电子鼻[7]是模拟动物的嗅觉,利用气体传感器阵列的响应值来识别气味的电子系统,响应时间短[8]、检测快速、测定范围较广、重复性好,能挖掘人鼻不能嗅闻的气体,在食品行业发挥着越来越重要的作用[9],目前,电子鼻用于分析面酱和花生酱等酱类中香气物质。楼飞等[10]使用电子鼻技术区分2 种花生酱香气成分的差异,为日后鉴定不同品牌的花生酱提供理论依据;但应用电子鼻分析大豆酱香气成分之间差异性的研究鲜有报道。鲁氏酵母属于豆酱呈味的有益酵母,其发酵后的代谢产物包括醇类和甘油[11]。目前,鲜见文献报道耐盐表皮葡萄球菌在大豆酱中检出,Montel等[12]发现木糖葡萄球菌和表皮萄球菌作为肉制品发酵剂,可生成氨基酸类和其他重要的风味物质。解淀粉芽孢杆菌具有较强的淀粉酶和酸性蛋白酶活性[13],其水解可产生还原性单糖和氨基酸,可促进酱的美拉德反应[14]。本研究以从宝泉岭大豆酱中分离的优势菌Zygosaccharomycse rouxii BSZ.16910、Staphylococcus epidermidis BSS.17312和Bacillus amyloliquefaciens BSB.170120为研究对象,按一定比例组合接种于无菌大豆酱醅中进行发酵,利用电子鼻和HS-SPME-GC-MS技术分析不同微生物对大豆酱挥发性成分的影响;通过因子分析,进一步确定优势菌对大豆酱香气成分的贡献,对明确香气的微生物来源、缩短发酵时间、稳定发酵品质、揭示呈香机理、优化产品质量和生产工艺改进具有指导意义。
1 材料与方法
1.1 材料
发酵7 d的大豆酱酱醅和发酵34 d成熟大豆酱由黑龙江省宝泉岭酱厂提供。菌种:Z. rouxii BSZ.16910、S. epidermidis BSS.17312、B. amyloliquefaciens BSB.170120为利用宏基因组技术和传统微生物分离技术,从成品宝泉酱中分离获得的优势菌,现保藏于黑龙江八一农垦大学食品学院分子生物技术实验室。
1.2 仪器与设备
GC 6890-MS 5973N型GC-MS联用仪 美国Agilent公司;50/30 μm二乙基苯/碳分子筛/聚二甲基硅氧烷萃取头、J&W DB-5石英毛细柱(60 m×0.25 mm,0.25 µm)美国J&W Sci公司;PEN3.5型便携式电子鼻 德国Airsence公司;LDZF-30L型立式压力蒸汽灭菌器 上海申安医疗机械厂。
1.3 方法
1.3.1 酱醅无菌化处理
7 份大豆酱醅,每份500 g,分装在三角瓶中,110 ℃灭菌20 min,间歇24 h后再灭菌一次,平板法检查酱醅无菌后使用。
1.3.2 大豆酱样品制备
菌种Z. rouxii BSZ.16910接种在YPD液体培养基中,28 ℃培养24 h;S. epidermidis BSS.17312接种在MRS液体培养基中,37 ℃培养48 h;B. amyloliquefaciens BSB.170120接种在LB液体培养基中,37 ℃培养48 h。将菌液3 000 r/min制冷离心后,经磷酸盐缓冲液洗涤2 次,在无菌环境中,将菌液体积比按照表1进行1∶1∶1方式组合,按2‰的接种量,接入酱醅中进行发酵,参照企业的产品加工技术参数和工艺进行发酵,发酵时间约为20 d(按照菌落计数国标法对每种样品发酵过程中微生物总数进行计数,待其总数达到成品宝泉酱的总数时,停止发酵),采集样品至于无菌袋中4 ℃保存,用于后续实验,样品命名如表1所示。
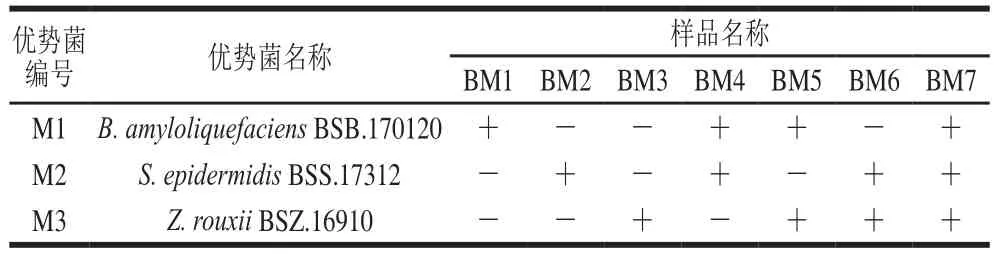
表1 添加菌株组合方式发酵的大豆酱名称Table 1 Pure and mixed starter cultures for fermented soybean paste
1.3.3 感官评价
选择有经验的实验室品评人员(5 位男性、5 位女性)对大豆酱的稠度(10 分)、硬度(10 分)、色泽(20 分)、气味(20 分)、均匀性(20 分)、总体可接受性(20 分)进行感官评分,满分100分,评分规则[11]如表2所示。
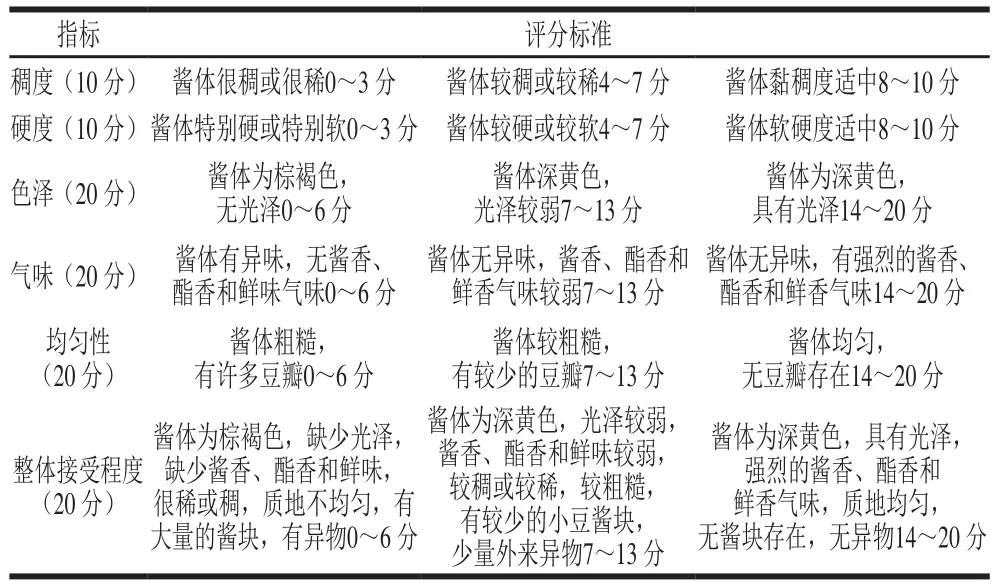
表2 大豆酱感官评分标准Table 2 Criteria for sensory evaluation of fermented soybean paste
1.3.4 电子鼻检测
分别取不同种大豆酱样品约1.00 g,置于电子鼻专用瓶内。将电子鼻系统进行预热和校准,确保电子鼻采集数据时的精确度和稳定性。电子鼻分析条件:传感器清洗时间设置180 s,零点校准时间10 s,检测时间60 s,进样流量150 mL/min,进样量250 μL,注射器温度70 ℃。按上述条件,每个样品准备3 个重复,取48~59 s处的信号作为电子鼻分析的时间点。电子鼻传感器性能描述见表3。
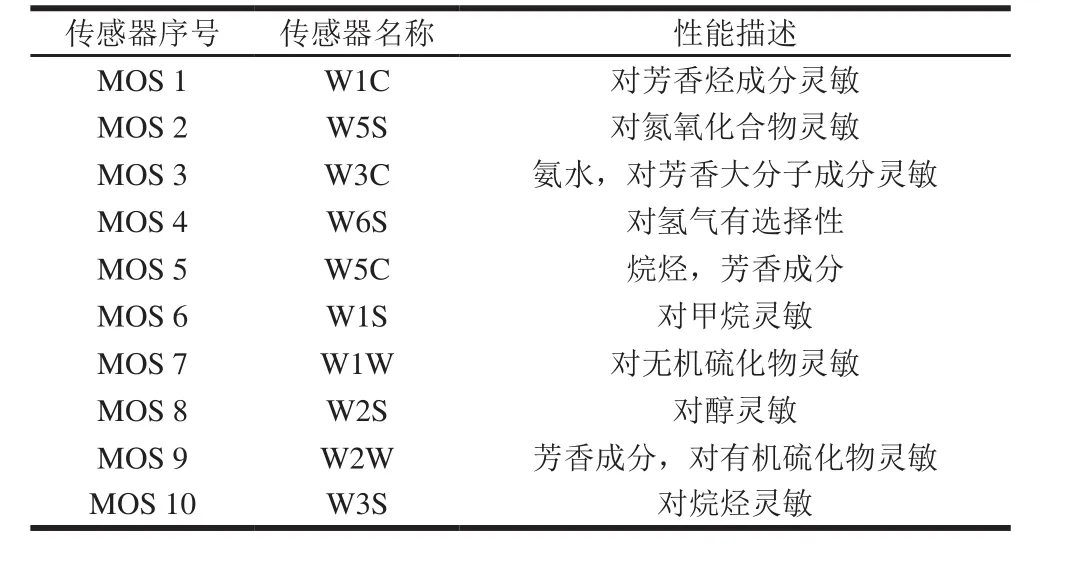
表3 电子鼻传感器性能描述Table 3 Performance description of ten electronic nose sensors
1.3.5 挥发性成分测定
萃取条件:取每种大豆酱约10 g加入40 mL样品瓶中,加入经过稀释的对甲氧基苯甲醛内标溶液0.01 μL,将样品瓶放入60 ℃水浴中平衡10 min,将老化5 min的萃取针头插入样品瓶中,推出纤维头,顶空气体中恒温60 ℃萃取30 min,于250 ℃解吸1 min,启动仪器采集数据。
GC条件:J&W DB-5石英毛细柱(60 m×0.25 mm,0.25µm);进样口温度250 ℃;载气为氦气(He),流速1.0 mL/min;采用程序升温,由室温升至80 ℃保持2 min,以4 ℃/min升至180 ℃,并保持3 min,以5 ℃/min升至230 ℃,保持5 min,降温至80 ℃;进样方式为不分流进样。
MS条件:离子源在225 ℃全扫描;电子电离源;电子能量70 eV;质量扫描范围50~500 u。
1.4 数据分析
1.4.1 GC-MS数据分析
定性分析利用计算机对采集到的质谱图进行检索,辅助人工解析图谱,与NIST 02.L标准谱库进行对照匹配。定量分析根据内标物的浓度、样品中各组分的峰面积与内标对甲氧基苯甲醛的峰面积比[15],大豆酱样品中各组分含量按下式计算:
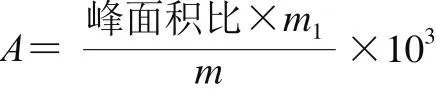
式中:A为大豆酱各挥发性成分含量/(ng/g);m1为内标物对甲氧基苯甲醛的质量/μg;m为每种大豆酱样品的质量/g。
1.4.2 电子鼻数据分析
主成分分析(principal component analysis,PCA)由电子鼻自带软件完成。
1.4.3 数据处理
利用SPSS 18.0软件对主要的挥发性香气成分进行因子分析,相关关系的变量X1、X2…X6代表检测出的香气化合物的种类。
2 结果与分析
2.1 优势菌接种大豆酱的感官评价结果
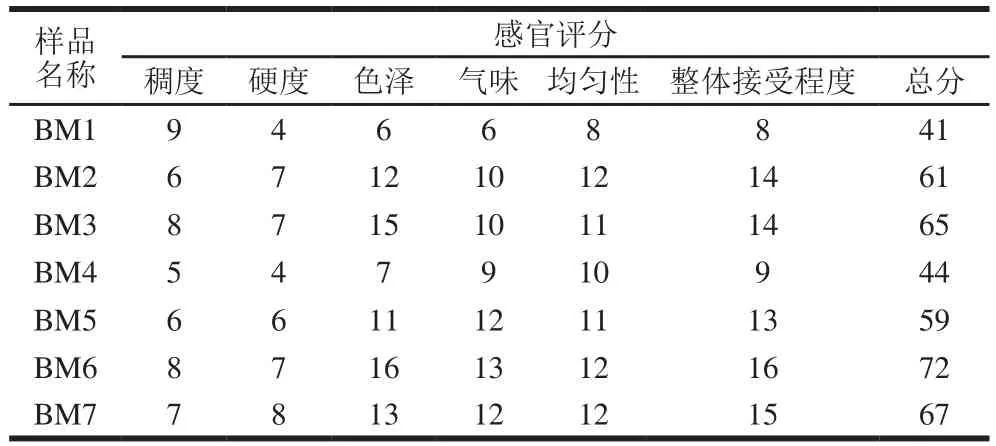
表4 优势菌发酵的大豆酱感官评分结果Table 4 Sensory evaluation of fermented soybean paste samples
由表4可知,不同菌株按一定比例接种酱醅,发酵后的感官评价排名为BM6>BM7>BM3>BM2>BM5>BM4>BM1。BM6接种了鲁氏酵母菌和表皮葡萄球菌,酵母菌代谢氨基酸、分解糖,产生风味前体物质;表皮葡萄球菌具有明显的蛋白酶和脂肪酶活性[16],有利于大酱鲜味氨基酸和风味酯类物质的产生,也可能是这2 种菌在酱醅中有很好的协同作用,有利于风味物质在数量和种类上的增加。BM1的感官评分较低,有微弱的臭味,这表明仅添加解淀粉芽孢杆菌的豆酱风味较差,其发酵的大豆酱的颜色较深,均匀性较差;但BM1的稠度较大,因为解淀粉芽孢杆菌释放黏度高的黏液。张娟等[17]证实解淀粉芽孢杆菌在大豆酱中属有益菌,可抑制杂菌生长,延长发酵食品的保质期。但解淀粉芽孢杆菌易生成芽孢而比较耐热,易造成产品杀菌不彻底,容易引起包装后的成品酱细菌总数超标。
2.2 优势菌接种大豆酱的电子鼻检测分析
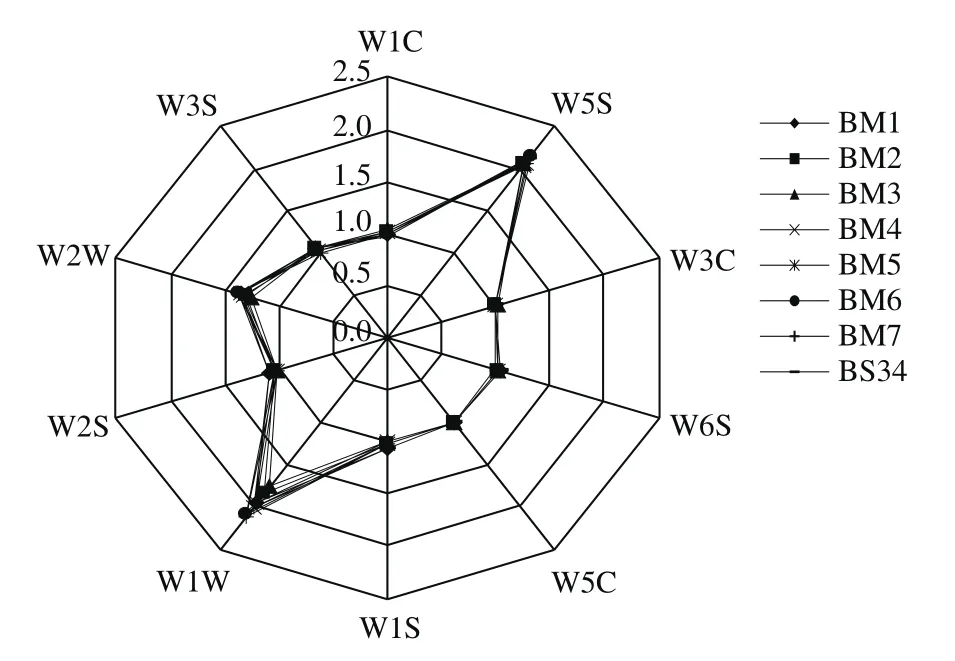
图1 优势菌种发酵的大豆酱电子鼻传感器特征响应值雷达图Fig. 1 Radar chart of characteristic response values of fermented soybean paste samples from electronic nose
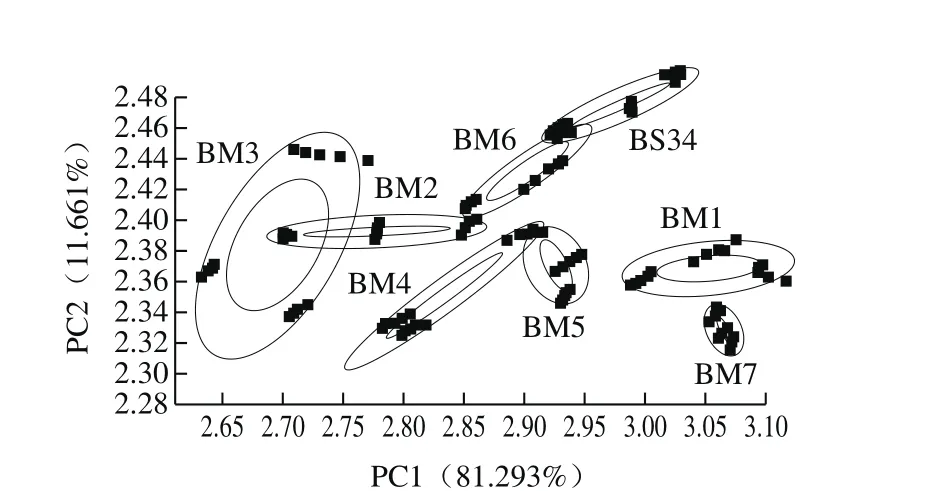
图2 优势菌发酵的大豆酱电子鼻PCA图Fig. 2 PCA plot of electronic nose data of different soybean paste samples
根据表3中电子鼻的10 个传感器性能描述,并结合图1可知,8 种样品对10 个传感器的特征响应值均在2.5以下,其香气成分均对传感器W1W、W2W和W5S响应强度较大;其次是传感器W2S、W3S、W1S;但传感器W5C、W6S、W3C、W1C对大豆酱的香气响应强度极小。上述结果表明,电子鼻传感器对大豆酱中的含硫化合物、醇类及氮氧化合物特别灵敏,而对烷烃类、氢气、芳香烃、芳香大分子响应不敏感。由图1可以看出,10 种传感器对8 个样品的响应强度值十分接近,这表明7 种优势菌接种大豆酱的特征性香气成分的差异相对较小,初步判定它们与成品大豆酱(BS34)的挥发性成分组成相似。
为进一步确定不同菌种发酵大豆酱的风味与成品大豆酱的相似程度,通过PCA法对数据进行统计分析,将传感器的数值进行转换及降维[18-19]。由图2可以看出,PC1贡献率为81.293%,PC2贡献率为11.661%,两者累计贡献率为92.954%,较全面地反映原始数据的降维信息,说明二者包含全部样品的整体香气变化信息。从7 种菌种组合发酵的大豆酱与成品大豆酱之间的距离可看出,成品大豆酱与BM6的距离最小,与BM7的距离最大,这说明菌株M2和M3混合后接种大豆酱与成品大豆酱香气相接近,差异不显著,这与其感官评分结果一致;3 种混合菌株发酵的大豆酱风味和成品大豆酱之间差异较显著。因此,可考虑在大豆酱发酵过程中接种M2和M3,不但缩短发酵周期,并在一定程度上满足成品大豆酱风味。同时,BM4和BM5的椭圆区有部分重叠,表明其发酵成熟后香气相近,这可能与接入的M1有关。张玉玉等[19]利用电子鼻对7 种面酱煮制前后的香气进行比较,把相似度较高的样品聚类在一起,PC1和PC2的贡献率分别为99.839%和0.138 3%。大豆酱中主要的挥发性成分是醇酯类[20],本实验中使用的电子鼻缺少酯类物质的检测器,因此,不能有效地区分样品风味之间的差异。
2.3 优势菌接种大豆酱的挥发性成分分析
为进一步阐明大豆酱挥发性成分的微生物来源及含量,明确不同菌种发酵对大豆酱挥发风味的贡献。由表5可知,利用HS-SPME-GC-MS在7 种样品中共检出38 种挥发性成分,包括15 种酯、6 种醇、6 种醛酮类、3 种酸酚类、8 种其他化合物。在单一菌种发酵的BM1、BM2和BM3中分别检出10、15、15 种挥发性成分,含量分别为190.02、101.42 ng/g和538.37 ng/g。BM3中挥发性成分含量最多,可能是因为鲁氏酵母的主要作用是醇类发酵,可合成多种酯类香气成分、甘油和多元醇,使得其挥发性成分含量较高[21]。混合菌种发酵的BM4、BM5、BM6、BM7中共鉴定出18、12、16、11 种化合物,含量分别为662.33、166.89、218.50 ng/g和721.52 ng/g。主要的挥发性成分包括亚油酸乙酯、棕榈酸乙酯、苯甲酸乙酯、3-甲基-1-丁醇、苯乙醇、苯甲醛、苯乙醛、3-甲氧基苯乙酮。每种大豆酱挥发性成分的种类较成品大豆酱挥发性成分减少约10 种,含量降低在188.47~743.1 ng/g之间。
从表5可以看出,M1、M2、M3菌株无论是单独发酵还是混合发酵,酯和醇都是主要的呈香成分,其中棕榈酸乙酯是它们在大豆酱中代谢产生的主要挥发性成分,因此它们是宝泉酱中主要香气物质棕榈酸乙酯的微生物来源,也影响其主要的风味,其主要来源于酵母菌M3;在天然发酵的干酪中棕榈酸乙酯也被发现[22]。3 种菌株之间在代谢产生酯类的含量和种类上存在微妙的互作关系。酯类物质是含氧酸与醇或酚类反应得到的,对大豆酱香气成分的形成贡献较大[23,21],可增加大豆酱的酯香,满足人们味觉享受并给人愉悦感,其大多由酵母利用糖代谢产生,并可抑制霉菌的生长,可作为大豆酱自身的防腐剂[24]。样品中的挥发性成分与发酵34 d的成品大豆酱相比,相同的酯类包括苯甲酸乙酯、亚油酸乙酯、亚油酸甲酯、肉豆蔻酸乙酯、十五酸乙酯、棕榈酸乙酯。BM4中酯类化合物总含量约为BM1和BM2的3 倍和5 倍,表明M1和M2菌株共同发酵对大豆酱酯类物质有增效作用;而BM5和BM6中酯类物质总含量较单一菌株发酵样品的含量降低,M1和M3、M2和M3两菌株共同发酵对酯类总量具有减效作用。具有水果香的苯甲酸乙酯未在BM1中检出,表明M1不产该种酯类。肉豆蔻酸乙酯具有温和鸾尾花香气并带有油脂香,其是由糖发酵产生的[25],本实验在5 种样品中均检出微量的该酯。微量的乙酸乙酯、正己酸乙酯、2,2-二甲基丙酸-2-苯基乙酯,分别在BM6、BM4、BM5中被检出。辛酸乙酯拥有白兰地酒香[26],未在含有M1菌株的BM1、BM4和BM5中检出,表明M1菌株具有抑制该种酯合成的作用。具有香甜红玫瑰似香气及浓厚蜂蜜风味的丙酸-2-苯乙酯在BM6和BM7中检出,在单一菌发酵的样品中未发现,可能是菌株之间互作的产物。M1菌株产酞酸二乙酯,仅在BM1中产生,含量较少;乙酸苯乙酯和月桂酸乙酯只在BM3中被检出,表明其来源于M3菌株。
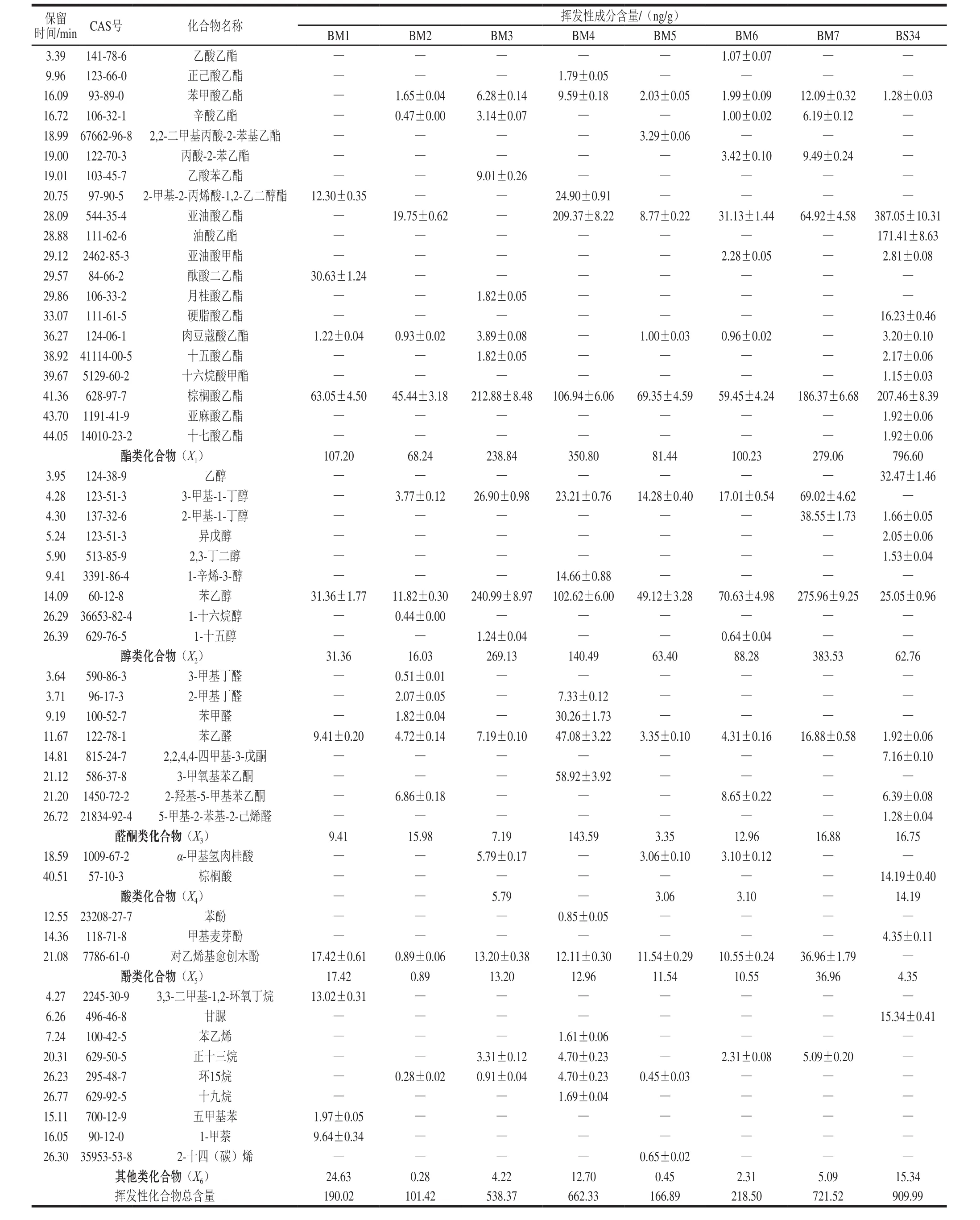
表5 优势菌发酵大豆酱中主要挥发性成分分析Table 5 Volatile compounds in fermented soybean paste samples identi fi ed by HS-SPME-GC-MS
大豆酱中酵母菌[27]在发酵麦芽糖、葡萄糖可产生异戊醇、乙醇等。BM3中醇类物质含量最高为269.13 ng/g,约为BM1和BM2的8 倍和16 倍,这证明菌株M3主要产醇类化合物。BM7中醇类物质总含量为383.53 ng/g,与BM1、BM2、BM3的总含量之和差异较小,表明3 株菌株发酵的样品在醇类化合物合成上具有等效作用。在BM7中鉴定出2-甲基-1-丁醇,呈清快香气,含量为38.55 ng/g,仅在3 种菌株共同作用下才能产生;被广泛用在食品中的增香剂苯乙醇,给人愉悦的玫瑰花香,在所有样品中均被检出;3 种菌株共同发酵时,对于苯乙醇的合成具有明显的协同增效作用。乔鑫[28]认为苯乙醇是苯丙氨酸在微生物作用下经Strecker降解产生醛后进一步还原生成,有很好的嗅感,可增加酱的醇香。BM4中检出少量的1-辛酸-3-醇,仅在M1和M2两株菌共同发酵时产生,该种化合物在大豆酱中未见检出报道。仅在BM1中未检出具有苹果白兰地香气的3-甲基-1-丁醇[29],而在其余样品中均含有该醇,这表明菌株M1自身代谢不生成该种化合物。同时,复合菌发酵的BM5和BM6中,该化合物的含量较单一菌发酵的BM3中的含量低,菌株M3与M1和M2共同发酵可抑制其产生。
脂肪分解可产生醛类和酮类化合物,葡萄球菌可分泌脂肪酶,促进大豆脂肪的分解。复合菌发酵的BM4中醛酮类化合物的含量比单一发酵的BM1和BM2的总量高15 倍左右,菌株M1和M2共同发酵对样品中醛酮类化合物的生成有明显的增效作用。在所有的样品中,具有类似风信子和水果甜香气的苯乙醛[30]均检出,BM4中含量最高为47.08 ng/g,约为BM5的14 倍,这可能是表皮葡萄球菌代谢脂肪酶促进脂肪分解,氧化的最终产物为醛[31]。3-甲氧基苯乙酮仅在BM4中检出,表明菌株M1和M2代谢合成该酮。3 种菌株中,M2菌株产生醛酮化合物的能力较强,表明宝泉岭大酱中醛酮类化合物主要来源于M2菌株。同时,BM4中醛酮化合物的含量约为BM2的8 倍,约为BM1的15 倍,表明菌株M1和M2互作对醛酮类化合物总量的生成具有明显的增效作用。
3 种菌株发酵的BM7中酸酚化合物的总含量最高,为其他样品的35 倍以上;3 菌株混合发酵对大豆酱酸酚化合物总量的生成具有增效作用。大豆酱中酸主要由嗜盐四联球菌、乳酸菌产生,且可与醇生成酯,为酯类风味和美拉德反应的前体物质[28]。本实验中仅检出1 种酸,为α-甲基氢肉桂酸,存在于含有M3菌株的样品中。具有烟熏香味的对乙烯基愈创木酚在7 种样品中均检出,但含量不同,其中BM7的含量最高,为36.96 ng/g。
2.4 样品挥发性成分的因子分析
为进一步确定不同优势菌对大豆酱挥发性成分的影响,利用因子分析将主要挥发性成分归为少量的因子变量,以便确定不同菌株发酵的大豆酱风味的差异。由表6可知,KMO值为0.835,在0.5~1之间,相关性较大,证明表5的数据可进行因子分析[10]。根据表7、8可知,前2 个主成分的累计贡献率达到97.059%,其涵盖了6 种香气成分的所有信息。第1个公因子代表酯类、醇类,不同菌株发酵的大豆酱中的酯和醇含量及种类也不相同,因此,二者对豆酱的香气成分贡献较大,含量越多,醇酯香就越浓郁,豆酱香气就更佳;第2个公因子代表酸类、酚类、醛类、酮类、其他类,尽管这几类化合物对大豆酱的香气贡献较小,但其均可作为醇和酯化合物的前体物质并丰富大豆酱风味的多样性[15]。
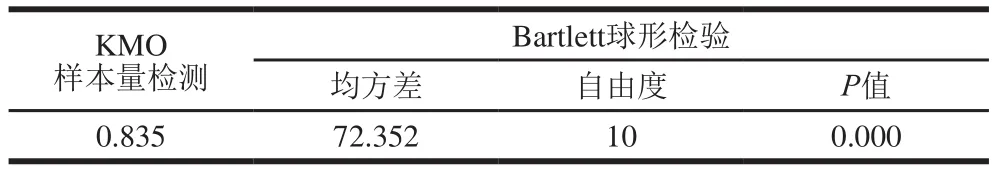
表6 KMO和Bartlett’s检验Table 6 KMO and Bartlett’s test
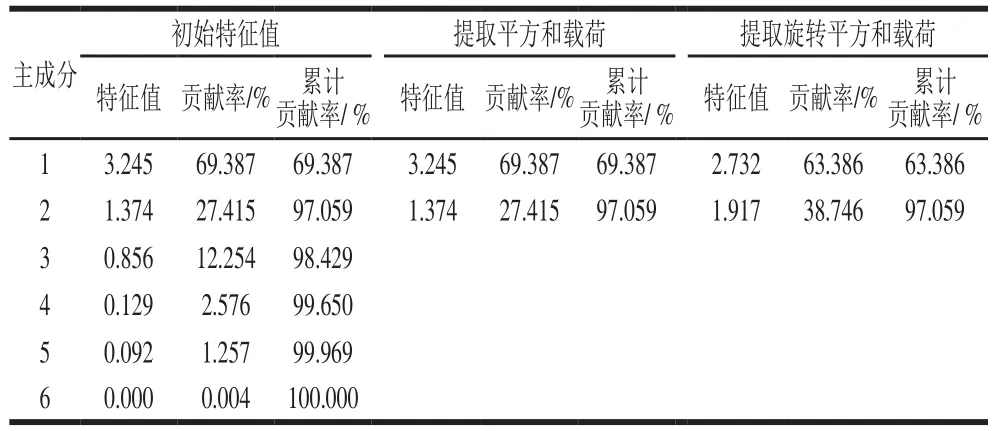
表7 优势菌接种大豆酱香气成分的特征值和方差贡献率Table 7 Eigenvalues and variance contributions of aroma components of different soybean pastes
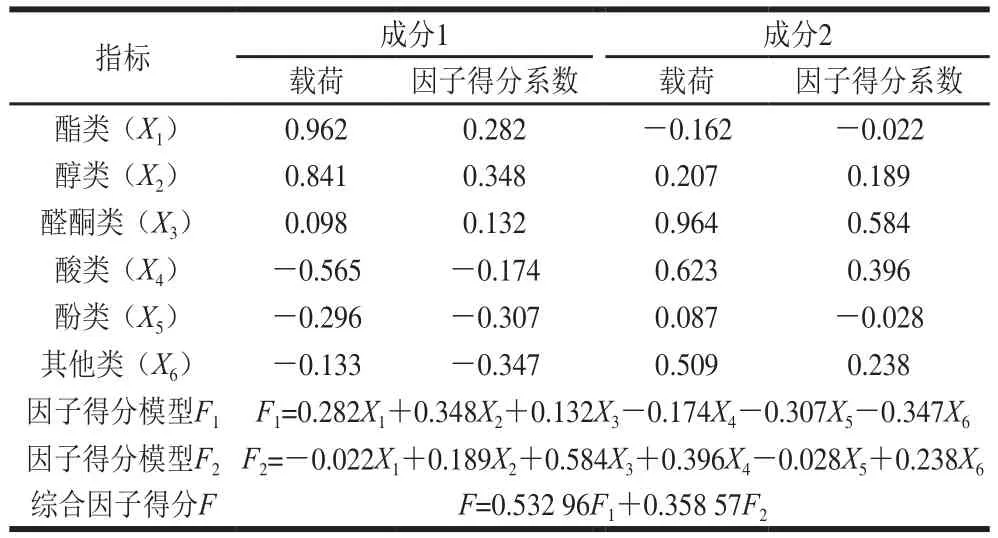
表8 旋转后的载荷矩阵和因子得分系数矩阵Table 8 Loading and component score coefficient matrix after rotation
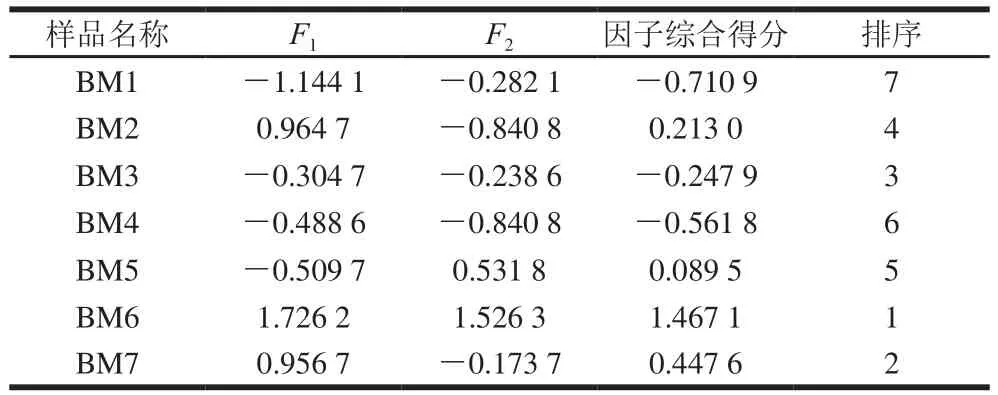
表9 因子综合得分Table 9 Component composite scores
综上所述,并结合表9可知,不同菌接种大豆酱的因子分析排序为BM6>BM7>BM3>BM2>BM5>BM4>BM1,这与感官评价的结果相一致,B. amyloliquefaciens BSB.170120和S. epidermidis BSS.17312发酵的BM6醇酯香更浓郁,香气更好;同时,也进一步证实这2 株菌可产生大量的醇和酯。
3 结 论
本实验采用感官评价、电子鼻技术和HS-SPME-GCMS法,对不同组合菌种发酵的大豆酱的风味属性和挥发性成分的种类、含量进行较全面的分析。接种鲁氏酵母和表皮葡萄球菌混合发酵的BM6整体品质更易被人接受。电子鼻的分析结果显示,7 种发酵样品的香气特征成分与成品宝泉酱的差异性相对较小,BM6的风味属性更接近发酵34 d宝泉成品酱。单一菌发酵的样品与成品大豆酱相比,苯甲酸乙酯、肉豆蔻酸乙酯、棕榈酸乙酯和苯乙醇主要来源Z. rouxii BSZ.16910;2-羟基-5-甲基苯乙酮来源于S. epidermidis BSS.17312。从组合菌发酵的样品来看,与成品大豆酱相比,苯甲酸乙酯、2-甲基-1-丁醇、苯乙醇的含量在3 种优势菌的作用下含量增加;B. amyloliquefaciens BSB.170120和S. epidermidis BSS.17312组合发酵具有促进亚油酸乙酯、苯乙醛的含量增加的作用;S. epidermidis BSS.17312和Z. rouxii BSZ.16910组合可促进亚油酸甲酯的产生,而抑制肉豆蔻酸乙酯。基于因子分析,优势菌M2(S. epidermidis BSS.17312)和M3(Z. rouxii BSZ.16910)对宝泉酱香气成分酯和醇的产生贡献较大,是大豆酱发酵的有益菌株,有利于大豆酱风味的形成,因此具有在大豆酱发酵中应用的潜质。
