碱性木聚糖酶产生菌株的分离鉴定与产酶分析
2018-10-31甘雅霆董重实闫达中
甘雅霆,周 慧,李 艳,董重实,赵 硕,闫达中,*
(1.武汉轻工大学生物与制药工程学院,湖北 武汉 430023;2.中国科学院大学资源与环境学院,北京 100049)
木聚糖酶(1,4-β-D-xylanase,EC3.2.1.8)属水解酶类,是将木聚糖降解为低聚木糖或木糖的复合酶系。该酶在自然界的来源广泛,诸如细菌(如枯草芽孢杆菌、黄热芽孢杆菌、甲基营养型芽孢杆菌、拜氏梭菌、耐盐高温双歧菌)、真菌(如木霉、青霉、米曲霉、黑曲霉、土曲霉)、放线菌、蜗牛等[1-3]。木聚糖酶有重要的工业价值,已应用于食品、造纸、饲料、能源和环境众多领域,尤其是在食品制作和纸浆生物漂白中有着不可小觑的重要性[4]。据澳新食品标准局消息,2017年7月7日澳新食品标准局发布17-17号通报,批准一种木聚糖酶作为加工助剂用于谷物食品生产。据了解,2017年1月23日,Puratos NV公司提交A1125号申请,申请木聚糖酶作为内切酶使用于谷物产品生产并提交相应草案。该木聚糖酶由转基因枯草芽孢杆菌产生。它能催化阿拉伯木聚糖转化成阿拉伯木聚糖寡糖,提高这些多糖的功能特性,取得更好或更稳定的产品质量,可用于面包、饼干、蛋糕等烘培食品,还有面食、面条、小吃等谷物产品[5]。此外,木聚糖酶在纸浆漂白中取代毒性化学物质的同时通过酶法预处理还能有效回收副产物,降低化学漂白剂用量,改善漂白效果,具有良好的环境和经济效益。
不同来源的木聚糖酶最适pH值不同,真菌接近于酸性,大部分放线菌和细菌接近于中性。最适反应温度大多在50~60 ℃左右,大大制约了木聚糖酶在工业中高温高碱环境下的应用[6]。由于来源于细菌的木聚糖酶的耐碱性和热稳定性方面要优于真菌和放线菌,所以成为目前工业用木聚糖酶的研究热点[4,7]。本研究从造纸厂的活性污泥中分离筛选产碱性木聚糖酶的菌株,并对1 株高产酶菌进行鉴定,以期为细菌木聚糖酶的研究和工业化应用提供细菌菌种资源。
1 材料与方法
1.1 材料与试剂
1.1.1 样品来源
从武汉汉阳晨鸣造纸厂的活性污泥和污水排放口附近的泥土中分别多点采样。
1.1.2 试剂
桦木木聚糖 美国Sigma公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(分析纯) 溴百里酚蓝、结晶紫、番红、醋酸铅滤纸以及其他化学试剂(均为分析纯) 中国医药集团(上海)化学试剂公司;dNTP Mix、Taq酶 宝生物工程(大连)有限公司。
1.1.3 引物
引物均购自生工生物工程(武汉)有限公司。正向引物27F(5’-GAGAGTTTGATCCTGGCTCAG-3’);反向引物1492R(5’-CTACGGCTACCTTGTTACGA-3’)。
1.1.4 培养基
无机盐培养基:木聚糖1 g/L,硝酸钾1 g/L,氯化钠0.2 g/L,磷酸氢二钾0.5 g/L,硫酸铵0.3 g/L,pH 8.5。配制固体培养基时加20 g/L琼脂粉。种子培养基:葡萄糖10 g/L,蛋白胨5 g/L,氯化钠5 g/L,pH 8.5。基础产酶培养基:木聚糖1 g/L,酵母膏2 g/L,玉米浆5 mL/L,硫酸镁0.2 g/L,氯化钠0.5 g/L,磷酸氢二钾0.5 g/L,pH 8.5。复筛产酶培养基:葡萄糖1.5 g/L,酵母粉4 g/L,玉米浆15 mL/L,硫酸镁1 g/L,氯化钠0.5 g/L,磷酸氢二钾1 g/L,氯化钙15 g/L,pH 8。LB培养基:蛋白胨10 g/L,酵母粉5 g/L,氯化钠10 g/L,琼脂粉20 g/L,pH 7。
1.2 仪器与设备
LAMBDA™ 25 Series紫外-可见分光光度计美国PerkinElmer公司;聚合酶链式反应(polymerase chain reaction,PCR)仪 德国耶拿分析仪器股份有限公司。
1.3 方法
1.3.1 产木聚糖酶菌株的分离
分别称取活性污泥10 g,接种于250 mL液体无机盐培养基中,于170 r/min、28 ℃摇床培养7 d。取5 mL培养物接入液体无机盐培养基传代培养,重复3 次。取最终培养物稀释成不同浓度梯度,在10-6~10-8梯度取稀释菌液0.2 mL涂布于选择培养基平板,入培养箱28 ℃培养,挑取透明圈较大并具有细菌形态的单菌落进行分离、纯化,直至得到均匀的单菌,于1 mL 20%甘油的LB培养基中-20 ℃保藏。
1.3.2 高产木聚糖酶菌株的筛选
初筛:从分离得到的7 株单菌落分别接入150 mL的种子培养基中,于28 ℃、170 r/min摇床培养24 h。分别取100 μL培养物接种到100 mL基础产酶培养基,于28 ℃、170 r/min摇床培养24 h,加入0.01 g/L木聚糖溶液3 mL诱导培养24 h后,测定波长600 nm处的光密度(OD600nm),同时将发酵液6 000 r/min离心,取粗酶液,测其酶活力。
复筛:对7 株中酶活力最高的1号菌株,命名为YD01,进行无机盐平板涂布培养,随机挑3 个单菌落分别接种于50 mL无机盐培养基28 ℃、170 r/min摇床培养,至OD600nm达到0.4~0.6时加入0.01 g/L木聚糖溶液3 mL,12 h后取1 mL菌液接种200 mL复筛产酶培养基于28 ℃、170 r/min培养48 h,将发酵液6 000 r/min离心10 min,取上清粗酶液,测其酶活力。
1.3.3 DNS定糖法测定木聚糖酶活力[8]
取0.5 mL稀释粗酶液入试管,加入1.0 mL质量浓度为5 mg/mL的木聚糖溶液,摇匀,50 ℃水浴反应30 min,加入2.5 mL DNS试剂摇匀后沸水浴加热10 min,待冷却至室温后加入8.5 mL蒸馏水定容到12.5 mL,摇匀,测定波长540 nm处OD值。每组3 次重复,取其平均值。空白对照组则预先将酶加热失活处理,其余步骤同实验组。将每分钟生成1 μmol还原糖(以木糖计)所需酶量定义为1 个酶活力单位(U)。还原糖(木糖)标准曲线方程为:y=1.710 0x-0.111 5,R2=0.994 9。酶活力计算公式如下:
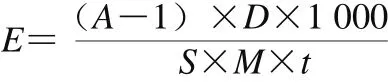
式中:E为样品酶活力/U;D为稀释倍数(200);A为酶液反应的OD值;S为标准曲线的斜率;I为标准曲线的截距;M为木糖的分子质量(150.13 Da);t为反应时间/min。
1.3.4 菌种培养及形态特征鉴定
将YD01菌液划线于LB平板,28 ℃培养24 h,观察菌落形状、大小、颜色、水溶性色素等特征,进行革兰氏染色[9]。
1.3.5 菌落PCR扩增及16S rRNA测序
将YD01菌液划线于无机盐平板,28 ℃培养24 h,煮沸法提取基因组RNA。采用细菌通用引物27F和1492R PCR扩增16S rRNA。PCR扩增体系50 μL,包括ddH2O 37.5 μL,PCR Buffer(10×)5 μL,引物P1(27F)、P2(1492R)各1 μL,10 mmol/L dNTP Mix 1 μL,Taq酶(含Mg2+)0.5 μL,模板4 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性40 s,56 ℃退火40 s,72 ℃延伸90 s,30 个循环;72 ℃延伸10 min。扩增产物送交生工武汉测序部测序。测序结果提交GenBank(Accession Number:MF443454),进行BLAST比对分析,利用Clustal W和MEGA 6.05软件进行分析,Neighbor-Joinning法构建系统发育树。
1.3.6 生理生化鉴定分析
糖、醇类发酵实验,H2S实验,细菌运动性观察实验,V-P实验,加热存活实验参照文献[9],根据上述实验结果参照微杆菌属不同种的特征确定YD01的菌种[10]。
1.3.7 木聚糖酶最适pH值、最适温度测定
配制pH值分别为6.0~10.0的Na2HPO4-NaH2PO4和甘氨酸-NaOH缓冲液,将粗酶液加到相应pH值buffer,按照1.3.3节测定50 ℃酶活力。以相同方法在温度分别为40、50、60、70、80 ℃条件下测定pH 8.0的酶活力。1.3.8 木聚糖酶pH值稳定性、温度稳定性测定
将粗酶液分别加到pH值为6.0~10.0的缓冲体系中保持1 h后同法测定50 ℃酶活力,以其最适温度对应的酶活力为100%,计算相对酶活力。将粗酶液分别置于40、50、60、70、80 ℃保温1 h后,同法测定pH 8.0的酶活力,以其最适pH值对应的酶活力为100%,计算相对酶活力。
1.4 数据与图像处理
所有实验均进行3 次重复,数据以 ±s表示,应用Origin 8.5软件进行拟合分析,Excel 2007软件进行显著性分析,显著性水平选取P<0.05。
2 结果与分析
2.1 产木聚糖酶菌株的分离

图1 产酶菌株在平板上形成的透明圈Fig. 1 Transparent halos around the colonies with xylanase activity on the plate
经过3 次连续传代培养,将培养物稀释涂布无机盐平板,得到均匀、水解圈较大且透明的单菌落(图1)。
2.2 高产木聚糖酶菌株的筛选
2.2.1 初筛菌株生长情况测定结果
挑取能产生透明圈的菌株共7 株。按1.3.2节方法培养后测定酶液在波长为600 nm处的光密度(图2)。7 株中生长情况最好的1号菌株,酶活力亦为最高,命名为YD01。

图2 不同初筛菌株的24 h培养物的OD600 nmFig. 2 OD600 nm of cultures of 7 isolates after 24 h incubation.
2.2.2 复筛菌株酶活力测定结果
将YD01进行无机盐平板涂布培养后随机挑3 个单菌落,扩大培养后测酶活力(图3),酶活力最高为36.85 U/mL。

图3 复筛菌株酶活力Fig. 3 Xylanase activity of selected strains
2.3 菌株鉴定
2.3.1 YD01菌落形态
菌落呈杆状、较湿润、较光滑、较黏稠、易挑起、质地均匀、菌落正反面及中央部位的颜色一致。
2.3.2 菌株的革兰氏染色
以革兰氏阳性枯草芽孢杆菌和革兰氏阴性菌大肠杆菌为对照,对YD01进行革兰氏染色,结果为紫色(图4),表明YD01为革兰氏阳性菌。

图4 革兰氏染色(40×10)Fig. 4 Gram staining (40 × 10)
2.3.3 PCR产物琼脂糖凝胶电泳检测及16S rRNA系统进化树
PCR扩增16S rRNA基因,电泳检测基因序列长度约1 433 bp(图5)。

图5 YD01的16S rRNA PCR产物电泳图Fig. 5 Electrophoresis of 16S rRNA PCR products amplified from strain YD01
PCR产物经过凝胶电泳回收后送生工测序,经BLAST同源分析并构建系统发育树(图6),它显示了YD01菌和微杆菌属其他种菌株之间的系统发育关系。根据同源性远近,结合系统发育树、菌落形态、颜色及革兰氏染色结果确定菌属,该菌为微杆菌属(Microbacterium)。

图6 菌株YD01的16S rRNA基因序列系统发育树(Bootstrap value 1 000)Fig. 6 Phylogenetic tree based on 16S rRNA gene sequence of strain YD01
2.3.4 生理生化鉴定

表1 菌株YD01的生理生化特征Table 1 Physiological and biochemical characteristics of strain YD01
如表1所示,菌株YD01的葡萄糖、L-阿拉伯糖、D-木糖、蔗糖发酵实验结果均为阳性;H2S实验阳性,V-P实验阴性;37 ℃加热能存活;能运动。
2.4 木聚糖酶最适pH值和最适温度分析

图7 木聚糖酶最适pH值(A)与最适温度(B)Fig. 7 Optimum pH (A) and optimum temperature (B) for the xylanase
如图7所示,木聚糖酶最适作用pH值为8.0,最适作用温度为50 ℃。pH 10和80 ℃时,仍有87%和85%的剩余酶活力。
2.5 木聚糖酶pH值稳定性与温度稳定性分析
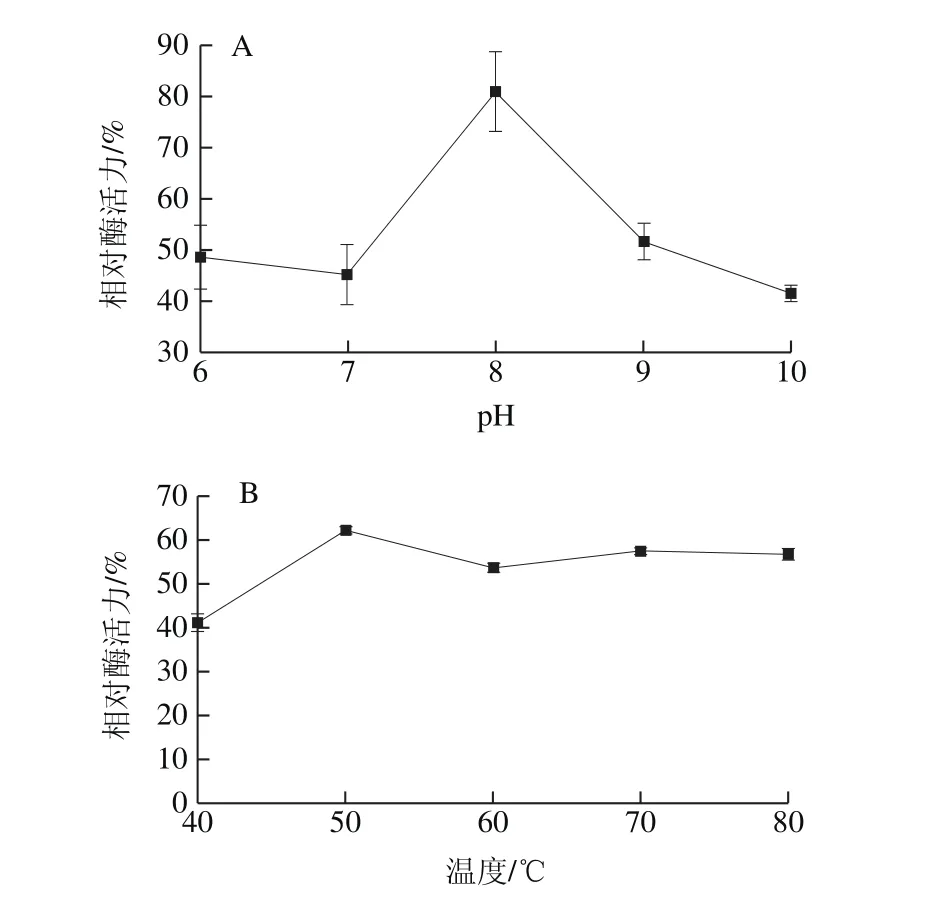
图8 木聚糖酶pH值稳定性(A)与温度稳定性(B)Fig. 8 pH stability (A) and temperature stability (B) for the xylanase
如图8所示,不同pH值保持1 h后的木聚糖酶在最适pH 8.0时有80.83%的相对酶活力,在pH 10时仍有41.43%的相对酶活力。保温1 h后的木聚糖酶在最适作用温度50 ℃时有62.33%的相对酶活力,在80℃时仍有56.82%的相对酶活力,表明YD01所产木聚糖酶具备较好的耐碱性和耐高温能力。
3 讨 论
经革兰氏染色、16S rRNA序列分析,确定YD01为微杆菌属。生理生化结果则为葡萄糖、L-阿拉伯糖、D-木糖、蔗糖发酵阳性;产H2S阳性,V-P实验阴性;37 ℃加热能存活,能运动;文献[10]表明微杆菌属仅有31 种,而高艳秀等[11]研究结果报道微杆菌属共有34 个种,另外3 个种分别为M. paraoxydans、M. aerolatum、M. gubbeenense,因M. paraoxydans产H2S阴性[12],M. aerolatum不能利用L-阿拉伯糖[13],M. gubbeenense不能利用L-阿拉伯糖、D-木糖、蔗糖产酸[14],不同于本研究的菌株YD01生理生化特征。通过BLAST程序比对后,显示同源性较高的菌株中并无M.imperial,而同源性高的M. trichothecerolyticum则在37 ℃下不能存活、不能利用阿拉伯糖、不能运动,M. hominis则不能利用木糖、不能运动,与生理生化特征鉴定结果相悖。可见16S rRNA序列同源性分析结果与生理生化鉴定结果存在部分差异,尚不能十分准确地将YD01菌鉴定至种,于是本研究结合生理生化实验结果,确定该菌株为微杆菌属蛾微杆菌M. imperiale。
我国食品添加剂使用卫生标准规定,可用于面粉面食的酶制剂有淀粉酶、葡萄糖氧化酶、木聚糖酶、谷氨酰胺转氨酶等[15]。实验证明,在面粉中添加木聚糖酶,能使不溶性阿拉伯木聚糖增溶,改进面团的机械强度和增加面包的体积,改进面包的色泽。我国成功研发了内切木聚糖酶,它可以使阿拉伯木聚糖水解成为水溶性的寡糖,其水解率达65%,产生以木二糖、木三糖为主的低聚糖混合物。这种低聚木糖甜味纯正,耐高温不分解,pH值稳定性好,有利于双歧杆菌增殖,对改善肠道功能增进健康有明显效果。假如面粉中阿拉伯木聚糖为2%,其中有1.5%的不溶性阿拉伯木聚糖,经内切木聚糖酶水解50%,则有0.75%的低聚木糖。即每100 g的面食中,就有0.75 g的低聚木糖,这正好是摄入的有效剂量。这样就做到了以主食为载体的低聚木糖功能食品。Chapla等[16]使用来自臭曲霉MTCC 4898的部分纯化的木聚糖酶进行选择性生产低聚木糖。在45 ℃下用20 U木聚糖酶的反应8 h后,木寡糖的最大产量为(6.73±0.23) mg/mL。Rajagopalan等[17]利用梭菌BOH3纯化的木聚糖酶从碱预处理的红木和芒果木屑中生产益生元-低聚木糖。Nieto-Domínguez等[18]研究了新型真菌GH11木聚糖酶对桦木木聚糖制备的低聚木糖的益生元效应,通过分析母乳喂养儿童粪便发酵中微生物组成和有机酸分布的变化,即乙酸和乳酸的骤增,潜在致病菌的减少和双歧杆菌的增加,以及可能的有益共生物,证实了这些低聚木糖的益生元价值。Jagtap等[19]使用来自农业废弃物的粗微生物酶生产低聚木糖,无需预处理,在12 h后获得1%的低聚木糖并且可能作为营养保健品应用。木聚糖酶在众多领域充分显示了它广阔的应用前景,但由于存在着经济性、稳定性、使用效率等各方面的问题,木聚糖酶大规模投入工业应用还有待努力。目前国内外很多研究团队筛选到一些产酶微生物。包怡红等[20]以木聚糖为唯一碳源,从富含半纤维素的土壤生境采样,分离、纯化、酶活测定后,经16S rRNA鉴定其为类芽孢杆菌,最适pH值为5,最适温度为50 ℃;梁芳芳等[21]经富集培养与透明平板筛选的方法得到透明圈最大的木聚糖酶产生菌X7,经鉴定其为枯草芽孢杆菌,最适pH值为6,最适温度为55 ℃;腾超等[22]从土样中筛选得到高产木聚糖酶霉菌,经菌体形态观察、菌落培养特征与18S rRNA序列同源性比对等分析,鉴定该菌为嗜热踝节菌;李里特等[23]以木聚糖为唯一碳源筛选出1 株木聚糖酶高产菌株,经菌落特征、生理生化特征和细胞壁化学组分分析等试验鉴定该菌为卷须链霉菌,最适pH值为6.0;He Haiyan等[24]利用甘蔗渣为底物培养米曲霉HML366所产木聚糖酶的最适温度为65 ℃,最适pH值为6.0;Mander等[25]以麦麸为底物培养链霉菌属CS624所产木聚糖酶最适温度为60 ℃,最适pH值为6.0;Walia等[26]发现纤维化纤维微细菌所产木聚糖酶最适温度为55 ℃,最适pH值为8.0。Wu He等[27]以甘蔗渣半纤维素为碳源,通过灰色链霉菌LH-3产生的胞外热稳定木聚糖酶进行纯化和酶学性质研究,最适pH值为5.0,最适温度60 ℃时表现出最大的活性。
但这些菌株所产的木聚糖酶仍然存在缺陷,不能大规模应用于生产。要着力研发耐酸碱性、热稳定性好的木聚糖酶。本次鉴定出产碱性木聚糖酶细菌——蛾微杆菌M. imperiale,还鲜见报道,菌株YD01所产木聚糖酶的最适pH值为8.0,最适温度为50 ℃;在pH 10时,仍有87%剩余酶活力,在80 ℃时,亦可达85%剩余酶活力,具有较好的耐碱性及热稳定性,有运用到工业生产的潜力。
对木聚糖酶基因进行定点突变和固定化等方法来改善木聚糖酶学性质,使木聚糖酶的酶学性质满足应用需求[2]。Li Fei等[28]对来自黑曲霉的木聚糖酶基因进行碱性pH值定点突变改造,突变体XynB-117,与野生型酶相比,提高了相当于初始的0.5 个pH值单位。Ribeiro等[29]将木聚糖酶插入到木糖结合蛋白中,发现有木糖存在时,酶活性提高了20%,原始的酶活性则被抑制。李同彪等[30]通过在黑曲霉木聚糖酶Xyn ZF-2α-螺旋催化活性中心位点处引入疏水性氨基酸,从而使酶的热稳定性大幅提高。Wickramasinghe等[31]通过对从局部分离的木霉属物种克隆EXNI基因进行克隆和异源胞外表达,从而基因修饰树干毕赤酵母菌(Pichia stipitis),将木聚糖水解成木寡糖。使用pGAPZα表达载体将树干毕赤酵母工程化以携带Trichoderma virens的EXNI基因。本研究有助于挖掘我国碱性木聚糖酶细菌资源,为进一步构建工程菌提高木聚糖酶表达水平以及利用定点突变技术改善酶学性质提供依据。
4 结 论
以木聚糖为唯一碳源,从造纸厂活性污泥中筛选1 株高产碱性木聚糖酶细菌,经形态学,生理、生化特征以及序列分析鉴定为微杆菌属蛾微杆菌(M. imperiale)。酶学性质表明,该菌株所产木聚糖酶的最适pH值为8.0,最适温度为50 ℃;在pH 10时,仍有87%剩余酶活力,在80 ℃时,亦可达85%剩余酶活力,具有较好的碱耐受性及热稳定性,最终发酵产酶水平为36.85 U/mL。
