黄曲霉毒素B1降解菌株的筛选及鉴定研究
2018-10-31于丽娜王明清张初署徐念均赵玉华毕洁孙杰龚魁杰刘开昌杨庆利
于丽娜,王明清,*,张初署,徐念均,赵玉华,毕洁,孙杰,*,龚魁杰,刘开昌,杨庆利
(1.山东省花生研究所,山东青岛266100;2.西海岸现代农业示范区管委会,山东青岛266000;3.胶南市种子公司,山东青岛266000;4.山东省农业科学院作物研究所,山东济南250000;5.青岛农业大学,山东青岛266109)
黄曲霉毒素(aflatoxin,AF)主要是黄曲霉(Aspergillus flavus)和寄生曲霉(Aspergillus parasiticus)等曲霉产生的一类代谢产物,广泛存在于花生、玉米、谷类等农产品和食品中[1]。黄曲霉毒素是天然存在的剧毒物质,具有致突变、致畸性、强致癌性,1993年被世界卫生组织的癌症研究机构列为IA类致癌物质[2]。黄曲霉毒素的基本结构为香豆素和二呋喃环,目前已发现20多种,如黄曲霉毒素B1(AFB1)、黄曲霉毒素B2(AFB2)、黄曲霉毒素G1(AFG1)、黄曲霉毒素G2(AFG2)等,其中AFB1是二氢呋喃氧杂萘邻酮的衍生物,其毒性和致癌性最强,AFB1毒性是氰化钾100倍,致癌性比二甲基亚硝胺强75倍[3-4]。
目前对AFB1的降解方法主要有物理法、化学法和生物法。常用的物理法包括吸附法、辐射法和萃取法等[5],化学法包括氨水等碱处理法、次氯酸钠等氧化剂处理法[6]。物理法和化学法去除AFB1存在成本高、操作复杂、造成营养损失、影响食品品质等问题,而生物法具有专一性高、效率高、不破坏食品的优点,是黄曲霉毒素去除的热点之一。目前国内外研究人员发现某些细菌可以有效去除AFB1,如橙色黄杆菌(Flavobacterium aurantiacum)[7]、分支杆菌(Mycobacterium fluoranthenivorans)[8]、红串红球菌(Rhodococcus erythropolis)[9]、嗜麦芽窄食单胞菌(Stenotrophomonas maltophilia)[10]、施氏假单胞菌(Pseudomonas stutzeri)[11]等菌株。目前大部分降解菌株从陆地或动物粪便等来源中分离,从海洋中分离降解AFB1的研究较少。本研究从青岛沿海的海水中分离纯化能降解AFB1的菌株,丰富降解微生物种类,为AFB1的生物脱毒提供菌株资源。
1 材料与方法
1.1 材料
海水样品采自青岛沿海。AFB1标准品:以色列Fermentek公司;香豆素:上海融禾医药科技发展有限公司;色谱级甲醇:德国Merck公司;黄曲霉毒素免疫亲和柱:华安麦科公司;Super GelRed荧光染色试剂:US Everbright Inc;pMD19-T载体:宝生物工程(大连)有限公司。
初筛培养基为香豆素液体筛选培养基[12](g/L):0.25 g KH2PO4,0.25 g MgSO4·7H2O,0.5 g KNO3,0.5 g(NH4)2SO4,0.005 g CaCl2,0.003 g FeCl3·6H2O,1.0 g 香豆素,pH 7.0,121℃高压灭菌20 min。香豆素固体筛选培养基:在液体培养基的基础上加入15 g/L琼脂。复筛培养基(g/L):10 g蛋白胨,3 g牛肉膏,10 g NaCl,1 g KH2PO4,1 g葡萄糖,pH7.0,121℃高压灭菌 15 min。LB(Luria-Bertani)液体培养基(g/L):10 g胰蛋白胨,5 g酵母提取物,10 g NaCl,pH7.0,121 ℃高压灭菌 20 min。LB固体培养基:LB液体培养基中加入15 g/L琼脂。
1.2 方法
1.2.1 降解AFB1菌株的初筛
采集的海水按1/1 000接种量接种到初筛培养基,以香豆素为唯一碳源进行AFB1降解菌株的初筛,100 r/min 37℃振荡培养15天~25天。观察菌株的生长情况,当培养基出现浑浊后在初筛的固体培养基涂布,在37℃培养箱中培养。观察细菌生长情况,根据菌落形态等挑取单菌落,在LB固体培养基上多次划线纯化培养。纯化的菌株培养后,加入20%甘油,-20℃冰箱保存。
1.2.2 降解AFB1菌株的复筛
初筛菌株接种于复筛培养基,37℃培养48 h。避光条件下,980 μL 发酵菌液加入 20 μL 5 mg/kg 的AFB1标准品,使发酵液中AFB1终浓度为100 μg/kg,无菌复筛培养基作为空白对照,37℃避光孵育72 h。
1.3 AFB1检测方法[13]
8 000 r/min离心20 min分离发酵液,上清液经0.22 μm滤膜过滤后过免疫亲和柱,先用超纯水洗两遍,然后用色谱级甲醇洗脱,收集洗脱液。采用高效液相色谱(high performance liquid chromatography,HPLC)检测溶液中AFB1的含量,HPLC检测条件为:Agilent 1260高效液相色谱仪,C-18色谱柱(4.6 mm×15 cm×5 μm),进样量为 20 μL,流动相为甲醇∶水=1∶1(体积比),流速0.8 mL/min,荧光检测器激发波长为360 nm,发射波长为440 nm。利用以下公式计算菌株对AFB1的降解率。
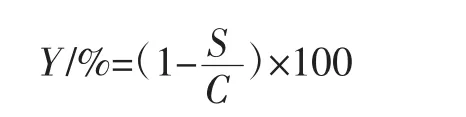
式中:C代表空白对照样品AFB1的峰面积;S代表发酵菌液处理样品中残留AFB1的峰面积;Y代表AFB1降解率。
1.4 菌株M8各组分降解特征研究
10 mL的菌株M8发酵液,4℃条件下8 000 r/min离心10 min,分离得到上清液和菌体。菌体用无菌蒸馏水洗涤、离心,重复3次后加入10 mL无菌蒸馏水制备成M8菌悬液。按上述方法制备10 mL菌悬液,然后在冰上超声破碎20 min后离心,收集的液体经0.22 μm滤膜过滤制备M8的胞内液。将M8上清液、菌悬液、胞内液加入AFB1,在37℃孵育72 h后,检测各组分AFB1降解率。
1.5 菌株的鉴定
1.5.1 表型分析
菌株M8在LB固体培养基平板上37℃培养48 h后观察菌落形态、色泽。
1.5.2 生理生化性质分析
观察菌株M8革兰氏染色反应,以及其能利用的碳源,其温度耐受、盐度耐受等试验[14],氧化酶试验:用1%四甲基对苯二胺二盐酸盐溶液浸湿滤纸,挑取新鲜的菌株A12点在滤纸上,在10 s内呈现紫色的为阳性。
1.5.3 细菌16S rRNA基因序列测定
菌株M8接种到LB液体培养基,37℃振荡培养24 h后,采用细菌基因组提取试剂盒提取细菌基因组DNA。采用的细菌16S rRNA基因通用引物为P1:5’-AGAGTTTGATCCTGGCTCAG-3’,P2:5’-GGTTACCTTGTTACGACTT-3’[15]。 PCR 的反应体系 25 μL:Taq buffer 2.5 μL,dNTPs 2 μL,Taq聚合酶 0.1 μL,引物 P1和P2 各 1 μL,M8 菌株基因组模板0.5 μL,ddH2O 17.9 μL。PCR扩增程序:95℃预变性8 min;95℃变性35 s,55 ℃退火 35 s,72℃延伸 80 s,28个循环;72℃延伸8 min。反应结束后,5 μL PCR产物上样于1%琼脂糖凝胶,90 V电压电泳25 min后经凝胶成像系统检测结果,PCR产物送到上海生工生物有限公司测序。测序得到的序列提交到NCBI进行BLAST分析,将目标序列与搜索到的同源序列经ClustalW分析后,再用MEGA6软件构建系统进化树。
2 结果与分析
2.1 菌株筛选
以香豆素为唯一碳源进行初筛,然后以加入AFB1的培养基进行复筛,各菌株降解AFB1的能力见图1。

图1 各菌株降解AFB1的能力Fig.1 The degradation of AFB1in each strain
筛选到多株能降解AFB1的菌株,其中效率最高的菌株编号为M8,孵育72 h能降解71.8%的AFB1(图1)。下面以菌M8为对象进行研究,分析菌株M8的降解特征并对其进行鉴定。
2.2 菌株M8降解特性
图2为菌株M8各组分降解AFB1特性。
比较菌株M8的上清液、菌悬液、胞内液降解AFB1的能力,发现上清液降解能力最强,达到71.8%,菌悬液和胞内液相对较弱,分别为10.2%和6.4%。由此判断,菌株M8降解AFB1不是依赖细菌胞体的吸附作用,而是细菌代谢产生并分泌至胞外的活性物质主导的生物降解作用。
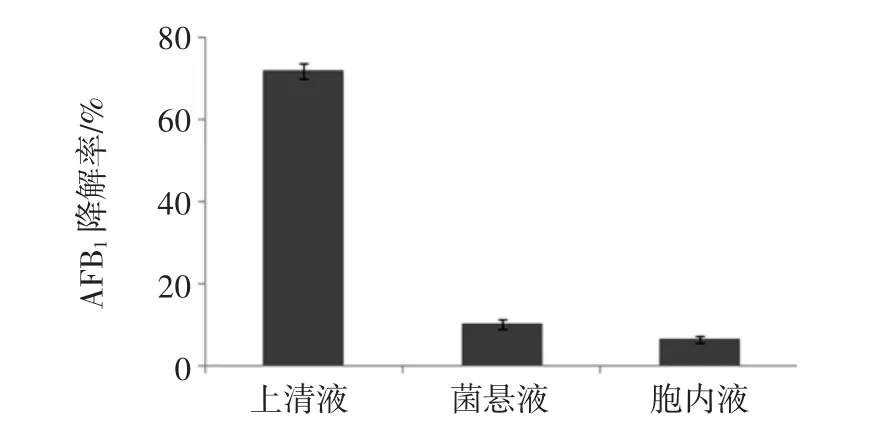
图2 菌株M8各组分降解AFB1特性Fig.2 Degradation of AFB1in each component of strain M8
2.3 菌种鉴定
2.3.1 菌株M8形态学特征
菌株M8的菌落形态见图3。
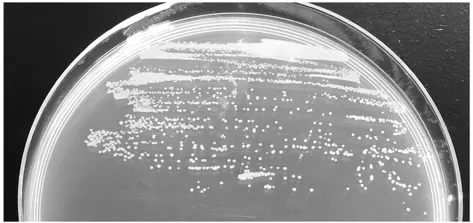
图3 菌株M8的菌落形态Fig.3 The colony morphology of strain M8
由图3菌株M8的菌落形态可以看出,菌株M8在LB培养基上单菌落呈现圆形,淡黄色,不透明,2 mm~3 mm直径。
2.3.2 菌株M8生理生化特征
菌株M8的革兰氏染色呈阴性,能利用吐温20、吐温80、甘露糖、葡萄糖、阿拉伯糖等碳源,具有氧化酶活性,能耐受6%的盐度,能在4℃~40℃范围内生长(表1)。

表1 菌株M8的生理生化特征Table1 Physiological and biochemical characteristics of stain M8
2.3.3 菌株M8的16S rRNA基因鉴定
菌株M8的16S rRNA基因PCR产物的琼脂糖凝胶电泳图见图4,菌株M8的16S rRNA基因的系统发育树见图5。
以16S rRNA基因特异性引物进行PCR扩增,在1 000 bp~2 000 bp之间获得一条特异性的扩增条带,且条带清晰亮度好(图4)。经测序得到16S rRNA基因长度为1 498 bp,与已经公布的序列比对分析,发现菌株M8与假单胞菌属(Pseudomonas)的菌株处于同一大的分支,其中与菌株PseudomonaskoreensisPs9-13T[16]的进化距离最近,相似度超过99%(图5)。结合形态、生理生化和16S rRNA基因分析结果鉴定菌株M8为假单胞菌属,命名为Pseudomonas sp.M8。

图4 菌株M8的16S rRNA基因PCR产物的琼脂糖凝胶电泳图Fig.4 Electrophoresis profile of 16S rRNA gene from srain M8 by PCR

图5 菌株M8的16S rRNA基因的系统发育树Fig.5 Phylogenetic tree of strain M8 based on 16S rRNA gene sequences
3 讨论与结论
有关AFB1降解菌的筛选已有较多报道,大部分研究是从陆地土壤和动物粪便等样品中分离降解菌株。海洋中细菌种类繁多、代谢产物丰富多样并且不同于陆地生物,从海洋样品中分离能降解AFB1的菌株,将丰富降解AFB1的菌种资源。本研究从海水中分离到多株能降解AFB1的菌株,其中菌株M8的降解率较高,进一步分析了M8各个组分的降解特征,发现细菌分泌的活性物质降解AFB1。前期研究发现有的菌种脱除AFB1的机理是吸附作用,如有的乳酸菌和酵母等菌株通过菌体吸附作用吸附毒素形式菌体-AFB1复合物,但是该复合物是可逆的,当环境发生变化AFB1可能会再次释放到机体中,因而这种毒素的去除是可逆的[17-18]。本研究分离菌株M8的AFB1去除不是吸附作用,在后续分离纯化AFB1的胞外活性物质时,排除了细胞菌体和胞内产物对生物工程下游处理带来的不便和复杂程序。
本研究从海水样品中筛选出的菌株M8能高效降解AFB1,进一步研究发现起降解的活性物质主要位于细菌胞外液。根据细菌生物形态学观察、生理生化特征以及16S rRNA基因分析鉴定菌株M8为假单胞菌,命名为Pseudomonas sp.M8。这些研究结果为进一步深入研究该菌的降解机理及应用于AFB1脱毒奠定了基础。
