传统超声与超声二维斑点追踪技术对小鼠心肌梗死模型评价的比较
2018-10-30严国锋肖忠标朱寅秋
卢 今, 严国锋, 周 晶, 肖忠标, 朱寅秋, 朱 莲, 汪 静, 李 垚, 左 勇
(上海交通大学医学院, 上海 200025)
心肌梗死(myocardial infarction, MI)是缺血性心脏病的主要病因之一。临床上以冠状动脉粥样硬化为诱因占到MI病例的绝大多数[1]。该病致病率及致死率高、预后差,且至今尚未完全解决其病理机制[2]。实验人员常使用小鼠制作MI手术模型用以模拟人类MI疾病过程。模型小鼠同样具有心肌缺血、再灌注以及心室重构的病程变化[1]。
使用一种非创伤性,并且对小鼠影响较小的检测手段动态观察小鼠心功能情况是非常必要的[3]。高分辨率小动物超声成像因其相对较小的投入以及对小鼠产生相对轻微的影响,成为评价小鼠MI模型的主要手段。然而, 传统超声心动图沿用临床方法, 通过左室射血分数(EF%)和左室缩短分数(FS%)评估小鼠心功能情况,在模型分析方面存在局限性[4]。由于小鼠的个体差异、品系差异、MI面积大小以及麻醉深度不同等原因, 传统超声在敏感性、精确定位发生病变心肌部位的准确性和及时反映病程变化的时效性方面都尚有诸多局限[5]。
超声二维斑点追踪(speckle tracking imaging,STI)技术通过对心肌各节段运动的追踪,可提供心肌各节段的运动特性以及心肌本身的力学性质,为判断MI小鼠的病程变化和发生梗死部位心肌的组织性质提供了方便[6]。然而,STI技术在小动物心脏疾病模型方面的应用和研究报道仍然较少,本研究拟将STI技术应用于小鼠MI模型,为定位、定量和定性小鼠MI情况提供依据。
1 材料与方法
1.1 实验动物及分组
清洁级10周龄雄性C57BL/6小鼠20只,购自上海斯莱克实验动物有限公司[SCXK(沪)2012-0002]。饲养于上海交通大学医学院实验动物科学部[SYXK(沪)2013-0050]屏障环境内至16周龄,体质量为(25±5) g后用于实验。将小鼠随机分为对照组(Sham组)和MI模型组(MI组)后准备手术。该设施通过国际实验动物评估和认可管理委员会(AAALAC)认证。该实验设计按照动物实验指南要求实施[7]。
1.2 主要仪器和设备
小动物高频超声成像仪(Vevo 2100)购自加拿大Visualsonic Inc公司, 电敏加热板(PhysioSuite)购自美国Kent Scientific公司, 麻醉机(小动物专用, 0828)购自美国Vet Equip公司,显微镜(BX60)购自日本Olympus公司。
1.3 麻醉方法
将待手术小鼠置于密封麻醉箱中,使用体积分数3%异氟烷(0.2 L/min氧气)诱导麻醉。随后将小鼠转移至加热板上,四肢涂上导电胶粘贴在电极上,并接上口鼻麻醉管,维持麻醉[体积分数2%~2.5%异氟烷(0.2 L/min氧气)]。冠状动脉结扎手术于极短时间内完成。手术完成后撤下口鼻管,小鼠于3 min内苏醒。术后小鼠注意保温。
1.4 手术方法
手术由超过10年经验术者完成。
小鼠左胸处常规备皮后, 剪开皮肤, 在第2~4肋间,胸骨左缘做一纵向切口,用3-0丝线在皮肤上做荷包缝合暂不闭合。避开肋间动脉后,分离胸大肌与胸小肌,暴露肋间肌后钝性分离上下两侧肋骨,用力挤出心脏。在左心耳下缘1.5 mm处采用6-0尼龙线结扎冠状动脉左前降支,结扎宽度约1 mm。结扎完成后,将心脏回纳入胸腔,迅速挤出胸腔内空气,抽紧荷包线闭合皮肤,关闭胸腔。Sham组采用相同方式麻醉并开闭胸腔,但不进行冠状动脉结扎。
1.5 超声图像采集
相同麻醉条件下,将小鼠按仰卧位固定于加热板上, 四肢接触点涂抹导电胶。胸部使用脱毛膏完全脱毛, 注意使毛发全部脱完,并防止脱毛膏烧伤皮肤。使用小动物高频超声成像仪配合MS-400探头采集小鼠心脏数据。超声频率为30 MHz,帧频235,增益27 dB,焦距深度3~11 mm。超声采集时采用胸骨旁长轴位, 调整探头, 找到左心室最大腔径处,采集左心室长轴图像,后期做STI分析。切换到M型超声,切线位置取心室乳头肌后缘, 垂直于心肌前后壁, 记录此处的心肌运动图像。90°顺时针旋转探头,出现左室短轴图像后,略微调整探头角度,用M型超声获得该切面最大直径处的前后壁厚度以及收缩末、舒张末直径。
1.6 传统超声数据分析
在左室长轴M型超声图像上,选取3个排除呼吸影响的心搏周期,通过测量其左室收缩末内径(LVID:s)和左室舒张末内径(LVID:d)得出心功能代表参数: 左室射血分数(EF%)、左室缩短分数(FS%)、左室搏出量(SV)和心输出量(CO)。
计算公式如下:

CO=SV×HR/1000, 其中LV Vol: d为左室舒张容积, LV Vol:s为左室收缩容积, HR为心率。
1.7 STI数据分析
进入vevostrain软件模块,结合心电图波迹,选取3个有效心动周期。随后,在二维图像上描画出左心室内膜轮廓,描绘线应起始并结束于左心室心基处,心尖位置为最远端。软件根据描绘线及二维斑点技术自动追踪左心室在收缩舒张过程中的运动轨迹。计算心肌各点在长轴和短轴上的运动速度(velocity)、位移(displacement)、应变(strain)以及应变率(strain rate)。将各参数的变化过程,按时间轴为x轴,参数值为y轴,拟合为一个心动周期中左室心肌各点在长轴和短轴上的变化形态。观察者通过拟合图直观了解心肌活动的顺应性及心肌本身的力学属性。
通过软件将左心室分为6个区域, 分别为: 前壁心尖位置(ant apex)、后壁心尖位置(post apex)、前壁心基位置(ant base)、后壁心基位置(post base)、前壁中间位置(ant mid)以及后壁中间位置(post mid)。分别计算得出各区域内心肌运动速度、位移、应变和应变率数值,并给出各区域心肌达到以上数值最大所花的时间(time to peak: TPK)。
1.8 取材和处理
在MI手术后7 d,将小鼠置于CO2气体气密盒内处死,迅速剪开胸腔和腹腔,下腔静脉撕开一小口,从腹主动脉入针灌注10 mL生理盐水以及10 mL质量分数 4%多聚甲醛(PFA),灌注完成后取下完整心脏,置于PFA中固定。固定完全后进行石蜡包埋。石蜡块经3 μm切片,并固定于粘附载玻片上。平行于心脏短轴切片,于乳头肌上方、乳头肌处、乳头肌下方及心尖部各取一张玻片待染色。再取另一只小鼠心脏按心脏长轴切片连续纵切,挑选左心室最大腔径处留取一张玻片待染色。MI组与Sham组切片都经苏木素-伊红(HE)染色后拍照观察。拍照采用Olympus BX60显微镜在20倍镜下进行图像采集, 并通过Neurolucida 5.65 (MBF Bioscience MicroBrightField, Inc.)软件拼接图像。
1.9 统计分析
实验结果均以表示,利用minitab 17.1.0(Six Sigma Academy Module)软件进行统计分析。差异显著性采用双样本非配对t检验,P<0.05为差异有统计学意义。
1.10 图像绘制
将长轴与短轴上的心肌运动速度、位移、应变和应变率统计数据分别求出矢量和后,运用R version 3.4.1(The R Foundation)软件将数据结果绘制成曲线雷达图。
2 结果
2.1 心电图
胸腔关闭手术后,心电图在短暂紊乱波形后,出现ST段抬高波形(图1,红色箭头位置)并维持,表明MI模型成功。
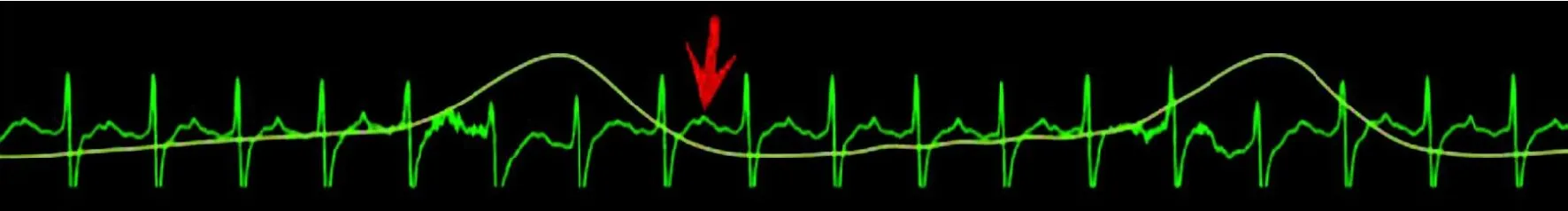
图1 冠状动脉结扎后心电图
2.2 病理学观察
图2A为Sham组小鼠心脏短轴切面。MI手术模型组心肌逐层坏死(图2B~D)。心脏前壁处,不仅结扎位置及下方区域心肌坏死、变薄,术部上方也有部分心肌坏死并被组织间质取代。Sham组小鼠和MI小鼠心脏长轴切面如图2E、2F所示。MI小鼠,除左心室前壁外,心室后壁处也出现心肌坏死的情况,坏死区域蔓延到左心室右心室交界点(图2F,*所示)。靠近心室内部仍有少量心肌细胞层存活。 外侧心肌多被组织间质取代,间质细胞核大量增多,推测坏死部可能被炎性细胞侵润。
2.3 传统超声结果
在小鼠左心室乳头肌后缘放置一条垂直于心室壁的M型超声切线(图3)。MI组EF% 与FS%值都较Sham组降低(图3, 表2)。 MI组的左室收缩内径(LVIDs)较Sham组略有扩张, 其余指标变化无统计学意义。当MI发生于预定切线之后方时, 超声获得的EF%值与FS%值仍处于正常范围, 而该鼠病理结果与超声直观观察心肌坏死情况匹配, 即心尖部与心脏中部心肌都发生了严重坏死(图3红色箭头位置)。
2.4 STI结果
2.4.1 直观分析 在左室舒张阶段,Sham组心肌运动速度均匀,方向均朝向心外膜,而MI小鼠心尖及心室后壁心肌反向运动明显,心基前壁代偿性运动幅度增加(图4A)。此外,Sham组心肌跟随心电活动变化而运动,从QRS波段(心室除极)开始,心基至心尖心肌依次进行舒张运动; 从T波中段(心室复极)开始,心基至心尖心肌依次进行收缩运动。在MI小鼠,心肌不追随心电活动进行运动,舒张与收缩心肌交错出现(图4B)。
2.4.2 区域性应变力和应变率分析 图5显示Sham组与MI组6个心肌区域到达最大应变与最大应变率分别消耗的时间。Sham组小鼠心肌在长轴方向上,各部分心肌做较为均匀的压缩运动,而MI组小鼠最大应变力下降,为Sham组的三分之一左右,TPK延后,并且前、后壁的心基部与心脏中部均存在先舒张后压缩的反向运动(图5A)。Sham组小鼠各部心肌应变率也较为均匀,反应速度较为一致,到达TPK集中在心电除极(ST段)与复极(T段)时间点。同样,MI组小鼠最大应变率也为Sham组的一半左右,除前壁心基部、前壁中部和后壁心基部外,其余部位的应变率TPK均有明显延后(图5B),说明受MI影响部位心肌受到心电刺激与周围作用力时反应速度较差。
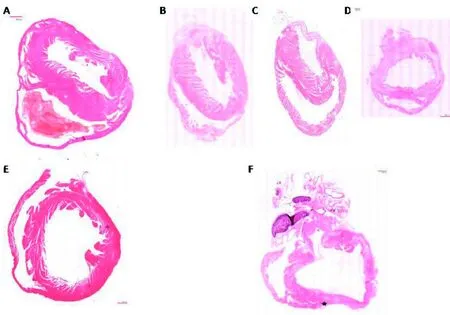
图2 小鼠心脏组织病理学观察(HE染色×20)
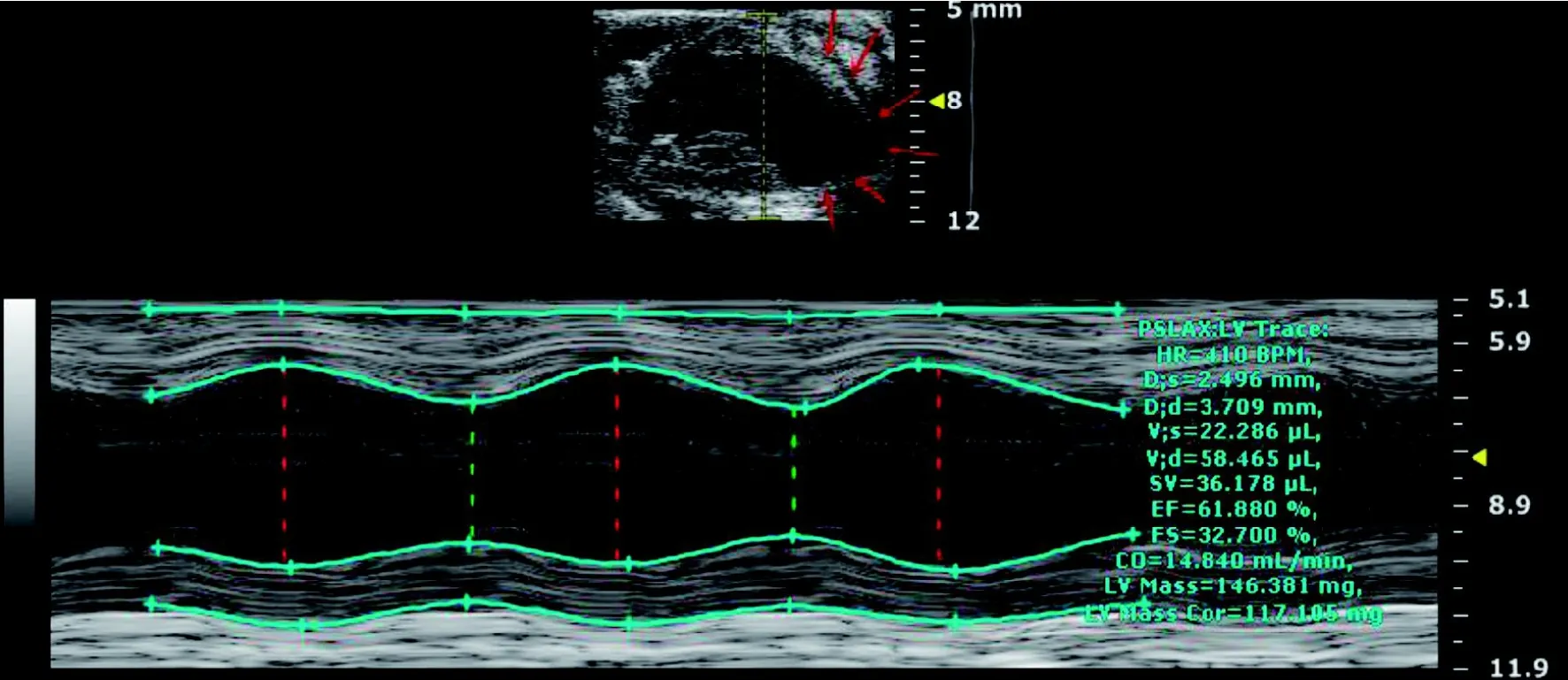
图3 MI小鼠M型超声图
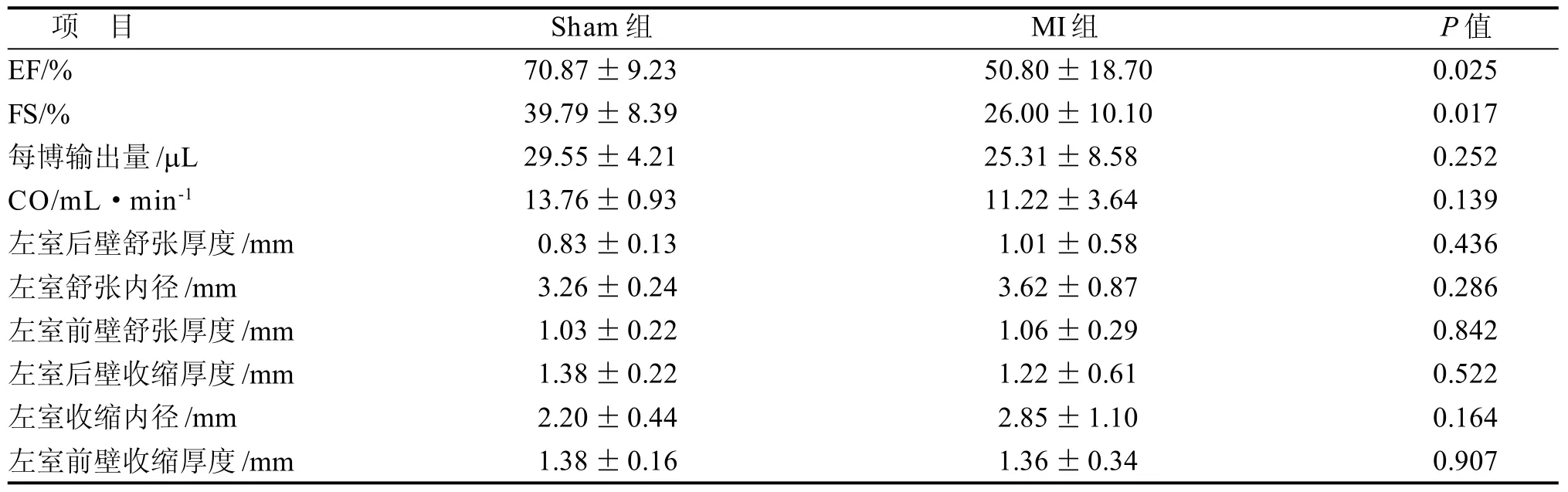
表 2 小鼠心功能指标和心脏厚度对比
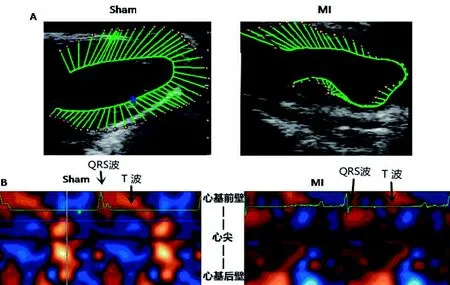
图4 心肌运动直观图
2.4.3 二维拟合分析 Sham组小鼠心肌运动速度均一,心基部略高于心尖部,前后壁心肌运动速度一致,而MI组小鼠心肌,尤其是心尖位置的运动速度明显降低,前壁心基部运动速度明显高于其余各部(图6A)。Sham组小鼠心肌的位移能力除前壁心基部和前壁中部较高外,其余各部位移均较为平均,而MI组小鼠表现出心尖位移小于心基部位移的形态(图6B)。Sham组小鼠心肌应变力在心脏中部最大,其次为前壁心基部,MI组除后壁心基部以外,应变力均有明显降低(图6C)。心肌应变率方面(图6D),Sham组小鼠的前壁心基部、心室中部以及后壁心尖部最高,其余部位应变率低于以上三个部位,MI组小鼠心肌应变率显著降低,且心室各部应变率较为均匀。

图5 对照组小鼠和MI小鼠心肌应变力和应变率的对比
3 讨论
高频小动物超声成像已成为对实验动物各类心血管模型评估的主要手段,其中包括了心肌缺血与梗死模型、心力衰竭模型、动脉粥样硬化模型和周围血管疾病动物模型等[3,8-10]。在小鼠MI模型方面,运用传统M型超声能够观测FS%、EF%、SV、心室壁厚度以及舒张末直径等,其中FS%与EF%一直是评价小鼠心功能以及造模后小鼠MI情况的主要指标[3,8,11,12]。本实验结果显示,MI组的FS%与EF%相对于Sham组均显著降低,与相关研究结果相似[3,11]。然而以上2项指标并不能作为判断小鼠MI以及左室心功能的决定性标准,主要有以下原因: 其一, M型超声得出的数据值较依赖M切迹放置的位置,即切线必须放置在心脏中部乳头肌后缘处,对于MI小鼠,M切迹放置稍有变化就会影响小鼠EF%与FS%,当MI发生位置较靠心尖而中部心肌仍能保持Sham组运动时,超声得出的数值不能完全反映小鼠MI情况。甚至,在MI发展中期,为维持SV和CO,中部心肌可能会代偿性增加运动功能, 从而导致EF%与FS%升高。随着心室重构,MI后期的EF%与FS%也会高于MI中期的EF%与FS%。此外,数据采集过程中,小鼠心功能指标会受到麻醉深度的影响[13],尚无证据表明,相同浓度异氟烷气体能够使Sham组小鼠与MI小鼠处于同一麻醉深度下,MI小鼠心功能受到麻醉气体的影响可能高于Sham组小鼠。由于Sham组与MI组测得的EF%与FS%的标准误差均较大,提示小鼠心功能存在个体差异。因此,利用其他方法作为传统超声EF%与FS%的补充,评估小鼠MI情况以及严重程度是非常必要的。
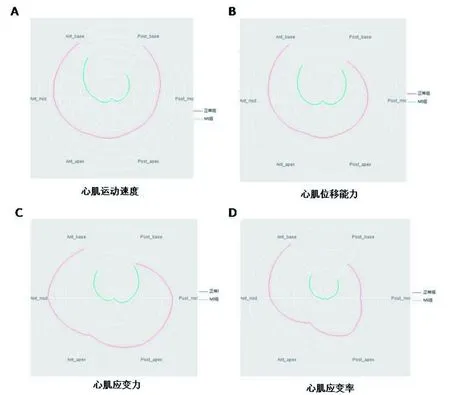
图6 MI小鼠心肌各参数模拟图
临床上,STI技术被用来评估传统超声不能反映的细微性心肌病变,从而能够对扩张性心肌病和缺血性心肌病作出早期判断[14-17]。在实验动物方面,超高频超声通过对二维灰阶超声图像上斑点运动轨迹的追踪,模拟合成了心肌的运动状态,可直接反映不同节段心肌的运动特征和力学属性,近年来该项技术也开始用于对实验动物模型的术后监测以及恢复性治疗手段的评估[18,19]。
STI技术通过对斑点运动追踪并加以分析,可获得心肌各点在长轴方向和短轴方向的运动速度、加速时间和位移变化。以上数据经拟合后叠加在时间轴上, 可明确某个心室段心肌发生了变化, 并了解心功能异常发生在心室收缩期或舒张期。不仅如此, 在对心肌运动速度定位、定量的同时, STI可同时测得左室心肌的应变和应变率。由于应变可反映心肌发生形变的能力,而应变率则反映心肌上某点被周围心肌作用力后的反应速度,因此可直观反映某节点的力学属性,从而减弱了麻醉深度及测试者间的差异对所得数据的影响[16]。应变与应变率在MI后期的降低可能与心肌层的变薄变脆、瘢痕组织的形成以及炎性细胞区的扩张有关[19]。以上数值的监测对于未来进行梗死后药物干预实验的位点和时间点都能有更精确的把握。
本研究表明,Sham组小鼠心肌应变力较为均一,加速时间较为一致,而MI小鼠的应变力大小、加速时间和方向都出现异常。尽管某些MI小鼠能够维持足够的EF%和FS%,但其受损心肌区域的心肌压缩能力已经受到了影响,机体为维持这种杂乱无序的形变无疑会造成大量能量损耗,从而拖累缺血心肌的修复[15,19]。小鼠应变力发生变化的心肌节段与病理结果也较为一致。在应变率方面,MI小鼠心肌应变率明显下降,某些节段加速时间延后,说明受影响部位心肌收缩迟缓、收缩不同步,心肌本身发生了质变。这也是MI小鼠心肌出现反向运动和运动混乱的原因。
通过分析表明, 尽管MI小鼠心肌的运动速度、位移能力都较对照组小鼠有所降低,但两组小鼠心肌应变力和应变率的变化更为明显,证明心肌力学属性的变化较心肌运动能力更能反映小鼠心室的实际状态。值得一提的是, 通过STI技术统计显示, 前壁心基部存在明显的代偿性运动速度增加,后壁心基部位移能力与Sham组差距较小,原因可能是机体通过增加Sham组心肌运动来维持足够的射血能力[14,15]。这也是为何传统超声只通过EF%与FS%来评价小鼠MI程度缺乏特异性和灵敏性的原因。
STI技术的缺点也很明显,即心肌运动与应力数据没有一个公认的正常范围或‘评分标准’,STI技术的判读必须与传统心功能参数: EF%与FS%联合作为判读小鼠MI程度的依据。此外,超声仪器的运用对数据的影响也较大: 不同仪器的条件设置(例如: 噪音、频率和增益幅度等)对于获得图像质量的差异,会影响到后期软件对于斑点运动的分析[14]。这也是其一直无法获得一个公认正常范围标准的原因。
本实验仅为STI技术在小鼠MI模型上运用的初探。通过运用STI技术,发掘MI小鼠心室不同节段心肌的运动能力变化以及力学属性变化,以弥补传统超声未给出的信息量。从MI疾病病程分析,由于MI涉及到心肌缺血、梗死和心室重构的变化过程,未来可运用该技术分析比较MI小鼠在MI前、中、后期的心功能变化。
