牦牛和柴达木黄牛低氧通气反应及颈动脉体NO、NOS的比较研究
2018-10-30靳国恩沈明华顾海燕雷乃虎
张 寿,靳国恩,常 兰*,吕 军,沈明华,刘 惠,顾海燕,雷乃虎
(1.青海大学农牧学院,西宁 810016; 2.青海大学医学院高原医学研究中心,西宁 810001; 3. 青海省天峻县畜牧兽医工作站,天峻 817200)
增加肺的通气量是平原动物(包括人)进入高原后迅速适应高原低氧环境的反应之一。资料报道急性高山病(acute mountain sickness,AMS)[1-2]的发病率与人的相对低通气量有关,增加通气量是防制AMS发生的主要措施之一。许多学者对人和动物有关低氧通气反应及其发生机制进行了大量研究,如Chiodi[3]报道美洲高原印第安人存在低氧通气反应(hypoxic ventilatory response,HVR)减弱和肺通气功能降低的趋势;Hodges等[4]对3个近交系大鼠品种和1个远交大鼠品种进行了对比试验研究,结果发现HVR受基因多样性的影响,不同品种的大鼠在低氧时呼吸表型(如频率、节奏)也不一样。Strohl等[5]报道HVR还受大鼠品种、个体、性别的影响,且品种是主要的影响因素。研究发现大鼠的每分通气量、频率、潮气量均与品种有关(如每分通气量SD大鼠大于K大鼠、Z大鼠,频率BN大鼠大于K大鼠,潮气量SD大鼠大于BN大鼠、K大鼠、Z大鼠)。Ye等[6]研究发现大鼠颈动脉体(carotid body,CB)中低氧所诱导的一氧化氮(nitric oxide,NO)增加可以促进其对慢性低氧的适应性,而且结构性一氧化氮合酶(constitutive nitric oxide synthase,cNOS)和诱导性一氧化氮合酶(inducible nitric oxide synthase,iNOS)参与了NO生成,在慢性低氧时NO生成增多又可钝化CB对低氧化学感受的敏感性等。有关高原牦牛颈动脉体形态学方面的研究我们已有报道[7-8],但对牦牛HVR及其机制方面鲜有研究。为此,我们对生活在青藏高原(海拔3 200 m) 低氧环境中牦牛的HVR及NO、一氧化氮合酶(nitric oxide synthase,NOS)含量与柴达木黄牛进行比较研究。
1 材料与方法
1.1 材料
选取青海省海西蒙古族藏族自治州(海拔3 200 m)临床健康的成年雌性牦牛和柴达木黄牛各10头进行低氧(13.9% O2)通气反应,经颈动脉放血处死后立即分离出CB投入液氮中,待用于ELISA双抗体夹心法检测。在屠宰季节另选取海拔3 200 m成年健康牦牛和柴达木黄牛各10头处死,迅速取出CB,其中左侧CB置入4%多聚甲醛磷酸缓冲液(0.01 mol·L-1,pH 7.4) 中固定,用于免疫组织化学染色;右侧CB投入液氮中,分别用于ELISA双抗体夹心法检测和荧光定量PCR。
1.2 方法
1.2.1 低氧通气反应 牛保定后牛耳剪毛便于检测血氧饱和度(SaO2)。戴上呼吸面罩(面罩呼气口连接多功能生理信号采集系统)后,在常氧下呼吸5~10 min,用MP150型多导电生理记录仪(16通道)(美国Biopac公司)描记连续呼吸曲线,并用YX301型脉搏血氧仪测定血氧饱和度(SaO2);吸入低氧(13.9% O2)混合气体(模拟海拔6 000 m)12 min,重复记录上述内容;根据MP150型多导电生理记录仪记录的呼吸曲线采集潮气量(TV)、呼吸频率(Bf),计算每分通气量(VE)=TV×Bf(60 s),用吸入低氧后SaO2下降和VE增加的绝对值的比值(ΔVE/ΔSaO2)来计算低氧通气反应的斜率。
1.2.2nNOS、eNOS和iNOS基因表达鉴定
1.2.2.1 总RNA提取和cDNA合成:用TRIZOL法提取海拔3 200 m牦牛和柴达木黄牛CB总RNA,选取OD260 nm/OD280 nm值介于1. 8 ~ 2. 0、浓度大于或等于0.1 μg·μL-1者,进行1%琼脂糖凝胶电泳检测,总RNA电泳采用4.5 V·cm-1电泳强度,采用First Strand cDNA Synthesis Kit(上海索宝生物公司)将提取鉴定的总RNA逆转录,并合成cDNA,并将逆转录PCR产物保存于-20 ℃。
1.2.2.2 基因扩增引物设计:采用NCBI登录GenBank,分别下载牛(Bostaurus,XM_015467111、NM_181037、NM_001076799)的nNOS、eNOS和iNOSmRNA序列,然后根据引物设计专用软件Primer Premier 5.0在基因序列保守区域设计特异性扩增引物,设计引物序列见表1。引物由上海生工生物工程有限公司合成。
表1牦牛和柴达木黄牛nNOS、eNOS和iNOS荧光定量PCR引物
Table1FluorescencequantitativePCRprimerofnNOS,eNOSandiNOSofyakandQaidamyellowcattle

基因Gene引物序列(5'→3')Primers sequence产物长度/bpProduct length退火温度/℃Annealing temperaturenNOSAGCACCTTTGGCAATGGAGACCC16860GAGGAAACGCTGTTGAAACGCACCeNOSGTTCCCTCGCGTGAAGAACT19959CTGGTTGATGAAGTCCCTGGCiNOSCTTGTTCTCGAGGTGCCCAT17460GTCCCGGACTCCAACTTCTG
1.2.2.3 荧光定量PCR检测:按照Hot Start Fluorescent PCR Core Reagent Kits (SYBR GreenⅠ) 说明书,取GAPDH标准品及样品等配制反应体系。配好PCR反应体系,放置于ABI7500 PCR仪上进行PCR反应。根据ABI7500预设条件,成倍稀释cDNA完成反应标准曲线,确保样品待测基因与内参照基因的扩增效率一致。
1.2.3 nNOS、eNOS和iNOS蛋白表达鉴定 采用酶联免疫吸附(ELISA)双抗体夹心法测定海拔3 200 m和模拟海拔6 000 m的牦牛和柴达木黄牛CB组织中nNOS、eNOS和iNOS蛋白(美国R&D公司ELISA kit试剂盒,购自北京谊普生生物公司)。各步骤均严格按说明书进行。每项检测均设3个复孔。
1.2.4 免疫组化染色步骤 海拔3 200 m牦牛和柴达木黄牛CB经4%多聚甲醛磷酸缓冲液固定、常规脱水、透明、包埋、连续切片,片厚4 μm,隔50取4,分成4套,其中3套分别用于nNOS、eNOS和iNOS多克隆抗体免疫组化SP法染色,另外1套进行阴性对照。用于免疫组化染色的切片依次常规脱蜡至水、枸橼酸修复液高压修复、内源性过氧化物酶阻断液孵育、非免疫动物血清(羊) 后分别入一抗(兔源性nNOS、eNOS和iNOS多克隆抗体,1∶200,武汉博士德公司)、置冰箱4 ℃过夜、生物素标记的羊抗兔IgG、HRP标记的链霉卵白素-抗生物素溶液(SP试剂盒,福州迈新公司)、DAB显色液呈色,各步骤间PBS液洗(非免疫动物血清和一抗间不洗)、苏木素染液复染、脱水、透明、封片。阴性对照试验用PBS液代替一抗。
光镜下观察切片,用图象采集系统数码照相,牦牛、柴达木黄牛各5头,每头牛CB组织取5张切片,每张nNOS、eNOS和iNOS阳性切片选取着色最深视野拍照 2~3张,每个因子共计60张。利用Image-Pro Plus 6.0图像分析软件(德国)分析照片,计算阳性区域平均光密度值(Mean optical density,MOD)。
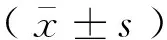
2 结 果
2.1 NOS基因mRNA在海拔3 200 m牦牛和柴达木黄牛CB表达差异
牦牛颈动脉体中nNOS基因mRNA表达水平高于柴达木黄牛,而eNOS、iNOS基因mRNA表达水平分别低于柴达木黄牛,差异均不显著(P>0.05)(表2)。
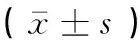
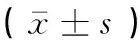

组别Group神经型一氧化氮合成酶nNOS内皮型一氧化氮合成酶eNOS诱导型一氧化氮合成酶iNOS牦牛Yak2.99±2.070.97±0.541.59±0.82柴达木黄牛Qaidam yellow cattle0.60±0.241.26±0.172.97±2.41
与柴达木黄牛组比较,*.P<0.05; **.P<0.01
*.P<0.05vsQaidam yellow cattle group; **.P<0.01vsQaidam yellow cattle group
2.2 急性低氧(13.9%O2)下牦牛和柴达木黄牛HVR比较
牦牛、柴达木黄牛在常氧下(海拔3 200 m)VE分别为(46.62±13.99)和(22.76±8.97) L·min-1(P<0.01),SaO2为(89.80±4.34)%和(85.25±6.76)% (P>0.05);吸入低氧混合气体(13.9% O2)后,VE分别为(50.11±13.86)和(30.20±8.29) L·min-1(P<0.01),SaO2下降至(71.92±8.43)%和(69.66±6.18)% (P>0.05)。故低氧通气反应的斜率(VE的增加和SaO2下降的绝对值的比值即两组△VE/△SaO2)分别为(0.21±0.10)和(0.50±0.21) (L·min-1)/% SaO2(P<0.01)。
2.3 急性低氧(13.9%O2)下牦牛和柴达木黄牛颈动脉体中NOS和NO比较
由表3可知,生活在海拔3 200 m组(即常氧下)牦牛CB中nNOS、eNOS、iNOS活性和NO含量分别与柴达木黄牛的相比均没有显著差异(P>0.05)。在急性低氧(13.9%O2)组(模拟海拔6 000 m组)中,牦牛CB中nNOS、eNOS、iNOS活性分别与柴达木黄牛相应值相比无显著差异(P>0.05),但牦牛CB中NO含量明显高于柴达木黄牛(P<0.01);急性低氧(13.9%O2)组的牦牛和柴达木黄牛CB中nNOS、eNOS、iNOS与海拔3 200 m组的相应值比较,均无显著差异(P>0.05),而NO含量均分别明显高于海拔3 200 m 组(P<0.01,P<0.05)。
2.4 NOS蛋白在牦牛和柴达木黄牛CB中表达的形态学差异
由图1和表4可以看出,CB实质由大量的圆形或椭圆形的小球密集组合而成,小球主要由分布于其外围的“C”型并成簇排列的球细胞组成。NOS的nNOS、eNOS、iNOS蛋白在牦牛和柴达木黄牛CB中均有表达,且主要表达于CB成簇的球细胞中;牦牛nNOS和iNOS蛋白水平表达显著高于柴达木黄牛,差异均极显著(P<0.01),而eNOS蛋白水平表达极显著低于柴达木黄牛(P<0.01)。
3 讨 论
平原人暴露在高原后HVR会增强,肺的通气量也增大[9]。研究还表明高原世居人对HVR迟钝[3,10-12],Severinghaus等[11]、Lahiri和Milledge[12]分别在对玻利维亚的印第安人和喜马拉雅的舍巴人的研究中获得了同样的结果。研究发现外周化学感受器去敏感性可导致高原世居人的HVR迟钝,这种去敏感现象发生于长期暴露在高原低氧环境下的几代人当中。杨生岳等[13]对平原移居至海拔4 750 m 20~80 d的汉族(短居组)、3~20年的汉族(久居组)和当地世居藏族(世居组)进行了HVR研究,结果表明,短居高原汉族的HVR较久居高原汉族和世居高原藏族敏感,且后两组HVR迟钝但无明显差异,说明久居高原汉族的HVR也变得迟钝,并获得与世居高原藏族相似的HVR。但也有高原世居人对HVR并不迟钝的报道,孙新甫等[14]对海拔3 658 m高原(拉萨)世居藏族及已习服的移居汉族的HVR进行了比较,发现世居组HVR高于移居组。而格日力等[15]对居住在青藏高原海拔2 000~3 000 m (中海拔)和4 000~4 700 m (高海拔)地区藏族的低氧(12% O2)通气反应进行了研究,结果发现,中海拔组对低氧的刺激反应保持着较高的通气反应,而高海拔组则显示钝化,认为高原人通气反应的钝化与居住地的海拔高度有关。本次研究发现吸入低氧(13.9% O2)后,牦牛SaO2下降的程度略大于柴达木黄牛,且每分通气量的增加量在牦牛和柴达木黄牛间有明显差异,即牦牛VE增加的绝对值小于柴达木黄牛。因此,△VE/△SaO2的斜率明显减小,说明牦牛比柴达木黄牛有着较低的HVR。
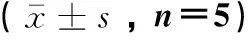
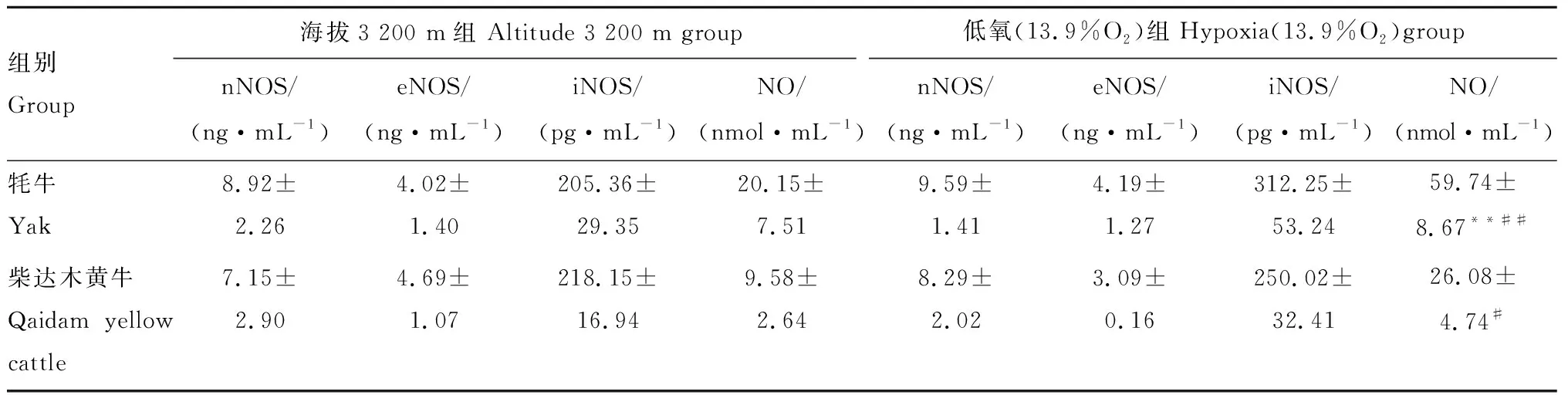
组别Group海拔3 200 m组 Altitude 3 200 m group低氧(13.9%O2)组Hypoxia(13.9%O2)groupnNOS/(ng·mL-1)eNOS/(ng·mL-1)iNOS/(pg·mL-1)NO/(nmol·mL-1)nNOS/(ng·mL-1)eNOS/(ng·mL-1)iNOS/(pg·mL-1)NO/(nmol·mL-1)牦牛Yak8.92±2.264.02±1.40205.36±29.3520.15±7.519.59±1.414.19±1.27312.25±53.2459.74±8.67**##柴达木黄牛Qaidam yellow cattle7.15±2.904.69±1.07218.15±16.949.58±2.648.29±2.023.09±0.16250.02±32.4126.08±4.74#
与柴达木黄牛组比较,**.P<0.01;与海拔3 200 m组比较,#.P<0.05, ##.P<0.01
**.P<0.01vsQaidam yellow cattle group;#.P<0.05,##.P<0.01vsaltitude 3 200 m group


A~C. 牦牛;D~F. 柴达木黄牛;A、D. nNOS;B、E. eNOS;C、F. iNOS;.小球.↑.球细胞A-C. Yak; D-F. Qaidam yellow cattle; A, D. nNOS; B, E. eNOS; C, F. iNOS;.Globule;↑.Globule cell图1 牦牛和柴达木黄牛CB中nNOS、eNOS、iNOS蛋白表达(免疫组织化学染色40×)Fig.1 The expression of nNOS, eNOS and iNOS in carotid body of yak and Qaidam yellow cattle (Immunohistochemical staining 40×)
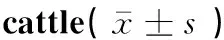

组别Group神经型一氧化氮合成酶nNOS内皮型一氧化氮合成酶eNOS诱导型一氧化氮合成酶iNOS牦牛 Yak0.20±0.02**0.18±0.02**0.27±0.04**柴达木黄牛 Qaidam yellow cattle0.16±0.020.19±0.010.19±0.01
与柴达木黄牛组比较, **.P<0.01
**.P<0.01vsQaidam yellow cattle group
一般认为HVR的减弱与CB的结构或生化改变有关。Donovan等[16]研究发现BN大鼠在低氧环境下表现出较低的急性通气反应,而SD大鼠呈现较高的通气反应,但BN大鼠TH阳性和nNOS阳性区域均大于SD大鼠。Ⅰ型细胞中线粒体被认为与CB氧感受有关,我们先前的研究表明牦牛Ⅰ型细胞线粒体数量明显少于柴达木黄牛[8],牦牛也有着比柴达木黄牛较低的HVR。另外,在常氧下(海拔3 200 m)牦牛通气量(46.62±13.99) L·min-1,显著大于柴达木黄牛的(22.76±8.97) L·min-1,这也可能是牦牛比柴达木黄牛有着较低HVR的原因之一。
急性氧感受是个体在低氧状态下生存的必要条件。CB是主要的外周化学感受器,其含调节离子通道含有的易兴奋和氧敏感的球细胞。机体暴露于急性低氧环境下,K+通道的抑制是触发细胞去极化、神经递质释放和刺激脑干呼吸中枢产生超通气的感觉纤维激活信号。最新的研究表明[17],大鼠两侧CB去神经后5周,呼吸节奏缓慢而不规律,10周后呼吸频率与假手术组间无差异,但呼吸节奏的规律性仍然在减少。增加随机呼吸暂停的频率可能是CB去神经后产生不规则呼吸模式的原因。在常氧下NO能增加去化学感受效应,而在低氧条件下,NO是CB化学感受的主要抑制调节器,它直接调节球细胞和岩神经节神经元的兴奋性,间接调节血管紧张性和氧传递[18]。Fung等[19]研究发现,在低氧状态下大鼠CB中内源性NO生成增多,NO的升高可抑制颈动脉化学感受器对低氧的反应。NOS催化L-精氨酸而生成NO。Valdés等[20]报道,在猫CB中nNOS和eNOS都参与NO的生成,但eNOS是NO的主要来源,并且加强化学感受活动。本研究中,海拔3 200 m(常氧下),牦牛颈动脉体中nNOS基因mRNA和蛋白表达水平、NO含量均高于柴达木黄牛,而eNOS、iNOS基因mRNA和蛋白表达水平分别低于柴达木黄牛,但差异均不显著(P>0.05);免疫组化的研究结果表明牦牛CB中nNOS也高于柴达木黄牛(P<0.01), eNOS蛋白水平表达也低于柴达木黄牛(P<0.01),但iNOS蛋白水平表达却高于柴达木黄牛(P<0.01),说明牦牛CB中nNOS、eNOS蛋白含量最高区域的平均光密度值均高于柴达木黄牛,而iNOS蛋白含量最高区域的平均光密度值低于柴达木黄牛。急性低氧(13.9% O2)组(模拟海拔6 000 m)牦牛和柴达木黄牛CB中nNOS、eNOS、iNOS活性分别大于海拔3 200 m 组,相应指标差异均不显著(P> 0.05),而NO含量则显著高于海拔3 200 m组(P<0.01,P<0.05),并且在急性低氧(13.9%O2)(模拟海拔6 000 m) 状态下,牦牛颈动脉体中NO含量极显著高于柴达木黄牛(P<0.01),可见急性低氧可导致牦牛和柴达木黄牛CB中产生大量NO,且牦牛明显多于柴达木黄牛。综上所述,在急性低氧条件下牦牛CB中高含量的NO阻止了CB对低氧的感受,同时钝化了牦牛的HVR。
4 结 论
青藏高原世居牦牛低氧通气反应钝化,而柴达木黄牛对低氧的刺激保持较高的通气反应,急性低氧时牦牛CB内产生大量的NO可抑制对低氧的化学感受。
