多黏菌素耐药基因的变异特征及传播规律的研究现状
2018-10-30张亚超上官振坤范若兰关松磊张林波
孙 赫,张亚超,上官振坤,张 益,范若兰,李 航,关松磊,张林波
(吉林农业大学生命科学学院病原微生物与免疫学研究室,长春 130118)
近年来,由于抗生素的滥用,多药耐药菌日益增多,致病性越来越强,治疗已陷入困境。多黏菌素(polymyxin/colistin)一直以来都被认为是防治产β-内酰胺酶革兰阴性菌感染的“最后一道防线”。但是自从2015年,中国科学家首次报道了从动物源大肠埃希菌中分离到质粒介导的多黏菌素抗性基因mcr-1[1],该基因的出现可能使人畜陷入“无药可用”的困境。随后,陆续有多种mcr基因被报道(包括mcr-2[2]、mcr-3[3]、mcr-4[4]、mcr-5[5])。这些耐药基因的突变率很高,每种类型又可以细分为若干亚型,截至目前,mcr-1报道有15种亚型,mcr-2有2种亚型,mcr-3有10种亚型,mcr-4有2种亚型。这种多样性是细菌适应外界抗生素压力的结果,可能会导致黏菌素耐药水平和传播能力的改变。为了全面了解黏菌素耐药的情况,本文对各亚型的特征及传播规律进行综述。
1 黏菌素耐药基因各亚型的特点
1.1 mcr-1
mcr-1是最早被发现的由质粒介导的黏菌素耐药基因(mobile colistin resistance,mcr-1),全长1 626 bp,GC含量49%,编码产生MCR-1蛋白,此蛋白属于磷酸乙醇胺转移酶家族,能够催化磷酸乙醇胺与细胞膜脂多糖上的类脂A结合并修饰,降低类脂A磷酸基团的负电荷,使磷酸基团与黏菌素结合变弱,导致细菌产生黏菌素抗性[6]。MCR-2~MCR-5各亚型的耐药机制与MCR-1基本相同,MCR-1含有5个跨膜的α螺旋并具有2个催化结构域,跨膜结构域可以将催化结构域锚定到细胞质膜的表面,完成对类脂A的共价修饰[7]。mcr-1的传播主要依靠质粒,Inc X4、Inc I2、Inc HI1、Inc HI2、Inc F等质粒都可以携带mcr-1[8],且大多数质粒上都存在插入序列ISApl1[9]。目前,已经发现了mcr-1的10余种亚型(表1),是黏菌素基因中最庞大的家族,包括从白血病儿童的直肠拭子中产KPC-3的肺炎克雷伯菌检测到的mcr-1.2[10],从鸡肉中的大肠埃希菌中检测到的mcr-1.3[11],从污水中大肠埃希菌检测到的mcr-1.4、mcr-1.7[12],从病人泌尿道的大肠埃希菌中检测到的mcr-1.5[13],从健康人携带的鼠伤寒沙门菌检测到的mcr-1.6[14],从大肠埃希菌中检测到的mcr-1.8、mcr-1.9、mcr-1.11、mcr-1.12以及从莫氏杆菌中检测到的mcr-1.10[15],此外还有在德国、中国和巴西的大肠埃希菌检测到的未命名的3种突变亚型[16]。这些变异大大丰富了mcr-1家族群体。
1.2 mcr-2
mcr-2是继mcr-1之后被发现的第二种类型黏菌素耐药基因。研究者[2]从比利时52头小牛和53头小猪的腹泻样本的大肠埃希菌中发现了不同于mcr-1的黏菌素耐药基因,命名为mcr-2。该基因全长1 617 bp,比mcr-1(1 626 bp)短9 bp,DNA序列和氨基酸序列分别有76.7%和81.0%的一致性。Inc X4不相容型质粒pKP37-BE在大肠埃希菌中携带mcr-2,插入序列ISEc69位于mcr-2附近,形成ISEc69-mcr-2,两者一同转移。研究还发现,ISEc69元件的主链序列及其编码的膜相关磷脂酸磷酸酶(phosphatidic acid phosphatase,PAP2)与莫拉菌属(Moraxellaosloensis)相似性很高,说明mcr-2基因可能来源于莫拉克斯菌属[2]。mcr-1(插入序列ISApl1)和mcr-2(插入序列ISEc69)基因相邻序列的不同,暗示了两种黏菌素耐药基因的整合、获得和传播的模式可能不同。目前报道的mcr-2突变亚型有两种(mcr-2.1和mcr-2.2),都来自于莫拉菌属[15]。与mcr-2相比,mcr-2.1有8个氨基酸变异,但是mcr-2.2却有65个氨基酸都发生突变,突变率较高。
1.3 mcr-3
mcr-3是在山东省农场动物细菌抗菌素耐药性的常规监测中被发现的。研究者从健康猪的粪便大肠埃希菌样品中获得了与mcr-1和mcr-2不同的黏菌素耐药基因mcr-3(MIC≥4 μg·mL-1)[3]。mcr-3由质粒IncHI2-pWJ1携带,大小为261 119 bp,pWJ1的222.3 kb区段(总序列的85.4%)与首次报道的携带mcr-1的大肠埃希菌菌株质粒pHNSHP45-2高度相似,说明两者同源性较近。mcr-3基因全长1 626 bp,mcr-3与mcr-1及mcr-2的差异较大,核酸序列与mcr-1和mcr-2只有45.0%和47.0%的相似性,氨基酸序列与MCR-1和MCR-2也只有32.5%和31.7%的一致性。MCR-3蛋白具有两个结构域,结构域1(残基1—172)含有5个跨膜α-螺旋,结构域2(残基173—541)包含催化中心的周质结构域,结构域2的最适合结构是4KAV(已被证明是最适合MCR-1和MCR-2的结构[1-2])。mcr-3目前共分离得到10种亚型,mcr-3、mcr-3.2、mcr-3.3、mcr-3.5、mcr-3.6、mcr-3.7、mcr-3.8、mcr-3.9、mcr-3.10和mcr-3.11(NG_055505、NG_055523、NG_055783、NG_055782、MF598076、MF598077、NG_055662、NG_055663、NG_055799及MG489958)[4,17-21],是目前为止除了mcr-1外,突变类型最复杂、涉及菌种最多、传播范围最广的黏菌素耐药基因。
表1黏菌素耐药基因各亚型的特征
Table1Thecharacteristicofmcrvariants
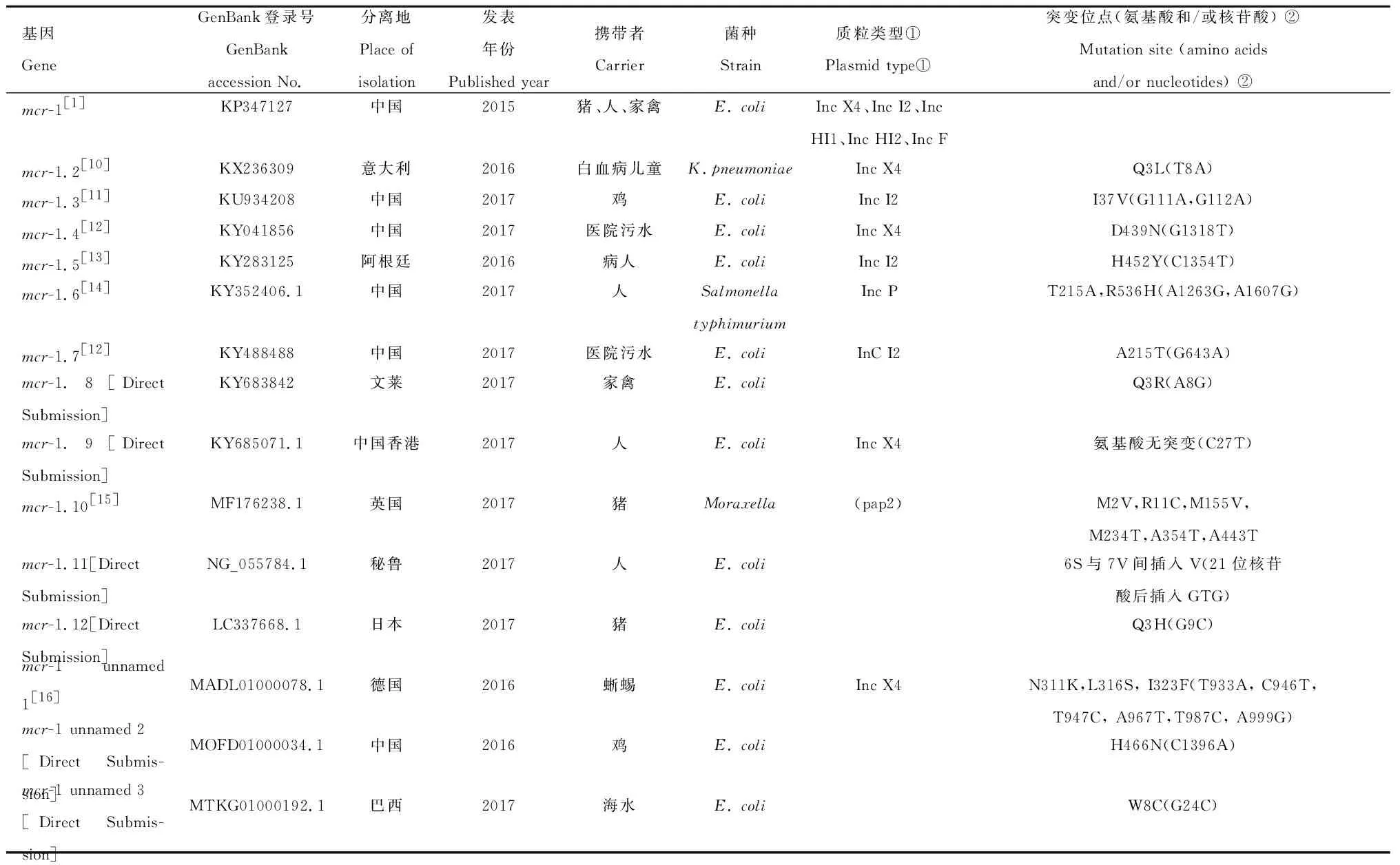
基因GeneGenBank登录号GenBank accession No.分离地Place ofisolation 发表年份Published year携带者Carrier菌种Strain质粒类型①Plasmid type① 突变位点(氨基酸和/或核苷酸) ②Mutation site (amino acids and/or nucleotides) ② mcr-1[1]KP347127中国2015猪、人、家禽E. coliInc X4、Inc I2、Inc HI1、Inc HI2、Inc Fmcr-1.2[10]KX236309意大利2016白血病儿童K.pneumoniaeInc X4 Q3L(T8A)mcr-1.3[11]KU934208中国2017鸡E. coliInc I2 I37V(G111A,G112A)mcr-1.4[12]KY041856中国2017医院污水E. coliInc X4D439N(G1318T)mcr-1.5[13]KY283125阿根廷2016病人E. coliInc I2H452Y(C1354T)mcr-1.6[14]KY352406.1中国2017人Salmonella typhimuriumInc PT215A,R536H(A1263G,A1607G)mcr-1.7[12]KY488488中国2017医院污水E. coliInC I2A215T(G643A)mcr-1.8[Direct Submission]KY683842文莱2017家禽E. coliQ3R(A8G)mcr-1.9[Direct Submission]KY685071.1中国香港2017人E. coliInc X4氨基酸无突变(C27T)mcr-1.10[15]MF176238.1英国2017猪Moraxella(pap2)M2V,R11C,M155V,M234T,A354T,A443Tmcr-1.11[Direct Submission]NG_055784.1秘鲁2017人E. coli6S与7V间插入V(21位核苷酸后插入GTG)mcr-1.12[Direct Submission]LC337668.1日本2017猪E. coliQ3H(G9C)mcr-1 unnamed 1[16]MADL01000078.1德国2016蜥蜴E. coliInc X4N311K,L316S, I323F(T933A, C946T,T947C, A967T,T987C, A999G)mcr-1 unnamed 2[Direct Submis-sion]MOFD01000034.1中国2016鸡E. coliH466N(C1396A)mcr-1 unnamed 3[Direct Submis-sion]MTKG01000192.1巴西2017海水E. coliW8C(G24C)

(转下页 Carried forward)

(转下页 Carried forward)
①括号内是移动元件;②括号内是核苷酸突变
① In brackets is the mobile element; ② In brackets is the nucleotide mutation
1.4 mcr-4
mcr-4是从意大利屠宰猪的盲肠内容物中分离的鼠伤寒沙门菌(4,5,12:i:-)R3445中检测到的。mcr-4基因位于ColE10质粒上(pMCR)。pMCR质粒整合在染色体Ⅰ型甲基化基因内,插入序列IS5参与了质粒与染色体的整合。ColE是具有广泛宿主范围的小型非自交质粒,可以在不同的细菌种属中复制,大大增加了耐药基因的传播。此外I1、I2、F、X1和HI2家族质粒也都可以携带mcr-4[4]。MCR-4蛋白与希瓦菌属(Shewanella)中发现的磷酸乙醇胺转移酶有82.0%~99.0%的氨基酸序列一致性,与MCR-1、MCR-2和MCR-3分别有34.0%、35.0%和49.0%的氨基酸序列一致性。目前在意大利、西班牙、比利时的猪源样本中均分离到了携带mcr-4的大肠埃希菌[4]。目前报道的mcr-4的亚型有3种,在意大利和新加坡病人体内分离出的阴沟肠杆菌和鼠伤寒沙门菌携带的mcr-4.2[19,21],以及mcr-4.3和mcr-4.4。
1.5 mcr-5
2011—2016年间,研究者从414株乙型副伤寒沙门菌中分离到14株耐黏菌素d-酒石酸发酵乙型副伤寒沙门菌亚种(SalmonellaParatyphiBdTa+),通过全基因组测序发现一种新的磷酸乙醇胺转移酶基因mcr-5[5],mcr-5基因全长1 644 bp,是Tn3家族的7 337 bp转座子的一部分,通常位于多拷贝相关的ColE型质粒上,其中一株亚克隆株12-02546-2沙门菌的mcr-5基因不在质粒上,而是位于细菌染色体鸟氨酸脱羧酶上,推测可能是通过转座子整合到沙门菌染色体上。MCR-5含有547个氨基酸,分为3个结构域:1个跨膜结构域和1个硫酸酯酶结构域,此外还有一个未知功能的结构域(DUF1705)。MCR-5与MCR-1、MCR-2、MCR-3、MCR-4氨基酸序 列差异较大,分别只有36.11%、35.29%、34.72% 和33.71%的一致性,且目前来源不明。在MCR-5硫酸酯酶结构域C末端中发现5个MCR-5保守残基(E248、T286、H389、D458和H459),与MCR-1、MCR-2、MCR-3和MCR-4中的残基相同。与之前发现的亚型不同,mcr-5是由小型多拷贝ColE型质粒携带的,不携带任何参与质粒接合相关的转移基因。到目前为止,mcr-5已经有两种突变亚型被报道。
2 传播情况
2.1 传播的机制
在各类型黏菌素耐药基因中,mcr-1的传播机制是目前研究最多的,也是最具有代表性的。最普遍的传播形式是耐药基因存在于可移动元件上,如质粒、插入序列、转座子等。最早有科学家从畜禽源黏菌素耐药大肠埃希菌pHNSHP45质粒上发现了可水平转移的黏菌素耐药基因mcr-1,并通过体外接合试验证明了该基因可通过多种可接合性质粒在不同菌种之间传播[22-23]。Dénervaud等[23]将临床分离得到的3种含有不同mcr-1质粒的大肠埃希菌作为供体,以肺炎克雷伯菌、产酸克雷伯杆菌、阴沟肠杆菌为受体进行质粒接合转移试验,发现mcr-1基因可以通过质粒传播到这些菌中,菌株类型对接合转移效率的影响比质粒类型对接合转移效率的影响更显著。ISApl1属于IS30家族的插入序列,两边侧翼序列为反向重复序列,左侧和右侧重复序列分别为IRL和IRR。Liu等[18]、Snesrud等[24]发现ISApl1在mcr-1基因的一端或两端连接,上游ISApl1的左侧重复序列IRL与下游ISApl1右侧的IRR识别并形成复合插入序列,促进其传播。可见转移元件在mcr传播过程中发挥了重要的作用。另外,携带mcr-1的菌株种类呈多样性,包括大肠埃希菌[11,25]、阪崎肠杆菌[26]、沙门菌[27-28]、肺炎克雷伯菌[1]、志贺菌[29]、解鸟氨酸劳特菌[30]等,染色体遗传是纵向传播的一种形式,部分菌株可以克隆扩增和水平传播[31-32]。Hernández等[20]在检测西班牙牛源大肠埃希菌多重耐药性情况时,其中一株细菌ZTA15/01169-1EB1同时携带mcr-1和mcr-3.2,这两个mcr基因可能位于同一质粒上,通过PFGE和mcr-1和mcr-3特异性探针的杂交结果显示Inc HI2为携带这两个黏菌素耐药基因的最适质粒,但是其黏菌素抗性较低(MIC≤4 mg·L-1)。
mcr-2、mcr-3、mcr-4、mcr-5的传播方式与mcr-1类似,也可以通过质粒、插入序列、转座子介导传播。大肠埃希菌Inc X4不相容型质粒pKP37-BE质粒可携带mcr-2。ISEc9转移元件介导的mcr-2转座与ISApl1元件介导的mcr-1转座机制有很大不同,mcr-2基因的两侧ISEc9元件会通过IS元件的同源重组而形成环化中间体参与mcr-2的转移,环化中间体的出现可能加速多种细菌宿主中mcr-2黏菌素抗性的快速传播[2]。另外,MCR-2酶的跨膜区域为TM2,而MCR-1酶的跨膜区域为TM1,经过试验证实TM2比TM1能够更有效地促进磷酸乙醇胺与类脂A的结合,因此MCR-2的酶活性明显高于MCR-1,且mcr-2的转录水平也明显高于mcr-1,耐药性更强[2]。
Inc HI2-pWJ1质粒携带mcr-3,上游的801 bp片段nimC / nimA-mcr-3属于TnAs2型转座子[33],Inc P质粒携带mcr-3.5,转座子TnAs3帮助基因的转移和传播。mcr-4基因位于鼠伤寒沙门菌和大肠埃希菌的ColE10质粒上,插入序列IS5位于mcr-4附近,质粒的转移需要辅助质粒Inc I2的参与,而且在Inc I1、Inc I2、Inc F、Inc X1和Inc HI2家族质粒上也发现了mcr-4[20]。研究发现,沙门菌内的小型多拷贝ColE型质粒携带mcr-5[5],但在乙型副伤寒沙门菌亚克隆菌株中未发现携带mcr-5 的质粒,mcr-5已经随转座子Tn3整合在细菌染色体内的鸟氨酸脱羧酶基因上,说明mcr-5主要随着转座子传播。由此可见,质粒在mcr基因得以广泛传播的过程中起关键性作用,但是在质粒基因组中都发现移动元件的存在,推测移动元件——mcr是黏菌素基因得以传播的一个重要因素。
2.2 传播的范围
黏菌素耐药基因最早被发现和报道的是mcr-1。mcr-1基因的产生可追溯到20世纪80年代,Shen等[34]对中国1970—2014年鸡肉样本进行检测,在首次发现之后的20多年里都没有检测到,在2004年和2006年检出mcr-1基因,从2009年开始mcr-1的检出率呈上升趋势,2009年为5.2%(6/115),2011年为11.9%(15/126),2012年为20.9%(24/115),2013年为25.4%(29/114),2014年为30.0%(15/50)。这一趋势与2009年开始我国大规模使用黏菌素相符合,说明耐药基因的产生与黏菌素压力相关。统计显示,国内动物性食品源大肠埃希菌mcr-1基因检出率为 4.9%~29.0%,且呈逐年递增的趋势[1]。除了中国,其他40多个国家,包括德国、巴西、韩国、突尼斯、南非等也从禽类、猪、牛、鱼、污水、空气中检出mcr-1基因[35]。值得注意的是,Zhang等[36]从临床病人的尿液和血液中也检测到mcr-1,随后在患者工作的宠物店里猫和狗的粪便样本中也分离到了携带mcr-1大肠埃希菌。中国科学家在山东省的人、畜、禽类中都检测到了mcr-1[37]。以上研究说明黏菌素耐药基因已经在人畜之间传播。此外, Wang等[38]以457株携带mcr-1细菌的全基因组测序(WGS)制作了全球数据集,中国(n=212)和越南(n=58)是报道mcr-1阳性菌的序列数最多的国家;而山东省则是国内mcr-1检出最多的省份,通过分析这些mcr-1基因的上下游环境,证实了ISApl1在mcr-1传播过程中起到重要作用,而Inc I2和Inc X4是携带mcr-1的主要质粒类型,分别占分离株的51%和38%。
MCR-3蛋白与马来西亚的猪源大肠埃希菌、泰国人源肺炎克雷伯菌和美国人源尿道鼠伤寒沙门菌分离株发现的氨基酸一致性为99.8%至100%[3]。这一发现表明mcr-3基因已经存在于东南亚和北美的农业和临床环境的至少3种肠杆菌中。此研究还表明肠杆菌科的mcr-3可能来源于气单胞菌属,由于此菌属广泛分布在自然界,所以来源于此菌属的携带mcr-3的菌株可能已经在人类、动物和环境中广泛传播[3]。2018年在日本先后报道出现了猪源携带mcr-1、mcr-3、mcr-5的大肠埃希菌,研究证明病猪大肠埃希菌更容易携带mcr,可能与病猪有黏菌素用药史有关[39]。到目前为止,黏菌素耐药基因已经在5个大洲的40多个国家广泛传播,尤其是亚洲和欧洲报道较多。我国是抗生素使用大国,也是最早报道黏菌素耐药基因的国家,mcr-1和mcr-3在我国均有检出和报道。黏菌素耐药基因的传播情况见表2。
表2黏菌素耐药基因的传播情况
Table2Spreadofmcrvariant
通过对mcr的基因环境分析发现不同类型的mcr来源不同,虽然有mcr基因通过移动元件整合到染色体的报道[5],但是质粒是mcr基因的主要载体。携带mcr基因的质粒类型也十分广泛,如Inc X4、Inc I2、Inc HI1、Inc HI2、Inc F、ColE等,而移动元件——mcr是黏菌素基因得以传播的一个重要因素。在多种肠杆菌中都检测到了mcr基因,而这些细菌的来源包括禽类、猪、牛、鱼、污水、水果、蔬菜、人体等。依据目前的报道,mcr-1和mcr-3在中国检出率较高,mcr-1在各国的传播最为广泛,且有可能来源于中国[38],而mcr-4只在意大利、西班牙、比利时、新加坡检出,推测与食品的进出口以及出国旅游,使mcr基因能够跨国跨区域传播有关[40]。
2.3 与其他抗性基因的共传播情况
mcr基因很少单独存在,常常与其他抗性基因共存,引起多药耐药,这种方式极大地增加其危害性,极有可能使人畜面临“无药可用”的境地。携带mcr-1的质粒常携带以下多种抗性基因,如blaCTX-M、blaTEM-1、blaNDM-5、blaNDM-1、aac(6′)-Ib、floR、fosA3、oqxAB等[41-42]。Liu等[1]在2010—2015年间,从中国20个省市病鸡收集的1 136株大肠埃希菌中分离到了58株(5.11%)mcr-1阳性菌株,其中的54株(93.1%)是多药耐药菌株,对喹诺酮类、头孢菌素类、氨基糖苷类和磺胺类都有抗性,25株(43.1%)同时携带CTX-M型基因,表明mcr-1和blaCTX-M基因在大肠埃希菌中共存发生频率很高。携带mcr-3的pWJ1质粒上携带多种耐药基因,其中2个抗性基因对应的抗生素用于人类临床,包括喹诺酮类抗性基因[aac(6′)-Ib-cr]和利福平抗性基因(arr3)[3]。mcr-4可以与blaTEM-1B、aph(4)-1a、aph(3′)-1c、aac(3)-Iva、aac(3)-IIa、strA、aadA1、floR、catA1、sul2、sul1、tet(B)、dfrA1、mph(A)、erm(B)、mphB等多种耐药基因共存于同一个质粒上[4]。而携带mcr-5的pSE13-SA01718质粒上也含有额外的blaTEM-1b耐药基因,由此可见,携带mcr的菌株常常是多药耐药菌株,尤其是耐碳氢霉烯类菌株危险性更高,对人畜的威胁更大。
3 应对策略
综上所述,黏菌素耐药基因具有变异类型复杂、变异频率高、传播范围广、与其他抗性基因普遍共存、潜在危害大的特点。应采取以下措施进行防控:①加强对其生物学行为特征的研究:虽然目前黏菌素处于低水平耐药(2~16 μg·mL-1),但是由于mcr基因突变速度快、类型复杂,一旦出现与其他抗性基因共存的高度多药耐药亚型,将使人畜彻底陷入“无药可用”的境地。目前,我们对黏菌素耐药基因的突变规律和突变原因尚知之甚少,应该对其进行深入研究,包括转移元件的类型及其作用、辅助型质粒在基因传播中的作用、基因从质粒整合到染色体的方式及与其他抗性基因间的相互作用等都是研究的重点。②广泛筛查:mcr基因在动物和动物性食品样本中的检出率远高于人源样本检出率,多数携带有mcr的多重耐药菌主要从动物源样本中检测到,这些耐药菌能够通过动物或食物链传播给人类,对人类健康造成潜在的严重威胁。应当在食源动物和人群中进行黏菌素耐药基因筛查,以了解其散播情况,并评估对人类健康的风险。③加强监管:目前全世界,包括中国在内,已经严格限制抗生素的使用,且采用多种新型组合疗法来治疗多重耐药菌引起的感染,但多黏菌素类药物在畜牧养殖中仍存在滥用的现象,应当切实加强畜牧养殖业的药物监管,定期监测,警惕黏菌素耐药基因的广泛传播。
