BHK21细胞悬浮培养的驯化和质量评价
2018-10-30乔自林王家敏冯若飞李明生令世鑫马忠仁
乔自林,马 祺,王家敏 ,冯若飞,李明生 ,令世鑫,马忠仁
(1.西北民族大学 生物医学研究中心,甘肃 兰州 730030;2.兰州百灵生物技术有限公司,甘肃 兰州 730010;3. 甘肃省动物细胞工程技术研究中心,甘肃 兰州 730030)
BHK21细胞,即叙利亚仓鼠肾细胞.该细胞系于1961年由Macpherson IA、Stoker MGP建系,源自5只未辨性别的1天龄仓鼠肾.该细胞是目前我国口蹄疫疫苗生产的惟一细胞系,原始的BHK21细胞株为贴壁生长[1,2].为提升口蹄疫疫苗的技术水平和产品质量,业内从细胞驯化、个性化培养基开发和生物反应器培养工艺等方面进行了深入研究.甘肃省动物细胞工程技术研究中心与口蹄疫疫苗生产企业合作开展了口蹄疫疫苗全悬浮培养工艺研究,得到了无血清全悬浮培养型细胞,并对口蹄疫病毒敏感.现将细胞驯化过程和驯化后细胞的质量评价情况进行交流.
1 材料与方法
1.1 材料
BHK21细胞(ATCC引进,编号:CCL-10,代次:P53),MEM、DMEM/F12和 Anti-Clumping Agent(Invitrigen),BFPM-BHK21无血清培养基(兰州百灵),新生牛血清(NBCS,兰州民海),PF-68、Hoechst33258荧光染色液(Sigma),无菌与支原体培养法检查培养基(北京三药),病毒检查阳性对照(中监所)、病毒荧光抗体结合物(VMRD)和细胞(本室保存);SPF级种蛋(斯帕法斯),SPF级BALB/c Nude 裸鼠(维通利华),SPF级BALB/c乳鼠和成鼠(甘肃中医学院实验动物中心)等.
2 方法
2.1 BHK21细胞的复苏和检定
用含10%NBCS的MEM复苏引进的BHK21细胞,待生长至致密单层后传代,按1∶6分瓶比例连续传代培养两代后冻存备用.
2.1.1 细胞鉴别
复苏后用倒置显微镜直接观察,形态与ATCC的形态图对比;用常规方法制备染色体标本,统计50个处于中期分裂相的细胞染色体数目.
2.1.2 生长特性
按文献方法[3].
2.1.3 无菌和支原体检查
按文献方法检查[4].
2.2 悬浮培养驯化
2.2.1 低血清适应培养
复苏P56代冻存的细胞,用10%NBCS的MEM培养2代血清降至8%.再逐步用DMEM/F12替代MEM并降低血清浓度.血清降到3%时在培养液中加5%~10%条件培养基,传代分瓶比例以48 h生长成致密单层为宜.
2.2.2 低血清悬浮驯化
适应3%NBCS低血清培养的P77代以后细胞,逐步用无血清培养基替代DMEM/F12,降低分瓶比例.收集悬浮在培养液中细胞和贴附性不好的细胞,也可用胰酶轻度消化后收集剩余细胞,调整细胞密度为(3~5)×105/mL.在培养液中补加0.03%PF-68和0.02%的Anti-Clumping Agent置110 r/min摇床,培养48 h离心置换一半培养液.
2.2.3 无血清培养悬浮培养
待细胞密度达2×106/mL以上离心后换用无血清培养基培养,每72 h传代一次.传代接种密度为5×105/mL,至细胞形态和生长规律趋于稳定后冻存.冻存密度为(1.0~1.5)×107/mL,冻存液中加20%NBCS和10%DMSO.
2.3 悬浮细胞的检定
2.3.1 细胞复苏和活力检查
在无血清培养基中加20%NBCS复苏冻存的悬浮细胞,第二代加5%NBCS,以后直接用无血清培养基培养.用台盼蓝染色法检查复苏细胞活力.
2.3.2 染色体核型
染色体核型同2.1.1.
2.3.3 生长和代谢特性
连续检测细胞以3×105/mL接种,在110 r/min摇床批培养每24 h的活力、密度以及培养液中葡萄糖、乳酸、谷氨酰胺和氨的量,绘制细胞生长曲线,计算代谢速率[5].
2.3.4 无菌、支原体、病毒和致瘤性检查
无菌、支原体、病毒和致瘤性检查依据文献[4].
2.4 生物反应器培养
2.4.1 批培养
细胞以5.0×105/mL密度接种到5 L反应器中,培养液体积5 L,反应器参数:温度37 ℃、转速100 r/min、溶氧50%、pH 7.20.
2.4.2 流加培养
初始培养体积2 L和密度1.0×106/mL接种,按2.4.1的方法培养,细胞密度(2.5~3)×106/mL时补培养基1.5 L,再培养至细胞密度(3.5~4)×106/mL时再补液1.5 L.
3 结果
1) 从ATCC引进的BHK21细胞形态呈长梭形和不规则形,与ATCC公布的细胞图片一致[6],染色体众数为42±2为66%,生长曲线呈“S”型曲线,最大增殖浓度达5.03×105/mL,倍增时间为17.99 h.无菌和支原体检查为阴性.
2) 运用逐步改变培养基和降低血清浓度的方法驯化,BHK21细胞能适应低血清培养,细胞形态从最初的长梭形变成短梭形或近圆形,生长速度也减缓分瓶比例降至1∶4,48 h才能长成致密单层.悬浮培养的前期细胞有严重的结团现象,在锥形瓶瓶壁上有肉眼可见的贴壁生长细胞层,在无血清培养基中传代10次后细胞生长变快,形态趋于较均一的圆形,见图1.
3) 驯化的悬浮培养型BHK21细胞复苏活力达92%以上,细胞呈较均一的圆形.染色体众数为42±2为54%,核型为12M+19SM+11T,与驯化前的贴壁细胞一致.生长曲线呈“S”型,最大增殖浓度为6.64×106/mL,倍增时间为17.73 h.在对数生长期葡萄糖、乳酸、谷氨酰胺、谷氨酸和氨的比代谢率为-0.27 mg/106cells·24h、0.34 mg/106cells·24h、-0.54 umol/106cells·24h、-0.04 umol/106cells·24h和0.55umol/106cells·24h.无菌和支原体检查为阴性.细胞冻融的上清液接种Vero、BHK21和MRC-5细胞,没有细胞病变和鸡红细胞吸附现象.接种鸡胚后,鸡胚存活100%(10/10),尿囊液血凝试验为阴性;接种乳鼠和成鼠后,动物100%存活(20/20),且没有出现异常反应;用荧光抗体结合物检查BVDV、BAV-3、BPV、PI-3、REO和PPV均未呈现特异性荧光,表明细胞未受外源病毒污染.裸鼠成瘤率100%(10/10)且呈进行性生长.
4) 驯化的BHK21细胞在5 L生物反应器中进行批培养和流加培养,密度可达5.71×106/mL和6.63×106/mL,见表1.在650 L生物反应器中培养口蹄疫病毒,90%以上细胞病变时间为13 h~18 h,146 s在2.45μg/mL ~4 μg/mL.
表1 5 L生物反应器培养BHK21悬浮细胞的结果

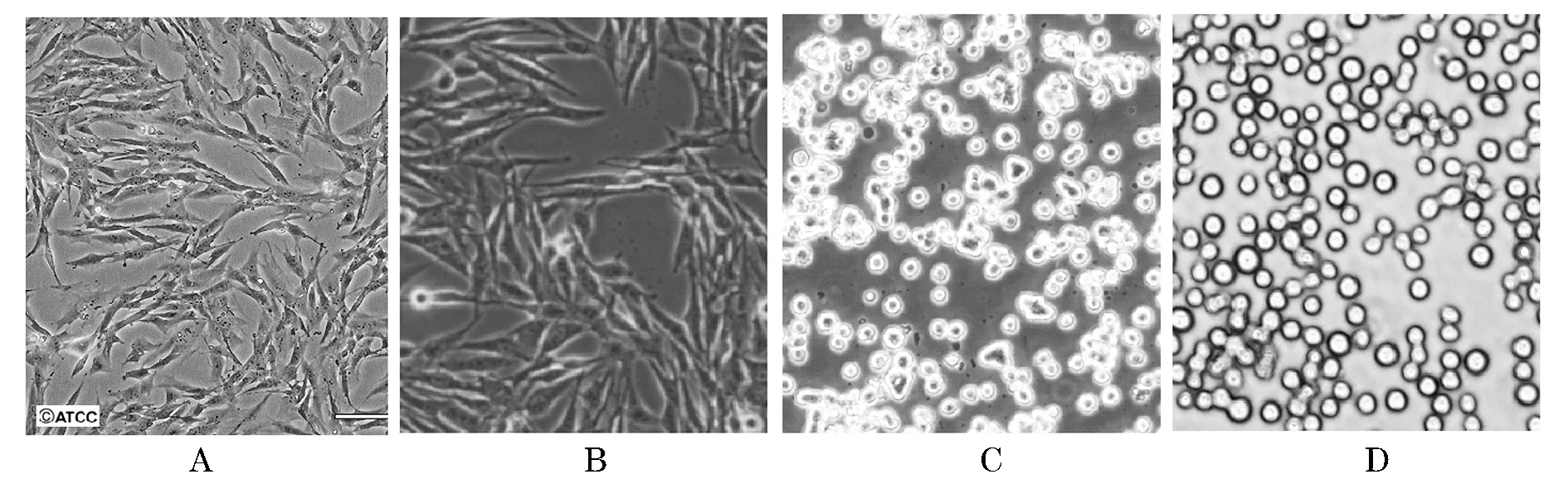
图1 BHK21细胞(A.ATCC;B.引进后复苏;C.悬浮驯化前期;D.完全悬浮培养)
4 讨论
生物反应器无血清悬浮培养技术运用于疫苗生产,不仅会节省大量场地和人力,还可减化纯化工艺,降低动物注射后的副反应,提高了产品的质量,是疫苗行业追求的目标.驯化得到无血清全悬浮高密度培养的细胞是工艺关键.逐步降低血清浓度适应悬浮培养的驯化方法,不改变细胞的遗传特性,是得到病毒高效表达细胞株的最有效方法之一.BHK21贴壁培养时对培养基的要求较低,在5%~10%NBCS时MEM能满足需要,血清加量减少时需要用营养更丰富的DMEM/F12.培养过细胞的培养液即条件培养基中有细胞的分泌物,这些分泌物对细胞度过冻存、复苏前期、低血清等“苛刻”条件有保护作用[7-8].悬浮培养的无血清培养基中一般都含有抗剪切力和促分散的成分.在悬浮驯化前期培养液还没有完全用无血清培养基时需要添加PF-68和Anti-Clum-ping Agent等,可提高细胞的存活率.驯化的细胞用含20%NBCS复苏的活力与不含血清的基本一致,但是含血清复苏后前两代生长明显快,此后无血清复苏的也没有差别.在相同的细胞量接种时流加培养的细胞利用培养基效率高、生长快.
细胞作为疫苗生产的基质,其质量直接影响疫苗的质量和安全性.一株细胞用于生产前必须进行全面的生物学研究和质量评价[9].评价内容包括历史来源、培养及驯化过程、细胞鉴别、复苏后活力、生长特征、微生物污染和内外源病毒因子检查,用于人用疫苗生产的细胞株还要进行活细胞的致瘤性和致癌性检查,有的还要进行均一性及传代稳定性检查.
本研究驯化的全悬浮培养型BHK21细胞的来源历史清楚,有较高的复苏活力,细胞没有被细菌、真菌和支原体等微生物污染.通过内、外源病毒因子检查,排除了致细胞病变的病毒、致红细胞吸附的病毒和致鸡胚、乳鼠和成鼠异常反应的病毒以及传代过程中使用胰蛋白酶、牛血清可能造成的病毒污染.驯化的细胞适用生物反应器高密度培养,对口蹄疫病毒敏感,能用于口蹄疫疫苗研究和生产.由于BHK21细胞本身具有很强的致瘤性,驯化后仍具有致瘤性,用于人用生物制品的生产还需要进行细胞碎片和DNA的致癌性研究.
