超声预处理对大豆蛋白酶解物结构及抗氧化活性的影响
2018-10-29王昱婷赵青山张晓松
许 晶,韩 东,王昱婷,赵青山,张晓松,金 花*
(东北农业大学理学院,黑龙江 哈尔滨 150030)
大豆常被人们称为“绿色牛乳”,这是因为大豆中含有丰富的蛋白质和油脂。大豆蛋白因其提取成本低、含量高、营养效价好,并且含有多种人体必需氨基酸,已成为人们所青睐的优质植物蛋白,被广泛应用于食品工业中[1]。同时,大豆蛋白经酶水解后的产物——大豆肽具有较强的还原能力、清除自由基能力、金属离子螯合能力和抗脂质过氧化作用,能在一定程度上清除机体内产生的多余自由基,延缓机体的衰老,降低各种老年性疾病发生的概率[2]。
蛋白质水解改性常用的方法包括酸水解法、碱水解法和酶水解法。其中蛋白质酶解改性法反应条件温和、专一性强、安全无毒,且不影响蛋白营养价值,被认为是蛋白质改性的最佳方法[3-8]。而且研究表明经适度酶解改性后,大豆蛋白的生物活性会较原始蛋白明显增强[9]。因此,如何调控酶解条件,实现适宜水解,进而获得最佳生物活性的大豆蛋白水解产物成为近些年人们研究的热点。Lamsal等[10]发现大豆蛋白酶解物的生物活性主要受其水解度、蛋白酶酶切位点和底物蛋白特性的影响。张宇昊等[11]则利用碱性蛋白酶水解花生蛋白,对酶解温度、时间、pH值和底物浓度等酶解条件进行调控,制备出理想水解度的蛋白酶解物。然而大豆蛋白的三级和四级结构紧密,这使得大豆蛋白酶解效率降低,酶解物水解度不高。所以,科学家们采用了多种预处理手段以提高大豆蛋白酶解效率[12-14]。超声预处理法是利用高频声波的剪切力和机械能所产生的空穴作用,对球状蛋白的结构和性质进行修饰,进而提高球状蛋白的酶解效率[15]。据报道,高强度超声预处理会提高大豆分离蛋白的乳化性[16]。Wu Jinju等[17]还发现经超声预处理后,大豆分离蛋白酶解物的抗氧化活性较未处理样品有所增强。
大豆蛋白按生理功能的差别分为贮藏蛋白(约占90%)和生物活性蛋白,其中两种主要的贮藏蛋白分别为大豆球蛋白(11S)和β-伴大豆球蛋白(7S),约占大豆蛋白总贮藏蛋白的70%。本课题组前期已经探索完善了大豆球蛋白和β-伴大豆球蛋白的超声预处理及酶解工艺,确定了制备高抗氧化活性大豆球蛋白和β-伴大豆球蛋白的最佳超声酶解工艺条件[18]。本研究则以大豆球蛋白和β-伴大豆球蛋白为原料蛋白,采用超声预处理和酶解改性相结合的方法,以最佳工艺条件制备大豆球蛋白和β-伴大豆球蛋白酶解物,并对其结构进行初步分析和表征,探讨超声预处理对蛋白酶解物结构的影响,初步分析超声预处理提高大豆蛋白酶解物抗氧化活性的原因,以期为大豆蛋白的有效利用提供理论参考。
1 材料与方法
1.1 材料与试剂
低温脱脂豆粕 黑龙江省哈高科大豆食品有限责任公司。
碱性蛋白酶(酶活力为2.0×105U/g) 北京奥博星生物技术有限责任公司;其他试剂均为国产分析纯。
1.2 仪器与设备
TU-1901双光束紫外-可见分光光度计 北京普析通用仪器有限责任公司;EL20实验室pH计 梅特勒-托利多仪器(上海)有限公司;RLPHR 1-4 LSC小型冷冻干燥机 北京博劢行仪器有限公司;SC-3610型低速离心机 安徽中科中佳科学仪器有限公司;JY92-2D超声波细胞粉碎机 宁波新芝生物科技股份有限公司;ALPHA-T傅里叶变换红外光谱仪 美国Bruker公司;LS55荧光分光光度计 英国PerkinElmer公司;S-3400扫描电子显微镜 日本日立高新技术公司。
1.3 方法
1.3.1 大豆球蛋白和β-伴大豆球蛋白超声预处理工艺
参考本课题组前期研究方法[18-19],从低温脱脂豆粕中提取的大豆球蛋白和β-伴大豆球蛋白,并分别以大豆球蛋白和β-伴大豆球蛋白的最佳超声工艺进行预处理。将大豆球蛋白和β-伴大豆球蛋白分别与蒸馏水以3∶100(m/V)的比例混合,置于锥形瓶中,室温(25 ℃)持续搅拌1 h。然后放入超声波处理器探头(φ=0.636 cm),以20 kHz分别对大豆球蛋白和β-伴大豆球蛋白进行超声预处理,具体超声条件如下:大豆球蛋白超声功率200 W、超声时间30 min、超声温度45 ℃;β-伴大豆球蛋白超声功率100 W、超声时间30 min、超声温度50 ℃。超声时间2 s,间隔时间2 s,将超声预处理后的样品冷冻干燥,存储于密闭容器中备用。
1.3.2 大豆球蛋白和β-伴大豆球蛋白酶解工艺
分别准确称取一定量经超声预处理和未经超声预处理的大豆球蛋白和β-伴大豆球蛋白于圆底烧瓶中,加水配制成质量分数2%的底物溶液。将底物溶液置于水浴锅中,调节溶液至碱性蛋白酶最适酶解pH值(pH 9.0),并调节水浴锅至最适酶解温度45 ℃。持续磁力搅拌的情况下,加入碱性蛋白酶开始酶解,加酶量为24 000 U/g底物。酶解进行过程中,不断滴加0.50 mol/L的NaOH溶液,从而维持酶解样品pH 9.0。酶解4 h后,酶解液于沸水浴中灭酶活性10 min,然后将其冷却至室温,再向酶解液中加入1.0 mol/L HCl溶液,调pH值为4.3。之后,将酶解液4 000 r/min离心15 min,取上清液冷冻干燥,得产物粉末,粉末于4 ℃下密封保存备用。水解度的测定采用pH-stat法[20]。
1.3.3 大豆球蛋白和β-伴大豆球蛋白酶解物的荧光光谱测定
参考Bonomi[21]和Zhang Qiuting[22]等的测定方法,并稍加修改,以蛋白质中内源性荧光基团(色氨酸基团)为探针,测定大豆蛋白酶解物荧光光谱。将超声预处理、未处理的大豆球蛋白和β-伴大豆球蛋白酶解物用0.01 mol/L磷酸盐缓冲液(pH 7.0)配制成质量浓度为0.02 mg/mL的溶液。以λex=290 nm为激发波长,在300~460 nm范围内进行扫描,选择5 nm为激发狭缝和发射狭缝,进行荧光光谱测定。
1.3.4 大豆球蛋白和β-伴大豆球蛋白酶解物的傅里叶变换红外光谱测定
采用KBr压片法,准确称取超声预处理和未处理的大豆球蛋白和β-伴大豆球蛋白酶解物2 mg,加入0.2 g左右的KBr,充分研磨混匀、压片,在4 000~400 cm-1范围内测定傅里叶变换红外光谱[23-25]。
1.3.5 大豆球蛋白和β-伴大豆球蛋白酶解物的紫外光谱测定
将超声预处理、未处理的大豆球蛋白和β-伴大豆球蛋白酶解物用0.01 mol/L磷酸盐缓冲液(pH 7.0)配制成质量浓度为0.2 mg/mL的溶液。在240~360 nm范围内进行紫外光谱扫描,测定分辨率为0.1 nm[26]。
1.3.6 大豆球蛋白和β-伴大豆球蛋白酶解物的扫描电子显微镜观察
参照文献[27]方法,在5 kV加速电压下进行大豆蛋白酶解物微观形貌表征。测定前,用离子喷射器对超声预处理、未处理的大豆球蛋白和β-伴大豆球蛋白酶解物干燥粉末表面镀一层15 nm左右的金箔。
1.3.7 大豆球蛋白和β-伴大豆球蛋白酶解物游离巯基含量测定
参考Shimada[28]和Ellman[29]等的测定方法,并略加改动。准确称取5,5’-二硫双-2-硝基苯甲酸400 mg,加Tris-甘氨酸缓冲液(0.086 mol/L Tris-0.09 mol/L甘氨酸-4 mmol/L Na2EDTA,pH 8.0)稀释定容至100.0 mL,配制成浓度为0.01 mol/L的Ellman试剂。准确移取2.00 mL大豆蛋白酶解液与5 mL Tris-甘氨酸缓冲液均匀混合,再加入0.100 mL配制好的Ellman试剂,快速充分混匀溶液。室温(25 ℃)静置15 min,然后测定样品412 nm波长处吸光度A412nm。设定不加Ellman试剂的混合溶液为空白参比,测定空白组吸光度。游离巯基含量的计算如式(1)所示。
式中:D为稀释系数;ρ为蛋白质量浓度/(mg/mL)。
1.3.8 大豆球蛋白和β-伴大豆球蛋白酶解物的抗氧化活性测定
1.3.8.1 还原能力
参照You Lijun等[30]的测定方法,取1 mL酶解液与2.50 mL磷酸盐缓冲液(pH 6.6)和2.50 mL 10 mg/mL的K3(Fe(CN)6)溶液混合摇匀。将混合溶液50 ℃水浴20 min。然后,向溶液中加入2.5 mL体积分数10%的三氯乙酸溶液,3 500 r/min离心10 min。取上清液2.5 mL,与2.5 mL超纯水和0.5 mL体积分数0.1%的三氯化铁溶液混和均匀,室温静置10 min。以超纯水为空白,测定700 nm波长处吸光度,吸光度与样品还原能力呈正相关,以吸光度表征还原能力。
1.3.8.2 羟自由基清除能力
参照Amarowicz等[31]的测定方法,以Fenton反应测定大豆球蛋白和β-伴大豆球蛋白酶解物羟自由基清除率。取1.00 mL酶解液和1.00 mL FeSO4溶液(3 mmol/L),与1.00 mL H2O2溶液(3 mmol/L)均匀混合,避光静置10 min,然后向混合液中加入1.00 mL水杨酸乙醇溶液(3 mmol/L),继续避光静置30 min,测定混合样液510 nm波长处吸光度Ai。本实验以超纯水为空白组,超纯水替换水杨酸乙醇为对照组,分别测定空白组吸光度A0和对照组吸光度Aj,计算大豆球蛋白和β-伴大豆球蛋白酶解物羟自由基清除率(式(2))。

1.3.8.3 Fe2+螯合能力
参照Wang Xiansheng等[32]的测定方法。取1 mL酶解液与3.7 mL超纯水和0.1 mL FeCl2溶液(20 mmol/L)混合均匀,室温静置3 min。然后向混合液中加入0.2 mL菲洛嗪(5 mmol/L),搅拌10 min,测定562 nm波长处吸光度Ai。同时,以超纯水为空白,测定空白组吸光度A0,计算大豆球蛋白和β-伴大豆球蛋白酶解物Fe2+螯合能力(式(3))。
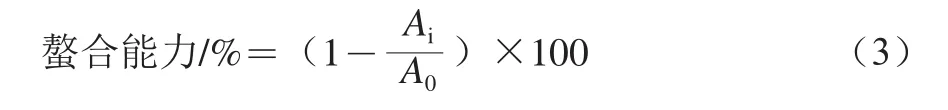
1.4 数据统计与分析
2 结果与分析
2.1 超声预处理对大豆球蛋白和β-伴大豆球蛋白酶解物结构的影响
2.1.1 大豆球蛋白和β-伴大豆球蛋白酶解物的荧光光谱分析
如图1所示,图中λ=360 nm的特征峰为色氨酸残基特征峰,荧光光谱峰位、峰强的改变都反映了色氨酸所处环境的变化[33-34]。本实验中,超声预处理后大豆球蛋白和β-伴大豆球蛋白酶解物的荧光光谱峰位无明显改变,但荧光强度均有所增加,这表明超声预处理后两种蛋白酶解物中的色氨酸所处的微环境极性增加,即内部色氨酸更多地暴露出来,说明蛋白质三级结构有所展开[35]。并且,蛋白质活性基团的暴露会有效增强其抗氧化活性[36],这对大豆球蛋白和β-伴大豆球蛋白酶解物的应用有积极作用。
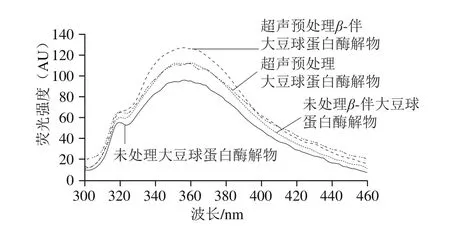
图 1 大豆球蛋白和β-伴大豆球蛋白酶解物的荧光光谱Fig. 1 Fluorescence spectra of glycinin and β-conglycinin hydrolysates
2.1.2 大豆球蛋白和β-伴大豆球蛋白酶解物的傅里叶变换红外光谱分析
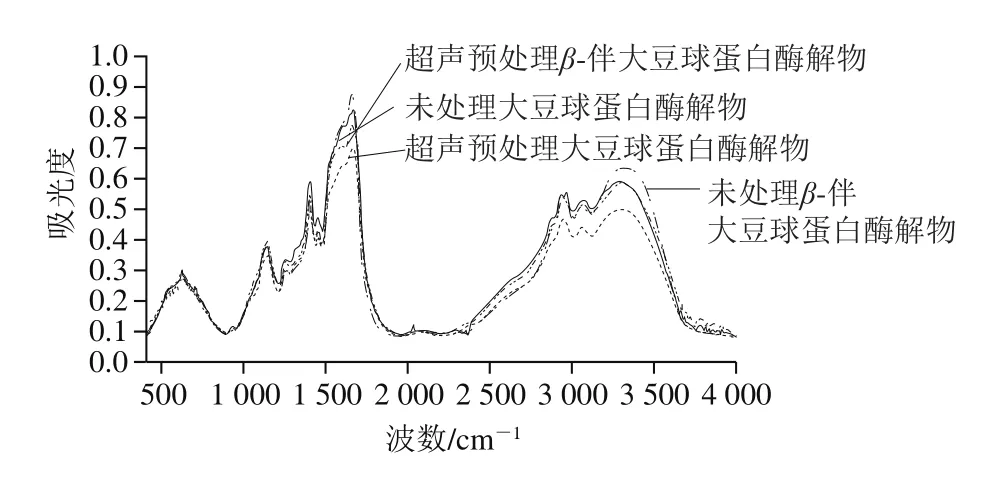
图 2 大豆球蛋白和β-伴大豆球蛋白酶解物的傅里叶变换红外光谱分析Fig. 2 Fourier transform infrared spectra of glycinin and β-conglycinin hydrolysates
图2为超声预处理前后大豆球蛋白和β-伴大豆球蛋白酶解物的傅里叶变换红外光谱图,其中波数1 600~1 700 cm-1的酰胺Ⅰ带频率与C=O键伸缩振动及肽键的C—N伸缩振动有关,可反映蛋白质的二级结构。校正傅里叶变换红外光谱基线、去卷积,对蛋白酶解物的酰胺Ⅰ带图谱作二阶导数拟合、Gauss峰形拟合,完全分辨重叠在一起的不同谱带(图3)。各子峰与蛋白质二级结构归属关系为:α-螺旋结构1 650~1 660 cm-1;β-转角结构1 660~1 680 cm-1和1 690~1 700 cm-1;β-折叠结构1 610~1 638 cm-1和1 680~1 690 cm-1;无规卷曲结构1 640~1 648 cm-1。
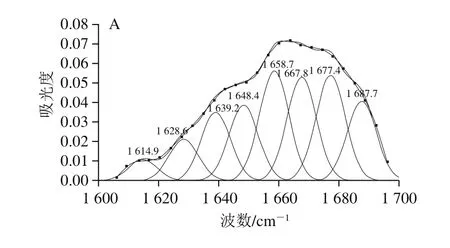
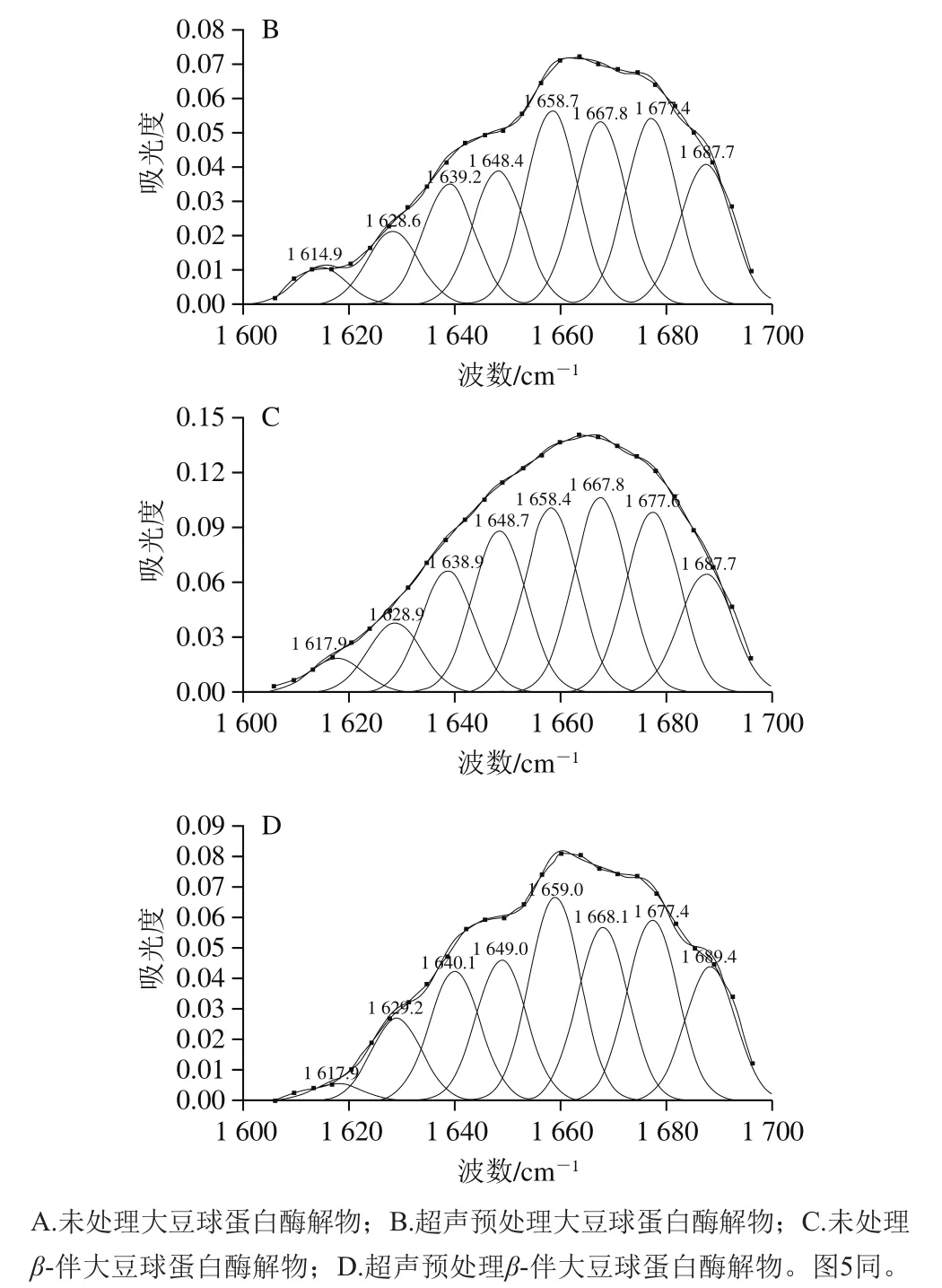
图 3 超声预处理前后大豆球蛋白和β-伴大豆球蛋白酶解物傅里叶变换红外光谱的酰胺Ⅰ带拟合图谱Fig. 3 Second-derivative Fourier transform infrared spectra in the amide I region and Gaussian curve fitting of glycinin and β-conglycinin hydrolysates
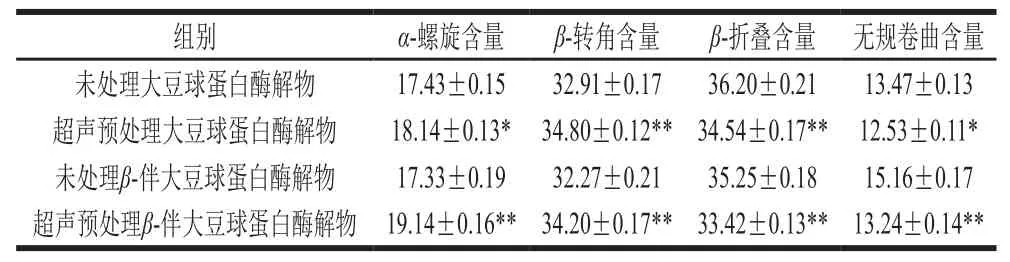
表 1 超声预处理前后大豆球蛋白和β-伴大豆球蛋白酶解物的二级结构含量Table 1 Contents of secondary structures of glycinin and β-conglycinin hydrolysates%
计算各子峰和总峰峰面积,求得各二级结构的含量(表1)。对比各二级结构含量发现大豆球蛋白和β-伴大豆球蛋白酶解物中β-转角、β-折叠结构含量最高,与已有报道一致[37-38]。超声预处理后,大豆球蛋白和β-伴大豆球蛋白酶解物中α-螺旋和β-转角结构含量显著升高,而无规卷曲和β-折叠结构含量显著降低。其中大豆球蛋白酶解物β-折叠结构含量降低1.66%,β-转角结构含量升高1.89%;β-伴大豆球蛋白酶解物β-折叠结构含量降低1.83%,β-转角结构含量升高1.93%,说明超声预处理能够使得蛋白质有序结构向无序结构转变。这是因为蛋白质的二级结构受局部氨基酸排列顺序以及蛋白质分子与其他分子交互作用的影响,在超声波空穴效应作用下,蛋白分子与其他分子的交互作用遭到破坏,从而发生解聚和重排,造成大豆蛋白二级结构含量发生变化。因此,超声预处理的大豆蛋白酶解后,其酶解物的二级结构含量也发生相应改变。超声预处理后酶解物β-折叠结构含量降低导致蛋白质疏水相关位点暴露,暴露的疏水性氨基酸能促进抗氧化肽与疏水性多不饱和脂肪酸相互作用,抑制脂质过氧化,进而提高蛋白质酶解物的抗氧化活性[39]。
2.1.3 大豆球蛋白和β-伴大豆球蛋白酶解物的紫外光谱分析

图 4 大豆球蛋白和β-伴大豆球蛋白酶解物的紫外光谱Fig. 4 Ultraviolet spectra of glycinin and β-conglycinin hydrolysates
由于蛋白质中的色氨酸、酪氨酸、半胱氨酸、组氨酸和苯丙氨酸残基侧链基团对紫外光有吸收作用,不同的氨基酸有不同的生色基团。其中,色氨酸和酪氨酸的紫外吸收峰在280 nm波长附近,苯丙氨酸的紫外吸收峰在257 nm波长附近[40]。所以,采用紫外光谱来研究蛋白侧链的变化(如酪氨酸残基的裸露程度),以探讨超声对大豆蛋白三级结构的影响。由图4可知,经超声预处理后,大豆球蛋白和β-伴大豆球蛋白酶解物的紫外吸收峰的峰型、峰位虽然没发生太大变化,但是相应吸收峰的强度明显增大。这可能是因为超声预处理的剪切力和空穴效应会破坏蛋白质的紧密结构,增加水解度,具有紫外吸收的芳香族氨基酸残基,如酪氨酸残基等暴露至蛋白质分子的表面,发色基团所处的环境由非极性向极性变化,大豆球蛋白和β-伴大豆球蛋白酶解物的三级结构部分展开[41]。
2.2 超声预处理对大豆球蛋白和β-伴大豆球蛋白酶解物微观形态的影响


图 5 大豆球蛋白和β-伴大豆球蛋白酶解物的显微结构Fig. 5 Microstructure of glycinin and β-conglycinin hydrolysates
如图5所示,未经超声预处理酶解物具有疏松结构,尺寸较大。而经超声预处理后酶解产物尺寸明显减小,样品质地更加疏松,紧密性有效降低。结果表明超声预处理能够有效破坏蛋白质紧密结构,获得结构疏松的处理产物,利于酶解反应进行,提高蛋白质水解度。
2.3 超声预处理对大豆球蛋白和β-伴大豆球蛋白酶解特性影响
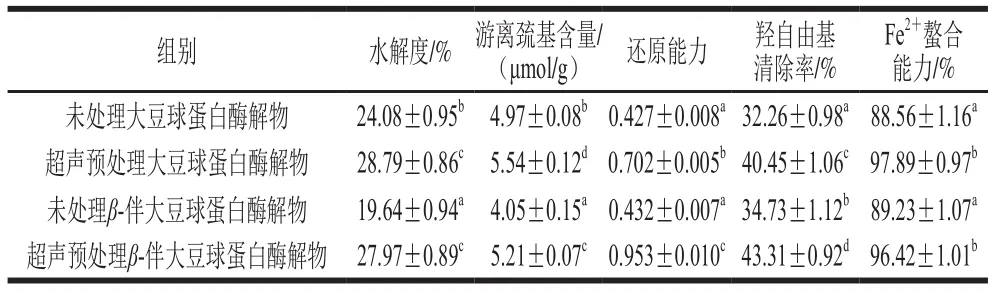
表 2 超声预处理大豆球蛋白和β-伴大豆球蛋白酶解物的水解度、游离巯基含量和抗氧化活性Table 2 Degree of hydrolysis, free free sulfhydryl group contents and antioxidant activity of glycinin and β-conglycinin hydrolysates
如表2所示,与未超声预处理的大豆球蛋白和β-伴大豆球蛋白酶解物相比,超声预处理后蛋白酶解物水解度显著升高(P<0.05),说明超声预处理能够有效提高酶解效率。本课题组前期研究结果表明过长的超声时间(30 min)、过高的超声温度(45 ℃)和超声功率(200 W)反而对提高水解度不利[18]。这是由于超声波的机械作用能够破坏蛋白质结构,暴露更多蛋白酶结合位点,促进蛋白酶解。可是过高的超声功率、过长的超声时间会进一步破坏蛋白酶结合位点和蛋白酶自身结构,使得蛋白酶活性下降,影响酶解效果,从而降低水解率[42]。同样,过高的超声温度也会破坏蛋白酶活性,所以适当升高超声温度才有利于蛋白水解度的提高。研究表明,蛋白质水解度与其抗氧化活性有一定关系,但不呈正相关[43-44]。因此,有效控制超声预处理条件和酶解工艺,才能获得适宜水解度的高抗氧化活性酶解产物。
超声预处理后大豆球蛋白和β-伴大豆球蛋白酶解物的游离巯基含量较未经超声预处理样品有显著升高。据报道,高静水压力会使大米蛋白结构部分展开,促使大米蛋白酶解物的游离巯基含量显著升高[45]。与之相似,超声-酶水解复合改性会使大豆球蛋白和β-伴大豆球蛋白结构疏松,水解度增大,酶解产物聚合度下降,蛋白质二级结构展开,包埋在蛋白质内部的巯基暴露出来,增加体系游离巯基的含量[46]。
经超声预处理后的大豆球蛋白和β-伴大豆球蛋白酶解物的抗氧化活性显著提高(P<0.05)。酶解物抗氧化活性提高的可能原因是超声波的空化效应使液体中产生气泡,气泡被挤压破裂后,瞬间产生强大的物理剪切力,这种作用力可以使蛋白质的结构改变,促使某些基团与酶切位点暴露出来,有利于和碱性蛋白酶的结合,水解得到具有较高抗氧化活性的肽段。超声预处理导致酶解物的空间构象改变,使得氨基酸基团与自由基接触变得容易,更多的电子与自由基未成对电子配对,使得羟自由基清除率有所增加。同时,酶解物结构上的改变,也使得抗氧化活性氨基酸更易与反应体系中Fe2+结合,组氨酸上的α-氨基和羧基与Fe2+形成五元环,α-氨基和咪唑基与Fe2+形成六元环,羧基和咪唑基与Fe2+形成七元环,Fe2+与组氨酸生成稳定的螯合物,提高了Fe2+的螯合能力[40]。
综上所述,超声-酶解复合改性是简单有效的蛋白质改性方法。在超声作用下,蛋白质结构的次级键和二硫键断裂,蛋白质二级、三级结构展开,紧密度下降。因此,超声预处理后,蛋白质聚集度下降,空间结构更加疏松,活性基团暴露,蛋白酶与底物结合位点增多,酶解反应更易进行,进而实现高抗氧化活性大豆球蛋白和β-伴大豆球蛋白酶解物的制备。
3 结 论
本研究采用超声-酶解复合改性的方法,利用碱性蛋白酶,对大豆球蛋白和β-伴大豆球蛋白进行酶解,并对其结构和抗氧化性进行初步分析和表征,主要结论如下:
傅里叶变换红外光谱表征发现在超声波空穴作用下,大豆球蛋白和β-伴大豆球蛋白酶解物中α-螺旋和β-转角结构含量明显升高,而无规卷曲和β-折叠结构含量明显降低,说明蛋白质分子发生解聚和重排,使其二级结构含量发生变化,疏水相关位点暴露。另外,大豆球蛋白和β-伴大豆球蛋白酶解物的荧光峰强和紫外峰强明显增加也进一步说明酶解物三级结构展开,包埋在蛋白质内部的疏水活性基团暴露出来[35,41],这对提高酶解物的抗氧化活性有积极意义。
超声预处理暴露酶解活性位点,有效提高酶解效率,使蛋白酶解物的水解度和游离巯基的含量较未处理样品大大升高。
超声预处理后,大豆球蛋白和β-伴大豆球蛋白酶解物的还原能力、羟自由基清除能力和Fe2+螯合能力均有显著提高,为大豆蛋白高效酶解改性提供技术参考和理论依据。
