温度对沉水植物腐解释放DOM及微生物群落多样性的影响
2018-10-29张毅敏朱月明巴翠翠汤志凯
杨 飞,姚 佳,张毅敏,朱月明,孔 明,巴翠翠,汤志凯
温度对沉水植物腐解释放DOM及微生物群落多样性的影响
杨 飞1,2,姚 佳1,3,张毅敏1*,朱月明1,孔 明1,巴翠翠3,汤志凯3
(1.环境保护部南京环境科学研究所,江苏 南京 210042;2.南京师范大学地理科学学院,江苏 南京 210097;3.常州大学环境与安全工程学院,江苏 常州 213164)
在5,10,20,35℃下研究了黑藻和马来眼子菜腐解过程中DOM的特性、细菌和真菌群落结构多样性的变化.结果表明,腐解结束时5,10,20,35℃下黑藻的干物质剩余量分别为初始干物质质量的59.13%、43.91%、32.61%和29.57%,马来眼子菜的干物质剩余量分别为初始干物质质量的69.13%、51.3%、30.87%和29.57%.升高温度一定程度上促进了植物有机碳和全氮释放,对全磷无明显影响(>0.05).采用平行因子分析法得到黑藻中含有2种类腐殖酸组分C1、C2和1种类蛋白质组分C3,马来眼子菜中含有3种类腐殖酸组分C1、C2和C3.温度升高使得腐解水体中DO和电导率的变化程度加剧,总体上4种温度下2种植物腐解水体中DO均呈现先下降后上升的趋势.通过高通量测序得到腐解前期(0~16d)参与黑藻和马来眼子菜腐解的主要细菌分别为变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes);腐解中后期(16~68d)参与黑藻和马来眼子菜腐解的细菌分别以厚壁菌门(Phylum Firmicutes)和变形菌门(Proteobacteria)为主,温度对细菌群落结构无明显影响,而参与2种植物腐解的真菌均以子囊菌(Ascomycetes)最为活跃.
沉水植物腐解;温度;溶解性有机物;细菌;真菌
在淡水湖泊和河流生态系统中,水生植物是主要的初级生产者,也是有机质的重要来源[1-2].但在一些湖泊中,由于食物链失衡,外源性营养盐不断输入累积,同时缺乏有效的管理,水生植物过量生长,植物残体不断淤积于湖底,导致湖泊迅速沼泽化[3-4].溶解性有机物(DOM)是有机质中最为活跃的组分,其结构和化学组成非常复杂,能影响水体中污染物的迁移和转化,加深水体污染程度[5].研究表明,在草型湖泊中水生植物腐解是内源DOM的最主要来源[6-7].
水生植物的分解和矿化过程既受外界环境因素如温度、物质循环、能量流动等影响[8-12],又受自身特性如木质素含量、氮含量、生长年限等影响[13-15].参与水生植物的微生物分解者主要是细菌和真菌群落[16],目前对在不同水生植物分解过程中的微生物群落组成和功能研究尚少,更缺少结合环境因素进行植物分解的研究,因此,本文选取典型沉水植物黑藻(夏季种)和马来眼子菜(春季种)为研究对象,根据湖泊上覆水的四季水温设置4种温度,模拟植物在不同季节温度下的腐解状况,分析温度和植物种类对腐解的影响,并利用荧光光谱技术分析其腐解释放DOM的特性差异,利用高通量测序测定植物腐解过程中细菌和真菌群落结构多样性,本研究有助于进一步认识细菌和真菌群落在水生植物腐解过程中的作用机制,为湖泊沼泽化的进一步研究和治理提供依据.
1 材料与方法
1.1 实验材料
黑藻和马来眼子菜采集于安徽省淮南市焦岗湖.于105℃杀青15min,80℃烘干至恒重,密封保存备用.实验水体为安徽省淮南市焦岗湖湖水.
1.2 实验设计

用HACH便携式溶氧仪LDO101测定水体DO;HACH便携式电导率仪CDC401测定水体电导率;植物全碳用重铬酸钾容量法测定;植物全氮、全磷通过H2SO4-H2O2消煮,用纳什比色法测定全氮,用钼锑抗分光光度法测定全磷.
用荧光分光光度计(CaryEclipse,美国安捷伦)测定样品的荧光光谱,首先稀释样品使得其在波长254nm处吸光度小于0.1[17].激发光源为150w疝弧灯,PMT电压为700V,信噪比>110,响应时间为0.05s,带通x=5nm、m=2nm,扫描速度为2400nm/min,扫描光谱进行仪器自动校正.激发波长x的扫描范围为200~450nm,发射波长m的扫描范围250~ 550nm.
1.3 数据分析
样品进行荧光光谱扫描时,以纯水作空白,将数据导出至Excel表格中,扣除空白、拉曼散射和瑞利散射后,使用带有DOMFlour工具包的matlab 7.8软件进行平行因子分析.采用SPSS 20.0和Origin 8.1处理分析图形.
采用Olson指数衰减方程:
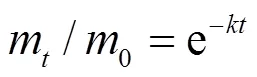
式中:0为植物样品初始干质量单位;m为时间植物样品干质量单位;为分解速率常数;表示分解时间单位
腐解率=(试验前干质量-试验后干质量)/
试验前干质量´100% (2)
2 结果与分析
2.1 不同温度下植物的腐解动态

图1 不同温度下黑藻和马来眼子菜腐解动态
水生植物的分解可以分为快速分解期和缓慢分解期[18-19].快速分解期主要是植物体内易溶有机颗粒和无机盐类的快速淋溶过程,缓慢分解期主要是难溶性物质在微生物以及酶作用下的分解过程[20].由图1可见,2种植物在4种温度下的腐解趋势相似,随着温度升高,黑藻和马来眼子菜的腐解速度加快,植物干物质剩余率逐渐降低.2种植物的快速分解期均为前4d,在5,10,20,35℃下,黑藻干物质分别减少了23.04%、51.3%、57.83%和59.57%,马来眼子菜的干物质分别减少了18.26%、40%、41.3%和29.57%;此后,2种植物的生物量呈现缓慢下降的趋势,在第68d,4个温度下黑藻的干物质剩余量分别为初始干物质质量的59.13%、43.91%、32.61%和29.57%,马来眼子菜的干物质剩余量分别为初始干物质质量的69.13%、51.3%、30.87%和29.57%,2种植物在4种温度下的腐解差异不显著(>0.05).
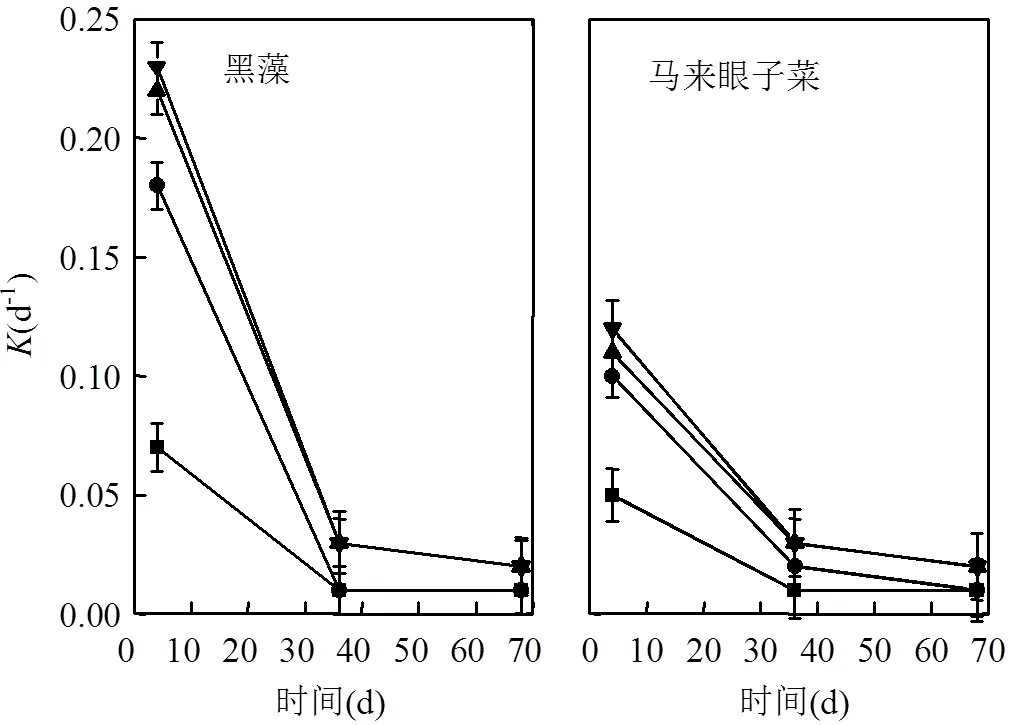
图2 不同温度下黑藻和马来眼子菜的分解速率随时间的变化
由图2可见,黑藻和马来眼子菜在前33d分解最快,黑藻在4个温度下的分解速率分别为0.07,0.18, 0.22,0.23d-1,马来眼子菜在4个温度下分解速率分别为0.05,0.1,0.11,0.12d-1;腐解4d后,2种植物的分解速率均快速降低,第33d后分解速率趋于稳定,从总体趋势看,温度越高,植物腐解越快,且黑藻比马来眼子菜腐解地更快,这可能是因为马来眼子菜根茎发达,温度对以木质素为主的根茎分解促进作用较小[21].
2.2 植物残体成分变化
腐解过程中,第0~33d黑藻和马来眼子菜残体中有机碳均呈上升趋势,在33~68d有机碳变化趋势在各个温度下有所差异.第33~68d,在5℃下黑藻和马来眼子菜残体有机碳略微下降,10,20,35℃下黑藻残体有机碳均稍有上升,而马来眼子菜有机碳在10和20℃下基本不变,35℃下缓慢减小.黑藻和马来眼子菜腐解过程中有机碳始终表现为35℃> 20℃> 10℃>5℃.
植物残体中全氮的变化趋势与有机碳不同,4种温度下2种植物残体全氮含量均呈现先快速上升后缓慢上升的趋势.实验结束时,4个温度下黑藻残体中全氮含量分别由初始的22.27mg/g上升27.45, 28.99,33.77,38.28mg/g,马来眼子菜残体中全氮由初始的18.07mg/g分别上升到26.87,27.08,30.55, 32.78mg/g.
实验第0~33d,2种植物残体中全磷均快速下降,黑藻中全磷含量由初始值8.2mg/g分别降低到7.24,6.96,6.56,6.02mg/g,马来眼子菜中全磷由7.14mg/g降低至6.48,5.9,5,5.12mg/g.第33~68d内,5和10℃下黑藻残体中全磷略有上升,而马来眼子菜中全磷继续保持下降的趋势,20和35℃下黑藻和马来眼子菜残体中全磷均持续缓慢降低.腐解过程中植物残体中全磷含量升高可能是微生物对磷进行固定以满足自身生长需求引起的[22-23].


图3 黑藻和马来眼子菜C、N、P含量随腐解时间的变化
2种植物在4种温度下的腐解过程中有机碳、全氮、全磷的变化差异均不显著(0.05),由于植物种类不同,黑藻和马来眼子菜初始C、N、P含量不同,温度对植物腐解释放有机碳和全氮有显著影响(0.05),对全磷无明显影响(0.05),这可能是因为较高的温度会加快植物有机质的矿化速度,促进了与植物残体N的矿化相关的微生物活动,如好氧纤维素分解菌等的生长,而磷主要存在于植物体内的一些生物活性物质中,这些物质易于分解,优先释放出磷,实验中后期基本为难降解物质[24-27].
2.3 不同温度下2种植物的物质组成
采用平行因子分析法对黑藻、马来眼子菜腐解的DOM样品进行测定,黑藻腐解分离出3种荧光组分(图4),分别是类腐殖酸组分C1(390nm/470nm)、以类腐殖酸为主的类富里酸组分C2(250nm、345nm/425nm)及以类色氨酸为主的类蛋白质组分C3(225nm、275nm/360nm),马来眼子菜腐解分离得到3种荧光组分(图5),分别是类腐殖酸组分C1(390nm/460nm)、以类腐殖酸为主的类富里酸组分C2(250nm、345nm/425nm)、C3(275nm/385nm、460nm)(表1).
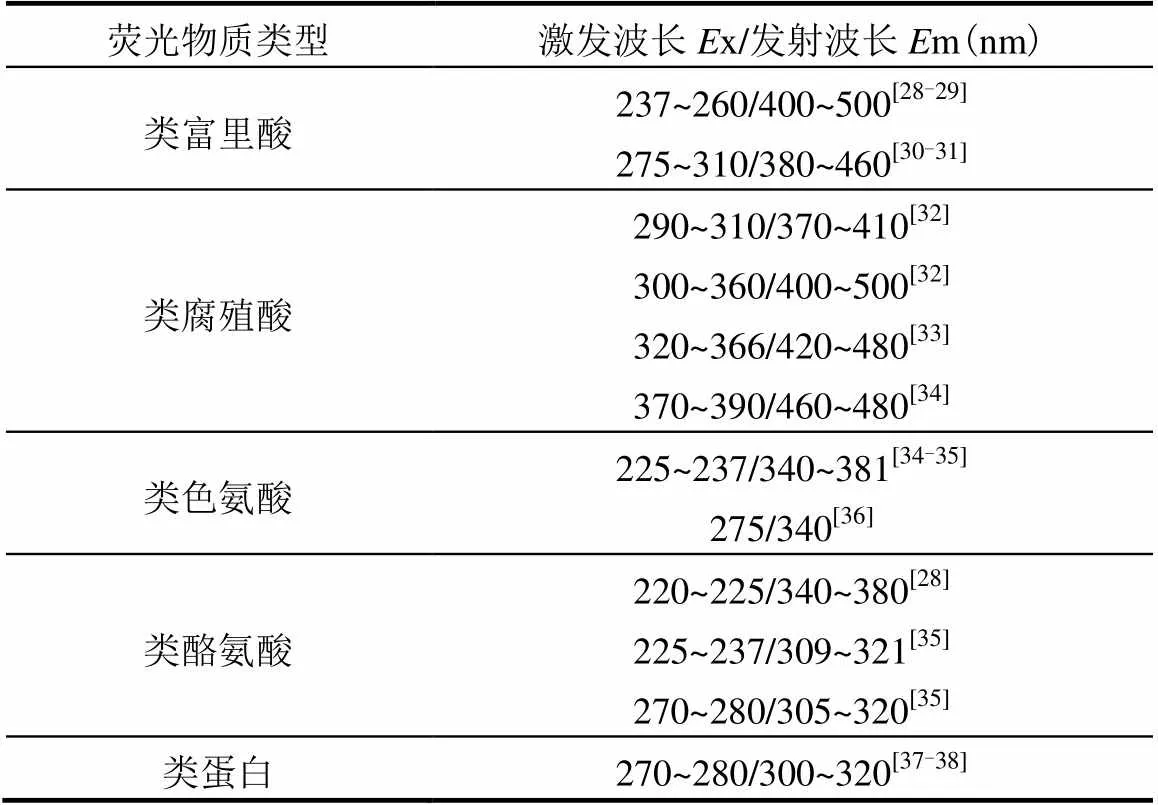
表1 DOM的主要荧光物质及其相应位置
利用平行因子分析法分析黑藻、马来眼子菜腐解DOM荧光矩阵所得的得分值max进行制图,max表示各类荧光峰的荧光强度或各样品中各组分的含量.由图5可以看出,随着腐解的进行,黑藻在4种温度下max值整体均呈现先升高后下降的趋势, 10℃下黑藻各样品中C1含量逐渐减少,C2、C3含量逐渐增多,35℃下腐解的黑藻样品中组分C1、C2含量普遍较高,C3含量最低,与5℃、20℃下各组分生成情况呈显著差异(<0.05).马来眼子菜在5℃和10℃下组分生成情况相似,C1含量较高,C2、C3含量降低,且在腐解过程中无明显变化.20℃下的马来眼子菜各样品C1组分先升高再降低,最后保持不变,C2、C3组分从16d起含量增大,35℃下的马来眼子菜各样品C1、C2、C3含量随腐解进行缓慢增大,在68d时突然减小,35℃下腐解的马来眼子菜中C1、C2组分生成情况与5,10℃呈极显著差异(<0.01), 20℃下腐解的马来眼子菜中C3组分生成情况与5,10℃呈显著差异(<0.05).
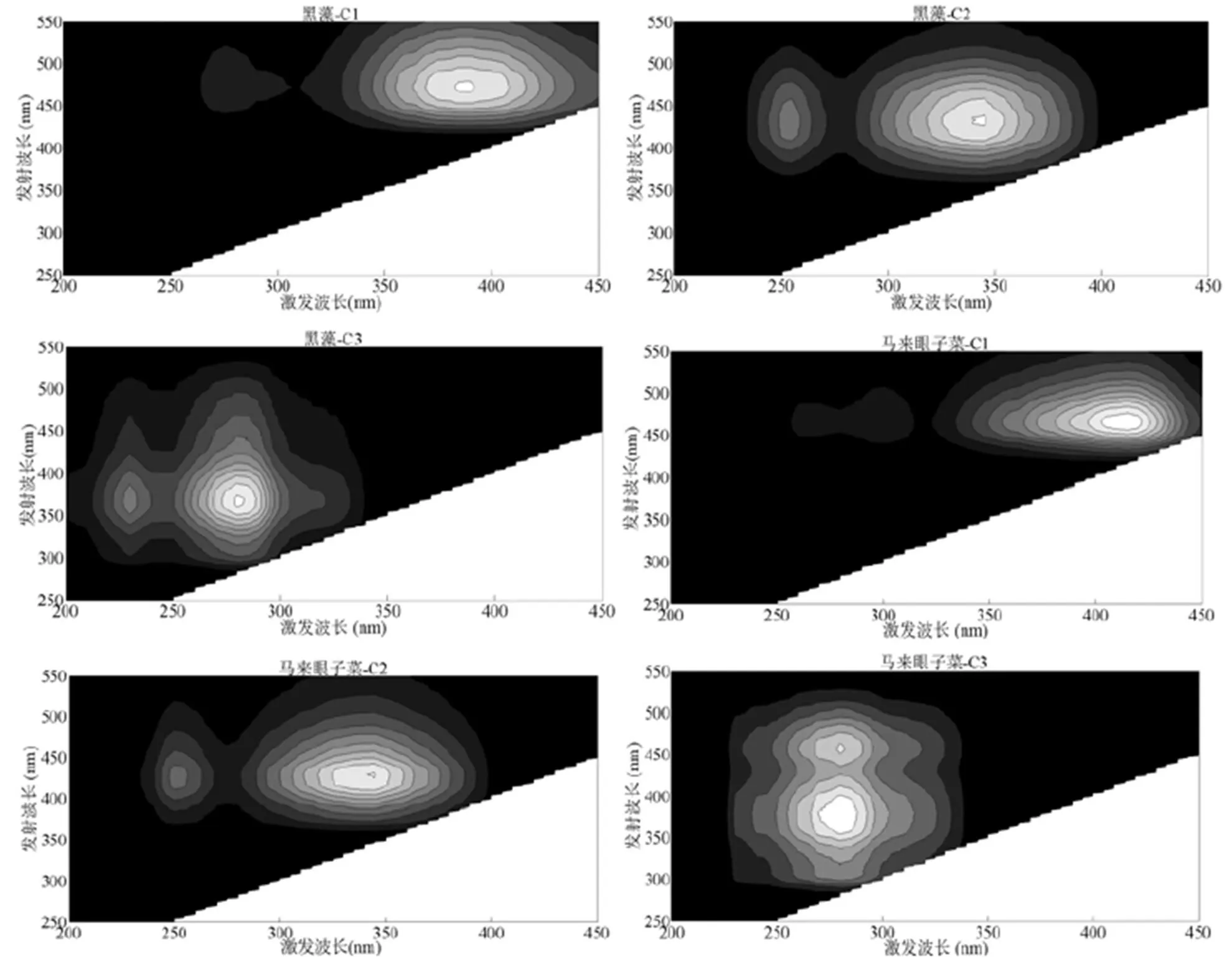
图4 黑藻和马来眼子菜腐解释放DOM的荧光光谱

图5 黑藻和马来眼子菜的荧光组分在4种温度下的Fmax值分布
从左至右依次为5,10,20,35℃
2.4 水体DO和电导率的变化
由图6可见,随着腐解的进行,4种温度下水体DO均呈现先下降后上升的趋势,黑藻腐解水体DO在5℃和10℃时均在第24d达到最低值,20℃和35℃时水体DO在第9d降到最低.实验前期,由于微生物分解植物残体,消耗水中氧气,导致DO下降,实验中后期植物腐解进程减缓,水体DO缓慢上升.由图可见,马来眼子菜腐解水体DO变化趋势与黑藻相似,但5℃和10℃时水体DO在第33d达到最低值,20℃和35℃时水体DO在第9d降到最低.各温度下空白组DO无明显差异(>0.05),低温组(5℃和10℃)与高温组(20℃和35℃)之间具有显著差异(0.05),这表明温度升高加快了植物的腐解,黑藻和马来眼子菜在5℃和10℃下的腐解无明显差异(>0.05),20℃和35℃下黑藻比马来眼子菜腐解地快.

图6 不同温度下黑藻和马来眼子菜腐解水体中DO的变化
随着腐解时间的增长,黑藻和马来眼子菜在4种温度下电导率的变化趋势无明显差异(>0.05),但35℃下植物腐解水体中电导率的变化情况与其他3种温度存在显著差异(0.05),35℃下2种植物腐解水体的电导率均为先升高后减小,但黑藻腐解水体的电导率在第16d达到最大值0.39s/m,马来眼子菜腐解水体中电导率在第4d达到最大值0.329s/m,这表明黑藻中矿物质和易溶解的导电物质含量更高[33],完全释放所需时间比马来眼子菜更长.
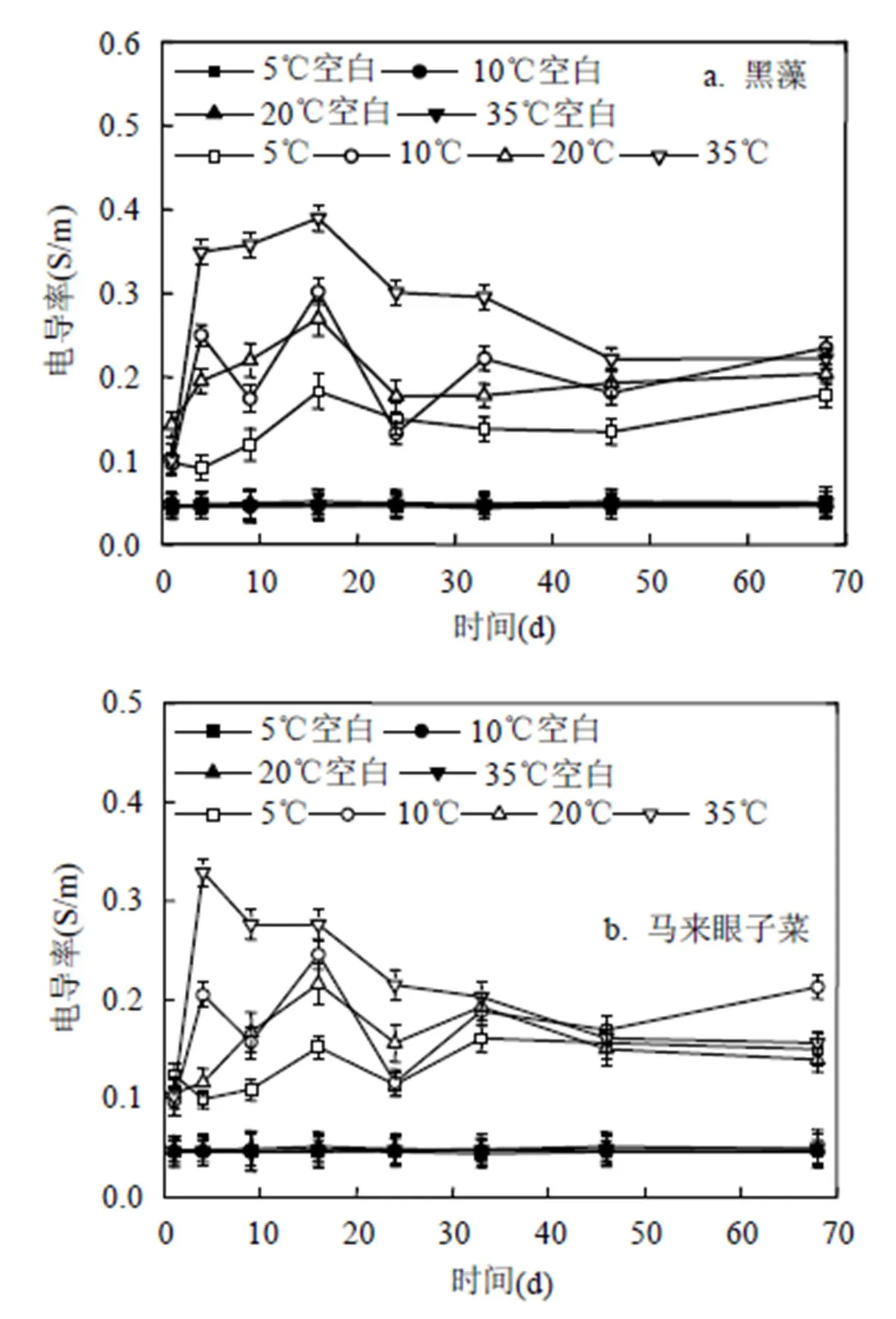
图7 不同温度下黑藻腐解和马来眼子菜水体中电导率的变化
2.5 植物腐解过程中微生物群落结构多样性和组成
2.5.1 腐解水体中微生物物种分布状况 Rank- abundance 曲线可用来解释物种多样性的两个方面,即丰度和均匀度.在水平方向,物种的丰度由曲线的宽度来反映,物种的丰度越高,曲线在横轴上的范围越大;曲线的形状反映了样品中物种的均度,曲线越平缓,物种分布越均匀.
腐解水体中细菌和真菌的Rank-abundance 曲线如图8、图9所示,可以看出细菌曲线的平滑程度较高,说明水体中细菌分布较均匀,真菌曲线平滑程度较低,说明真菌分布较分散.随着OTU等级的增加,曲线越来越宽,表明随着腐解的进行,水体中细菌分布越来越均匀.腐解第68d,黑藻腐解水体中细菌和真菌的物种丰度均表现为:HZ68_20 > HZ68_35 > HZ68_10 > HZ68_5,表明20℃下黑藻腐解释放的微生物物种丰度最高.腐解第16d,马来眼子菜腐解水体中细菌的物种丰度表现为:ML16_20 > ML16_35 > ML16_10 > ML16_5,真菌的物种丰度依次为ML16_35 > ML16_20 > ML16_10 > ML16_5,表明在较高温度下腐解的马来眼子菜释放的微生物物种丰度较高.
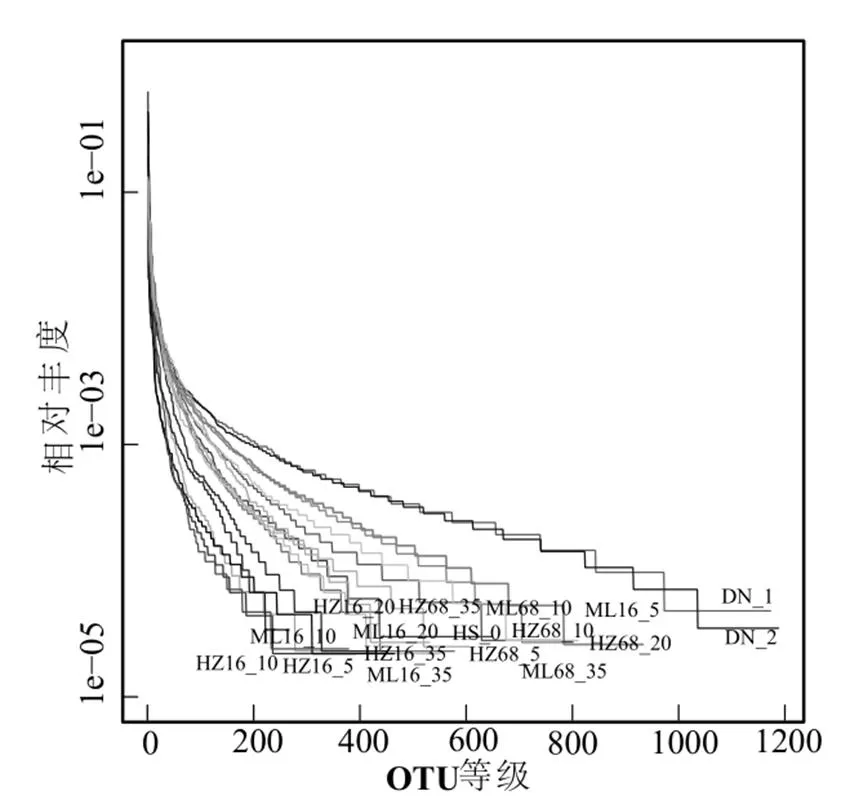
图8 腐解水体中细菌的Rank-abundance 曲线
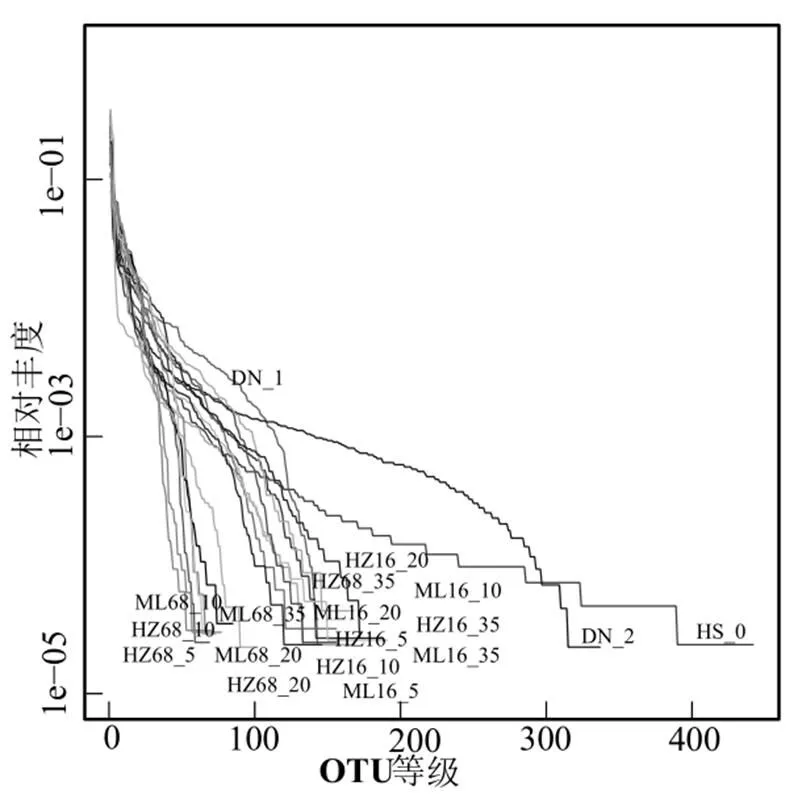
图9 腐解水体中真菌的Rank-abundance 曲线
2.5.2 微生物群落结构组成 各样品中所有序列在门水平上的相对丰度如图10所示,可以看出黑藻和马来眼子菜腐解主要释放出变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、硬壁菌门(Firmicutes)和软壁菌门(Tenericutes)等细菌.腐解0~16d,黑藻腐解水体中以变形菌门居多,马来眼子菜腐解水体中以拟杆菌门居多;腐解进行到68d,黑藻腐解水体中主要为厚壁菌门,马来眼子菜腐解水体中以变形菌门为主[39],温度对细菌群落结构无明显影响.
对2种植物腐解释放的优势菌门在科水平上进行系统发生分类分析,由图11可以得出,变形菌门包括莫拉氏菌科(Moraxellaceae)、毛螺菌科(Lachnospiraceae)、肠杆菌科(Enterobacteriaceae)、伯克氏菌科(Burkholderiaceae)、红螺菌科(Rhodospirillaceae)、螺杆菌科(Heliobacteriaceae)、螺杆菌科(Acidaminococcaceae)等,拟杆菌门包括黄杆菌科(Flavobactericaceae)、拟杆菌科(Bacteroidaceae)、(Prevotellaceae)等,硬壁菌门包括乳杆菌科(Lactobacillaceae)等.腐解0~16d,2种植物腐解水体中变形菌门的莫拉氏菌科(Moraxellaceae)和拟杆菌门的黄杆菌科(Flavobactericaceae)占据较大比例;腐解进行到68d,HZ68_5样品中变形菌门的毛螺菌科(Lachnospiraceae)和硬壁菌门的乳杆菌科(Lactobacillaceae)分别占26%和58%.
此外,通过扩增真菌ITS分析了植物分解过程中的真菌群落结构,如图11所示,参与植物腐解的真菌主要有子囊菌(Ascomycetes)、担子菌(Basidiomycetes)及少量接合菌(Zygomycetes),随着腐解的进行,子囊菌占比上升,ML68_10中子囊菌占75%,HZ68_20中子囊菌占90%,表明腐解第68d,在10℃下腐解的马来眼子菜和20℃下腐解的黑藻中以子囊菌最为活跃[40].

图10 细菌16S rRNA基因分类法在门分类水平上的相对丰度
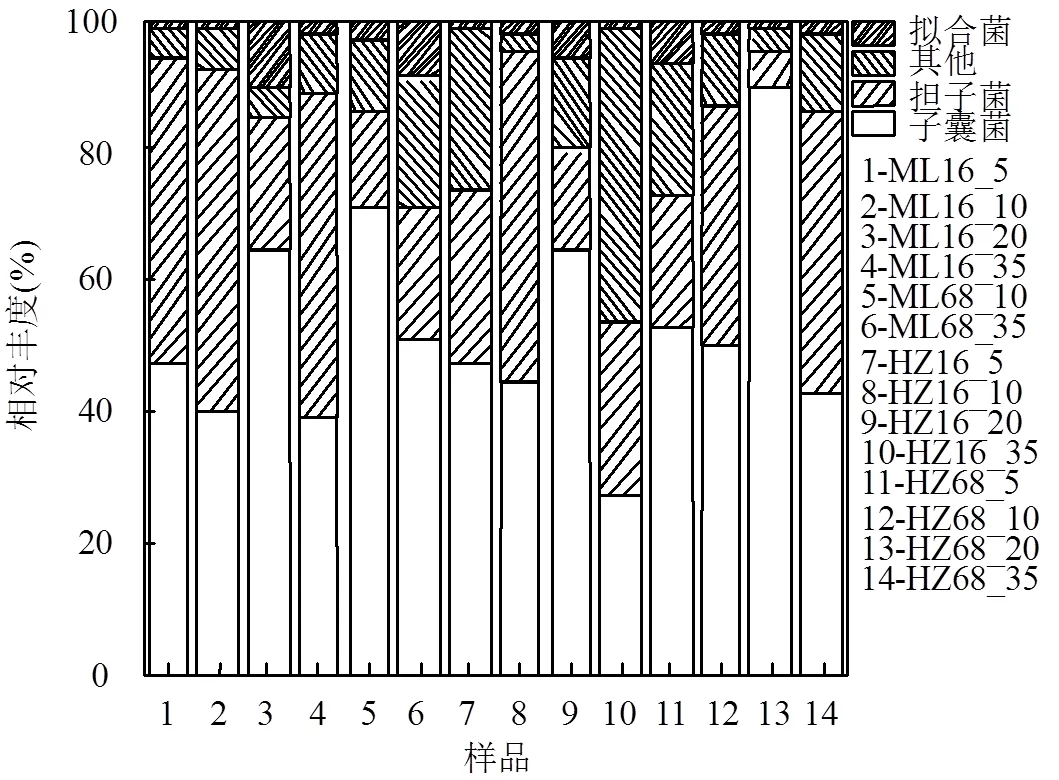
图12 真菌ITS基因分类法在门分类水平上的相对丰度
2.5.3 水中细菌多样性指数分析 利用Mothur对各个样本进行Alpha多样性分析,包括chao指数和shannon指数,chao指数反映样品中群落的丰富度,shannon指数反映群落的多样性,指数越大,表明样品中的物种越丰富.
Chao指数如图13所示,当序列达到5000条时,曲线随着序列的增加而变缓,序列达到20000条时,所有样本的Chao指数均进入平台期.黑藻腐解第68d时,Chao指数依次为HZ68_20 > HZ68_10 > HZ68_5 > HZ68_35,表明20℃下黑藻腐解产生的物种最丰富.腐解第16d时,黑藻和马来眼子菜在4个温度下的Chao曲线接近,此时,2种植物在4个温度下的腐解均不完全.Shannon指数如图14所示,测序开始后各样本的Shannon指数急速增加,在序列达到2000左右时,Shannon指数进入平台期,此时能够反映各样品的细菌群落的全部信息.
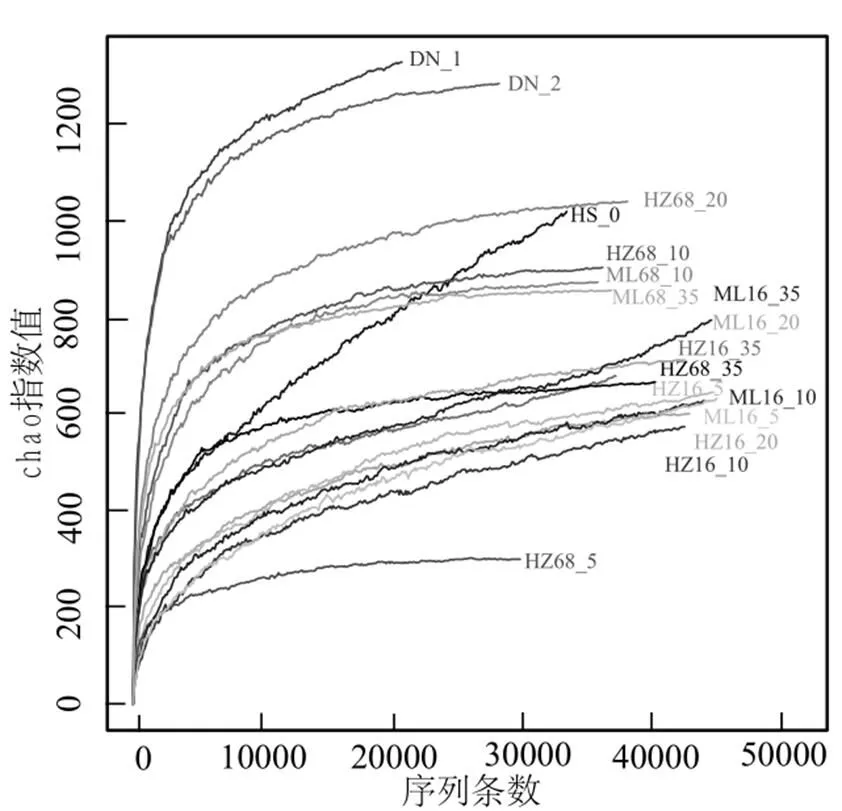
图13 Chao指数
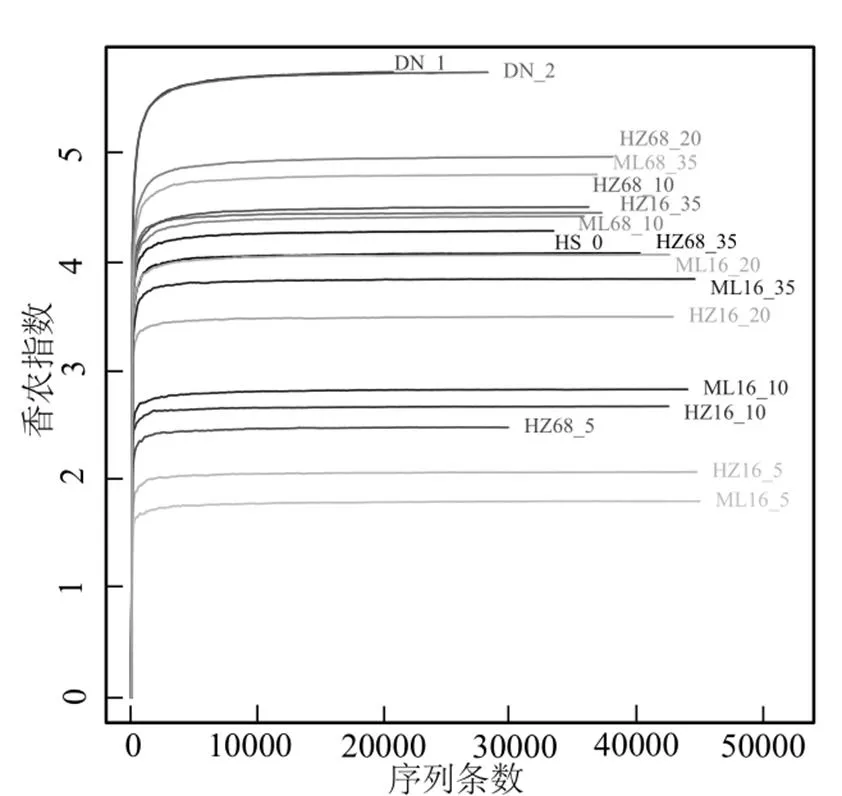
图14 Shannon指数
3 结论
3.1 黑藻和马来眼子菜在第0~33d内快速腐解,第33~68d内缓慢腐解,腐解结束时5、10、20和35℃下黑藻的干物质剩余量分别为初始干物质质量的59.13%、43.91%、32.61%和29.57%,马来眼子菜的干物质剩余量分别为初始干物质质量的69.13%、51.3%、30.87%和29.57%.
3.2 黑藻和马来眼子菜初始C、N、P含量不同,温度对植物腐解释放有机碳和全氮有显著影响(0.05),对全磷无明显影响(0.05).
3.3 采用平行因子分析法得到黑藻中含有2种类腐殖酸组分C1、C2和1种类蛋白质组分C3,马来眼子菜中含有3种类腐殖酸组分C1、C2和C3.
3.4 温度升高使得腐解水体中DO和电导率的变化程度加剧,总体上4种温度下2种植物腐解水体种DO均呈现先下降后上升的趋势.
3.5 腐解前期(0~16d),参与黑藻和马来眼子菜腐解的主要细菌分别为变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes);腐解中后期(16~68d),参与黑藻和马来眼子菜腐解的细菌分别以厚壁菌门(Phylum Firmicutes)和变形菌门(Proteobacteria)为主,温度对细菌群落结构无明显影响,而参与2种植物腐解的真菌均以子囊菌(Ascomycetes)最为活跃.
[1] 年跃刚,宋英伟,李英杰,等.富营养化浅水湖泊稳态转换理论与生态恢复讨论[J]. 环境科学研究, 2006,19(1):67-70.
[2] 潘慧云,许小花,高士祥.沉水植物衰亡过程中营养盐的释放过程及规律[J]. 环境科学研究, 2008,21(1):64-68.
[3] 秦伯强.太湖水环境演化过程与机理[M]. 北京:科学出版社, 2004:46-47.
[4] 尚士友,杜健民,李旭英,等.草型富营养化湖泊生态恢复工程技术的研究—内蒙古乌梁素海生态恢复工程试验研究[J]. 生态学杂志, 2003,22(6):57-62.
[5] Aiken G R, McKnight D M, Wershaw R L, et al. Humic substances in soil, sediment and water [M]. New York:Wiley-Interscience, 1985.
[6] Tzortziou M, Neale P J, Osburn C L, et al. Tidal marshes as a source of optically and chemically distinctive colored dissolved organic matter in the Chesapeake Bay [J]. Limnology Oceanography, 2008,53: 148-159.
[7] Zhang Y L, Liu X H, Wang M Z, et al. Compositional differences of chromophoric dissolved organic matter derived from phytoplankton and macrophytes [J]. Organic Geochemistry, 2013,55:22-37.
[8] Daniel S, Takashi A, Takeshi F, et al. Decomposition of dominant submerged macrophytes:implications for nutrient release in Myall Lake, NSW, Australia [J]. Ecology and Management, 2006,14(5):427- 433.
[9] 戴国华,吕宪国,杨 青,等.三江平原湿地主要优势植物枯落物分解过程与能量动态研究[J]. 湿地科学, 2008,6(1):29-33.
[10] 刘德燕,宋长春.外源氮输入对沼泽湿地小叶章枯落物性质及其早期分解的影响[J]. 湿地科学, 2008,6(2):235-241.
[11] 范航清,林 鹏.秋茄红树植物落叶分解的碎屑能量研究[J]. 植物学报, 1994,36(4):305-311.
[12] 柳新伟,刘 君.温度对藨草()分解的影响[J]. 湿地科学, 2013,11(3):334-338.
[13] Barik S K, Mishra S, Ayyappan S. Decomposition patterns of unprocessed and processed lingo cellulosicsin a freshwater fish pond [J]. Aquatic Ecology, 2000,34(2):185-204.
[14] Noah F, Joseph M C, Kendra M. Litter quality and the temperature sensitivity of decomposition [J]. Ecology, 2005,86(2):320-326.
[15] Takashi A, Le H N. Effects of rhizome age on the decomposition rate ofrhizomes[J]. Hydrobiologia, 2002,485(1-3): 205-208.
[16] Baldock J A, Oades J M, Nelson P N, et al. Assessing the extent of decomposition of nateral organic materials using solid-state 13C NMR spectroscopy [J]. Australian Journal of Soil Research, 1997,35(5): 1061-1084.
[17] Cox L, Celis R, Hermonsin M C, et al. Effect of organic amendments on herbicide sorptionas as related to the nature of the dissolved organic matter [J]. Environmental Science & Technology, 2000,34(21): 4600-4605.
[18] 叶 春,王 博.沉水植物黑藻早期分解过程及影响因素研究[J]. 中国农学通报, 2009,25(17):260-264.
[19] 顾久君,金朝晖,刘振英.乌梁素海沉水植物腐烂分解试验研究[J]. 干旱区资源与环境, 2008,22(4):181-184.
[20] 武海涛,吕宪国,杨 青,等.三江平原典型湿地枯落物早期分解过程及影响因素[J]. 生态学报, 2007,27(10):4027-4035.
[21] 柳新伟.温度对芦苇不同部位分解动态的影响[J]. 生态环境学报, 2009,18(3):1042-1044.
[22] Ozalp M, Conner W H, Lockaby B G. Above-ground productivity and litter decomposition in a tidal freshwater forested wetland on Bull Island, SC, USA [J]. Forest Ecology and Management, 2007,245(1-3): 31-43.
[23] 曹 勋,韩睿明,卓婷曦,等.冬季水生植物分解过程及其对水质的影响研究[J]. 农业环境科学学报, 2015,34(2):361-369.
[24] Song N, Yan Z S, Cai H Y, et al. Effect of temperature on submerged macrophyte litter decomposition within sediments from a large shallow and subtropical freshwater lake [J]. Hydrobiologia, 2013,714: 131-144.
[25] Thullen J S, Nelson S M, Cade B S, et al. Macrophyte decomposition in a surface-flow ammonia-dominated constructed wetland:rates associated with environmental and biotic variables [J]. Ecological Engineering, 2008,32(3):281-290.
[26] Bornette G, Puijalon S. Response of aquatic plants to abiotic factors:a review [J]. Aquatic Sciences, 2011,73(1):1-14.
[27] Bosatta E, Gren G. Soil organic matter quality interpreted thermodynamically [J]. Soil Biology and Biochemistry, 1999,31(13): 1889-1891.
[28] 虞敏达,何小松,檀文炳,等.城市纳污河流有色溶解有机物时空演变特征[J]. 中国环境科学, 2016,36(1):133-142.
[29] Leenheer J A, Croue J. Peer reviewed: characterizing aquatic dissolved organic matter [J]. Environmental Science & Technology, 2003,37(1): 18A-26A.
[30] Murphy K R, Ruiz G M, Dunsmuir W T, et al. Optimized parameters for fluorescence-based verfication of ballast water exchange by ships [J]. Environmental Science & Technology, 2006,40(7):2357-2362.
[31] 冯伟莹,朱元荣,吴丰昌,等.太湖水体溶解性有机质荧光特征及其来源解析[J]. 环境科学学报, 2016,36(2):475-482.
[32] 黄昌春,李云梅,王 桥,等.基于三维荧光和平行因子分析法的太湖水体CDOM组分光学特征[J]. 湖泊科学, 2010,22(3):375-382.
[33] 郭卫东,黄建平,洪华生,等.河口区溶解有机物三维荧光光谱的平行因子分析及其示踪特性[J]. 环境科学, 2010,31(6):1419-1427.
[34] 汪玲玲.三维荧光光谱技术在溶解性有机物研究中的应用[J]. 环境科学与管理, 2015,40(1):153-155.
[35] Bridgeman J, Bieroza M, Baker A. The application fluorescence spectroscopy to organic matter characterization in drinking water treatment [J]. Reviews in Environmental Science and Bio-Technology, 2011,10(3):277-290.
[36] Coble P G. Characterization of marine and terrestrial DOM in seawater using excitation-emission matrix spectroscopy [J]. Marine Chemistry, 1996,51(4):325-346.
[37] 宋晓娜,于 涛,张 远,等.利用三维荧光技术分析太湖水体溶解性有机质的分布特征及来源[J]. 环境科学学报, 2010,30(11):2321- 2331.
[38] 洪志强,熊 瑛,李 艳,等.白洋淀沉水植物腐解释放溶解性有机物光谱特性[J]. 生态学报, 2016,36(19):1-10.
[39] Gessner M O, van R G. Water fungi as decomposers in freshwater ecosystems//Bitton G,ed [J]. Encyclopedia of Environmental Microbiology. New York (online edition DOI:10.1002/0471263397. env314). 2003.
[40] Junpeng R J P, Lu Y H. Succession of bacterial populations during plant residue decomposition in rich field soil [J]. Applied and environmental microbiology, 2009,75(14):4879-4886.
Research on the dissolved organic matter and microbial community diversity of submerged macrophytes decomposed under different temperature.
YANG Fei1,2, YAO Jia1,3, ZHANG Yi-min1*, ZHU Yue-ming1, KONG Ming1, BA Cui-cui3, TANG Zhi-kai3
(1.Nanjing Institute of Environmental Sciences, Ministry of Environmental Protection, Nanjing 210042, China;2.School of Geographic Science, NanJing Normal University, Nanjing 210097, China;3.School of Environmental and Safety Engineering, Changzhou University, Changzhou 213164, China)., 2018,38(10):3904~3913
The characteristics of DOM, the variation of bacteria and fungi in the decomposed process ofandwere studied under four temperatures (5, 10, 20 and 35℃). The results showed that the remaining biomass ofwere 59.13%, 43.91%, 32.61% and 29.57%, the remaining biomass ofwere 69.13%, 51.3%, 30.8% and 29.57%. The concentration of C, N was promoted by rising temperature, and there was no obvious effect on(>0.05). Two humic-like components (C1and C2) and one protein-like component C3 were identified in. Three humic-like components (C1, C2 and C3 )were identified in. The variation of DO and CDC in the decomposed water were promoted by temperature. During 0~16d, the main bacteria involved in the decomposition ofandwere Proteobacteriaand Bacteroidetesrespectively. During 16~68d, the main bacteria involved in the decomposition ofandwere Phylum Firmicutesand Proteobacterespectively. The temperature had no obvious effect on bacteria community structure, and Ascomycetes was the major fungi during decomposition.
submerged macrophyte decomposition;temperature;dissolved organic matter;bacteria;fungi
X131.2
A
1000-6923(2018)10-3904-10
杨 飞(1984-),男,江苏常州人,环境保护部南京环境科学研究所,主要研究方向为水体污染与生态修复.发表论文10余篇.
2018-03-29
国家重大水污染治理专项(2017ZX07202006);江苏省环保科研课题(2016034);江苏省太湖水环境综合治理科研课题(TH2016402);中央级公益性科研院所基本科研业务专项—长江经济带突发事故环境风险分级与防控对策研究(GYZX170104)
*责任作者, 研究员, zym7127@163.com
