川西北不同沙化程度草地土壤细菌群落特征
2018-10-29杨秉珣董廷旭
杨秉珣, 刘 泉, 董廷旭
(四川绵阳师范学院 资源环境工程学院, 四川 绵阳621000)
微生物是土壤生态系统的重要组成部分,微生物参与碳、氮循环,有机化合物分解以及能量传输、运送等多种过程的维护和调节,是土壤生态系统中最具有生命活力的重要组成部分[1-2]。微生物群落多样性与土壤生态系统的结构、功能密切相关,在维持土壤肥力和土壤生态平衡中发挥着重要作用,其结构和功能对于周围环境条件特别敏感,是土壤变化的重要指示之一[3]。细菌作为微生物中含量最多、丰富度最高的类群,通常占土壤微生物的70%~90%,具有最为丰富的遗传多样性,能有效促进有机质分解、营养物质的释放,参与碳、氮等物质循环过程,维持了生态系统能量流动和物质循环[4-6]。在陆生系统中,细菌利用生产者提供的有机物质和代谢物作为营养来源,分解为简单的无机物,同时这些无机物又是生产者的营养来源。土壤中细菌多样性变化会影响土壤生态过程,例如养分循环等[7-8]。此外,土壤中细菌多样性变化还会受自然和人为因素的影响,例如植被、土壤养分、土地利用方式等。高通量测序作为第二代测序方法,由于无需构建克隆,耗时少,通量高,能够准确全面地反映土壤微生物群落分布特征等优势,已经逐渐取代传统的测序方法[9]。
自20世纪90年代以来,随着我国实施的大规模生态恢复工程,西北地区土地沙化和荒漠化得到遏制,然而从目前的研究成果来看,我国土地沙化的重点工作仍集中在北方干旱、半干旱区域,忽略了对西北地区草地沙化的研究[10]。川西北高寒草原是全国五大牧区之一,地处青藏高原东缘,生态地理位置极其重要,是四川省沙化最严重的区域,过去20(1994—2013年)年间沙化总面积增加了28.1%,目前草地面积剩余820万hm2。随着全球气候变化和人类掠夺式发展(滥垦和乱挖),导致该区草原植被数量级覆盖度急剧下降,生态环境也极度恶化,退化沙化草地面积也逐年扩大,形成了不同沙化程度的草地类型,这已经严重影响了该区经济的可持续发展和生态安全问题,因此对该区不同沙化程度草地的治理和研究已经迫在眉睫[11-12]。截止目前,该区沙化草地的研究大部分集中在如何治理及治理措施的选取等方面,在沙化草地退化过程中土壤养分急剧降低,导致微生物功能降低。大量的研究也表明,草地沙化降低了土壤微生物数量和活性,不同沙化程度对土壤微生物群落的影响不同,微生物种类及多寡是土壤质量的重要指标,它们对环境极为敏感,又是恢复环境的先锋,提高了生态系统的缓冲能力,微生物指标已经用来评价退化生态系统中生物群系与恢复功能之间的联系并能为退化土壤恢复提供有用信息[11-12]。目前针对不同程度沙化草地土壤微生物群落特征多样性的具体变化情况尚不明确。鉴于此,本文以典型川西北不同沙化程度草地为研究对象,运用高通量测序技术,研究土壤细菌多样性、物种组成和丰富度,并结合土壤理养分探讨影响细菌群落结构的环境因素,对发挥土壤潜在肥力、了解土壤健康状况,实现该区植被的管理与可持续利用有着重要的意义。
1 材料与方法
1.1 研究区概况
研究区域位于红原县(四川省西北部),地处阿坝藏族羌族自治州中部(31°51′—33°19′N,101°51′—103°23′E),属于川西北高原灌丛和若尔盖高原植被地区中的植被小区。该区属高原寒冷地区,沙漠化土地总面积为6 915.4 hm2,海拔3 210~4 857 m,冬季长春秋季短,无夏季,日照充足,寒冷干燥,无霜期40~60 d,昼夜温差大,年平均气温1.1℃,年均降水量753.0 mm,近十年极端最高气温为26℃,极端最低气温为-36℃,日照达2 417.9 h,日照率为55%。植被以亚高山草甸为主,沼泽植被占有优势,受高寒气候的影响,该区域以高山草甸土、亚高山草甸土和沼泽土为主,伴有寒漠土和风沙土,近年来风沙土的范围不断扩大。本研究的取样点分布于红原至若尔盖公路旁,该区域不同沙化草地均有所表现。
1.2 试验设计
2017年8—10月,对研究区进行初步的资料收集和调查,了解研究区沙化土地分布格局,采样时间为植被生长最旺盛期,根据研究区现状选择不同沙化程度的草地(未沙化草地、轻度沙化草地、中度沙化草地、严重沙化草地)。GPS采集样地经纬度和高程信息,详细记录样地基础环境和物种等指标(表1)。每种沙化草地分别选取3个500 m×500 m的样地,每个样地随机选取1 m×1 m样方15个,进行植物群落样方调查。在每个样方按照五点取样法收取500 g左右鲜土,鲜土过2 mm筛除去大的砾石和根系,取样深度为0—10 cm混合土样(除去表层的枯落物和较多的根系),充分混匀后液氮保存(-80℃),带回实验室内用于测定微生物多样性;另一部分自然风干15 d后过80目筛后测定土壤养分含量。
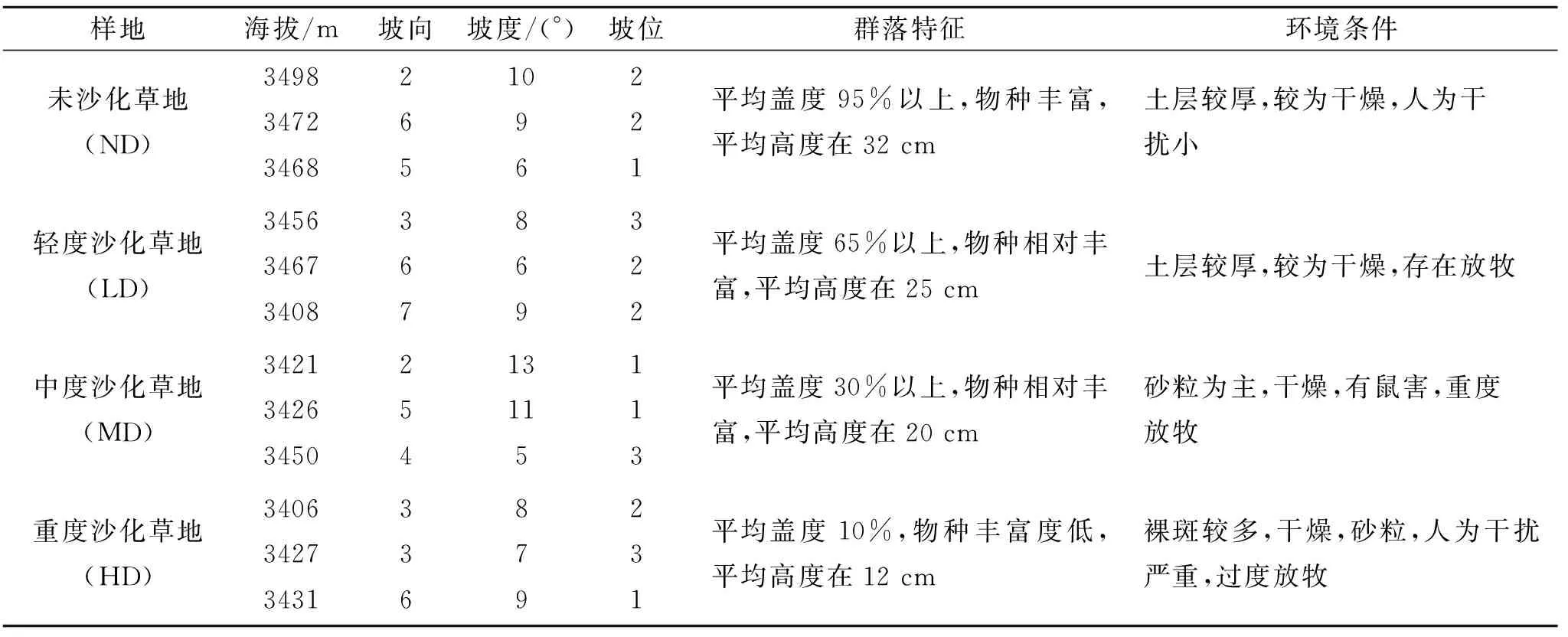
表1 不同程度沙化样地特征
注:表中用1代表上坡位,2代表中坡位,3代表下坡位。坡向是顺时针旋转的角度来表示(以朝东为起点,为0°),每45°为一个等级,其变化范围在0~8之间,数字越大,表示越干热[19-20]。
1.3 土壤样品的测定
1.3.1 土壤养分的测定 一部分土壤样品经自然风干20 d后,去除植物根系等杂物过2 mm筛。土壤pH值采用电极电位法(2.5∶1水土比浸提液);有机碳和全氮含量采用元素分析仪;速效磷采用NaHCO3浸提—钼锑抗比色法;碱解氮采用NaOH-H3BO3法;全钾采用乙酸铵浸提—火焰光度计法[13]。
1.3.2 土壤细菌测序
(1) 土壤DNA提取和测序。土壤DNA的提取使用上海美吉公司提供的DNA试剂盒(Omega Bio-tek,Inc,Doravilla,GA,USA)利用1%琼脂糖凝胶电泳进行基因组DNA的检测抽提。参照电泳初步定量的结果,使用Promega 公司的QuantiFluorTM-ST 蓝色荧光系统对PCR 产物进行定量检测,之后根据每个样本的测序量要求进行相应比例的混合。利用磁珠纯化后的PCR产物对目的片段(16 SrRNA V3—V4)进行检测。采用上海美吉生物公司提供的MiSeq测序平台,利用细菌的特异性引物(338 F_806 R)进行16 SrRNA基因扩增,使用AXYGEN公司的AxyPrepDNA凝胶回收试剂盒切胶回收PCR产物,Tris-HCl洗脱;2%琼脂糖电泳检测。下机的原始数据去接头、去污染、去低质量,筛选得到可信数据,根据索引号对比至各个样品。
(2) 序列的优化及去杂。高通量测序过程中通常会出现一些点突变和高分子均聚物等测序错误,随着测序长度的增加造成序列末端的质量降低,为了得到更高质量及更精准的生物信息分析结果,则应对有效序列进行去杂和修剪得到优化数据。使用软件Trimmomatic,FLSAH对数据进行去杂。
(3) 生物信息分析及数据处理。根据Barcode 序列拆分各样品数据,然后截取Barcode和引物的序列使用FLASH对进行拼接;高通量序列数据使用QⅡME进行数据处理:利用UPARSE软件对全部有效序列进行聚类,默认以99%序列相似度对序列聚类获得OTUs(operational taxonomic units,操作分类单元);从每个OTUs选取一个代表性序列,以Greengenes数据库为参考,使用RDP Classifier对OUT进行物种注释,置信水平为80%;最后对样品数据均一化处理,以样品中数量最少的为标准,统一抽取有效序列来研究细菌群落结构。通过计算物种丰富度(OTUs)和土壤细菌群落多样性。
计算细菌丰度(Community richness)的指数如下[14]:Chao指数是用Chao1算法估计群落中含OTU数目的指数,Chao1在生态学中常用来估计物种总数,由Chao最早提出。Ace指数用来估计群落中含有OTU数目的指数,由Chao提出,是生态学中估计物种总数的常用指数之一,与Chao1的算法不同。
细菌多样性(community diversity)的指数如下[15]:Simpson指数用来估算样品中微生物的多样性指数之一,由Simpson提出,在生态学中常用来定量描述一个区域的生物多样性,Simpson指数值越大,说明群落多样性越低。Shannon用来估算样品中微生物的多样性指数之一。它与Simpson多样性指数均为常用来反映α多样性的指数,Shannon值越大,说明群落多样性越高。
测序深度指数如下[16]:Coverage是指各样品文库的覆盖率,其数值越高,则样本中序列没有被测出的概率越低。该指数反映了本次测序结果是否代表样本的真实情况。对OTU列表中获得的分类信息与丰度进行整理,在门和纲分类水平下对各样品进行物种丰度统计及冗余分析(RDA),可得到样品中群落组成结构、相似性以及群落结构与环境因子的关系。
2 结果与分析
2.1 不同沙化草地土壤养分特征
由表2可知,川西北不同沙化草地土壤养分具有明显差异,依次表现为:随着沙化程度的增加,土壤pH值逐渐增加,而土壤有机碳、全氮、全钾、碱解氮和速效磷逐渐降低;其中土壤pH值变化范围7.56~8.63,均值为8.03,沙化草地pH值显著高于未沙化草地(p<0.05);土壤有机碳变化范围为9.04~13.2 g/kg,均值为11.25 g/kg,ND和LD差异不显著(p>0.05),MD和HD差异不显著(p>0.05);土壤全氮变化范围为1.01~1.23 g/kg,均值为1.11 g/kg,其中沙化草地土壤全氮显著高于未沙化草地(p<0.05),MD和HD差异不显著(p>0.05);土壤全钾变化范围为9.87~13.56 g/kg,均值为11.76 g/kg,ND和LD差民不显著(p>0.05),HD显著高于其他草地(p<0.05);土壤碱解氮变化范围18.74~29.85 mg/kg,均值为24.24 mg/kg,不同草地土壤碱解氮差异均显著(p<0.05);土壤速效磷变化范围18.74~29.85 mg/kg,均值为29.19 mg/kg,不同草地土壤速效磷差异均显著(p<0.05)。
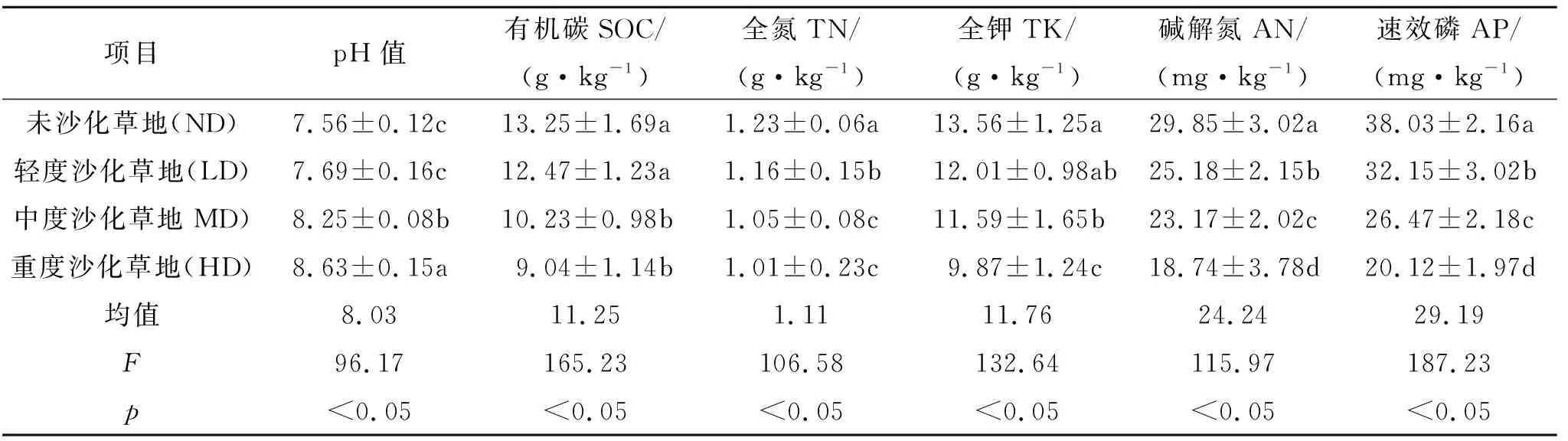
表2 不同沙化草地土壤养分特征
注:不同小写字母表示差异显著(p<0.05),下同。
2.2 不同沙化草地土壤细菌多样性
如表3所示,所有样品的平均覆盖率为98%,表明该测序效果理想。在3%分类水平下,不同沙化草地土壤细菌Chao,Ace、Simpson指数、Shannon指数、OTU数量有所差异。OUT数目、Chao指数、Ace指数、Shannon指数均表现为:ND>LD>MD>HD,其中不同沙化草地土壤细菌覆盖率和Simpson指数差异不显著(p>0.05);不同沙化草地土壤Chao、Ace、Simpson指数、Shannon指数、OTU均显著高于未沙化草地。
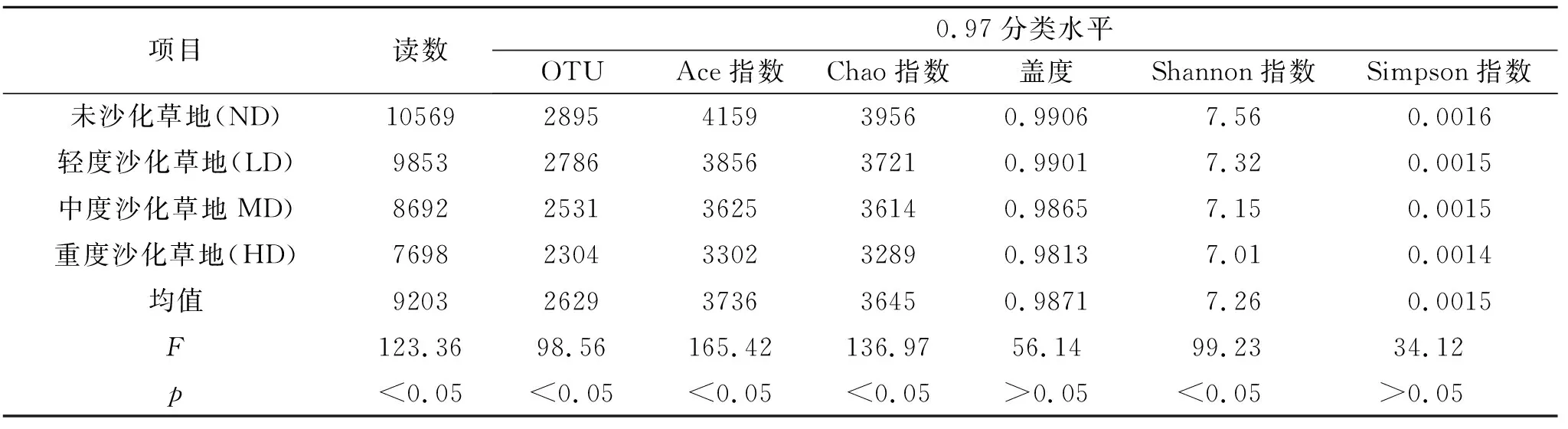
表3 不同沙化草地土壤细菌序列统计及多样性指数
2.3 不同沙化草地土壤细菌的群落组成特征
高通量测序结果显示不同沙化程度草地土壤样品中共检测到细菌的32个门,65个纲,169个目。所有样品一共获得756 234条有效序列,其中最少序列为65 231条,最多序列为70 218条。这些序列的99.1%可以分类到不同的细菌门类,0.9%与数据库比对分类到古菌门类。如图1A所示,通过MiSeq高通量测序发现不同沙化草地土壤中检测到的主要门有:变形菌门(Proteobacteria)(29.8%~35.2%)、放线菌门(Actinobacteria)(11.3%~19.8%)、酸杆菌门(Acidobacteria)(11.3%~19.8%)、绿弯菌门(Chloroflexi)(8.3%~12.6%)、芽单胞菌门(Gemmatimonadetes)(3.2%~7.5%)、厚壁菌门(Firmicutes)(3.2%~7.2%)、拟杆菌门(Bacteroidetes)(1.6%~4.1%)、硝化螺旋菌门(Nitrospirae)(1.2%~3.9%)共8个门。其中,前6个门在土壤中占主导地位,约占到所有细菌的89%~95%。此外还发现了相对丰度小于1%的其他41个稀有门类,它们占总序列5.4%。
如图1B所示,通过MiSeq高通量测序发现不同沙化草地下土壤中检测到的主要纲有:α-变形菌纲(α-Proteobacteria)(21.9%~26.9%)、放线菌纲(Actinobacteria)(18.3%~29.3%)、酸杆菌纲(Acidobacteria)(15.3%~20.5%)、β-变形菌纲(β-Proteobacteria)(12.1%~13.5%)、嗜热油菌纲(Thermoleophilia)(6.3%~9.8%)、芽单胞菌纲(Gemmatimonadetes)(5.4%~8.3%)、杆菌纲(Bacilli)(2.3%~7.2%)和δ-变形菌纲(δ-Proteobacteria)(1.7%~4.5%)共8个。其中,前6个纲在土壤中占主导地位,约占到所有所有纲的89%~95%。
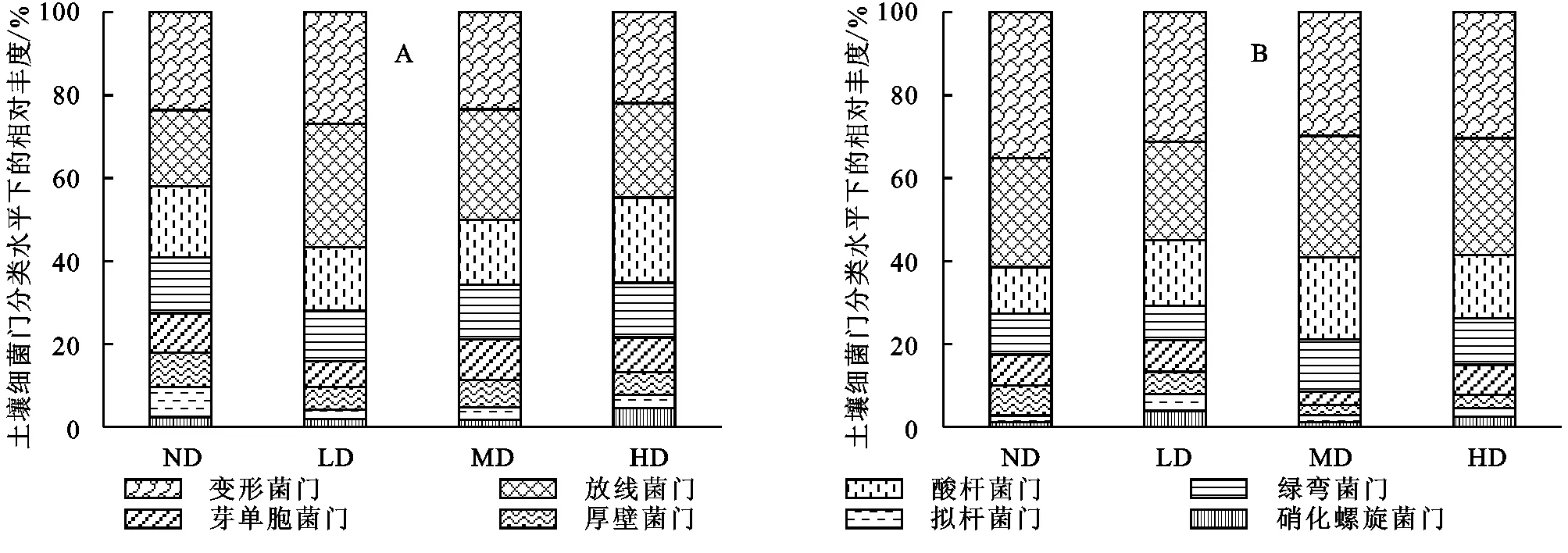
图1 不同沙化草地土壤细菌门和纲分类水平下的相对丰度
2.4 土壤养分与细菌群落结构的相关性
土壤可以提供细菌群落生长繁殖的微环境,而不同的植被类型通过改变土壤的微环境间接影响了土壤细菌群落结构的组成。土壤理化性质和细菌群落结构的相关性采用Mantel检验方法(Mantel tests)分析,从表4可以看出土壤细菌群落结构与土壤pH值、土壤含水量、土壤有机碳和总氮呈现显著相关(p<0.05)。相关性分析表明,Proteobacteria,Acidobacteria,Firmicutes,Nitrospirae的相对丰富度与土壤pH值呈显著负相关,Actinobacteria的相对丰富度与土壤pH值呈显著正相关;Actinobacteria的相对丰富度与SOC呈显著负相关,Proteobacteria,Acidobacteria,Chloroflexi,Firmicutes的相对丰富度与SOC呈显著正相关;Actinobacteria的相对丰富度与TN呈显著负相关,Proteobacteria,Acidobacteria,ChloroflexiFirmicutes的相对丰富度与TN呈显著正相关;Chloroflexi的相对丰富度与TK呈显著正相关;Chloroflexi,Gemmatimonadetes的相对丰富度与AN呈显著正相关;Acidobacteria的相对丰富度与AP呈显著正相关。

表4 土壤养分与土壤优势细菌相对丰度相关性
注:*,**分别表示在0.05,0.01水平上差异显著。
2.5 环境因素对微生物群落的影响
为了探讨土壤环境对微生物群落组成的影响,本文通过将土壤理化性质分别与纲和属分类水平下细菌的群落组成关系进行冗余分析,利用R语言bioENV筛选出最能体现土壤细菌群落结构变化的6个土壤因子,研究结果与Mantel tests方法一致,将经过筛选的土壤理化因子与细菌群落结构进行冗余分析RDA),RDA二维排序图可以直观地给出研究对象与环境变量之间的关系,排序轴与箭头连线夹角表示环境因子与排序轴的相关性,夹角越小表明关系越密切,而箭头连线表示环境因子与研究对象相关程度的大小,连线越短,相关性越小,反之越大。所有样品因环境因素的不同而聚类或分离的情况,蒙特卡罗检验(Monte Carlo test)发现,特征根的F=2.76,轴1,轴2,轴3和轴4的特征根的相关系数分别为0.953,0.967,0.853,0.981,到轴4的累计合理解释变量为87.36%,故RDA分析排序结果可信。环境变量间夹角的余弦值表示二者的相关关系,ND和HD土壤细菌组成差异较大,MD和HD位于二、三象限,ND和LD位于一、四象限。SOC和pH值的射线较长,表明其对细菌群落组成影响较大,而AP值的射线较短,说明其对细菌群落组成影响较小;在土壤pH值,SOC,TN对土壤细菌群落结构具有较大影响,同时不同沙化草地土壤细菌群落发生明显分异,ND土壤细菌群落主要处于土壤pH值较高区域,而HD土壤细菌群落主要聚类于土壤含水量较高的区域,不同沙化草地土壤细菌群落结构较为分散,其中Actinobacteria,Acidobacteria群落与pH值显著负相关,Proteobacteria群落与SOC,TN呈显著正相关。
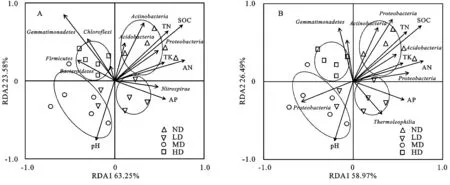
图2 基于门(A)和纲(B)水平下的土壤细菌分布与环境因子的关系
3 讨论与结论
3.1 不同沙化草地土壤细菌多样性及群落组成
川西北草地生态系统是全球变化的敏感区域,其微生物组成和功能影响生态系统转化的方向和进程[8]。本研究中,未沙化草地土壤养分含量高于沙化草地,这可能与土壤含水量较高有关,而土壤水分是调节生态系统土壤微生物物质转化的关键因子,沙化草地土壤含水量较低,破坏较为严重,受干扰程度较高,因此,其土壤养分含量较低,其中重度沙化草地土壤含水量最低。土壤细菌是土壤微生物的重要组成部分,绝大多数土壤优势细菌种类基本相同,主要包括10个左右的细菌类群。Chu等[17]在青藏高原西北部研究表层土壤细菌群落结构发现放线菌门、α-变形菌门、酸杆菌门、绿弯菌门和芽单胞菌门5大门类为研究区的优势类群。厚壁菌门、γ-变形菌门、β-变形菌门、δ-变形菌门、拟杆菌门、浮霉菌门6大门类为平均相对丰度小于5%大于1%的细菌门类,与本研究基本一致。而Yuan等[18]在念青唐古拉南面沿海拔梯度取样研究高山草原土壤细菌群落发现酸杆菌门、变形菌门、芽单胞菌门为研究范围内最主要的3个细菌门类。Zhang等[19]在青藏高原北麓河流域分析草甸、草原和荒漠草原土壤细菌群落结构差异发现主要优势菌群为变形菌门、放线菌门、酸杆菌门、拟杆菌门4个门类,这可能与当地的气候、水文、土壤、植被条件不同有关,似乎没有两种土壤包含完全一致的微生物群落结构。本研究中土壤细菌优势菌群,与其他研究相比厚壁菌门相对丰度较高,这可能与厚壁菌门更能适应川西北沙化草地土壤环境和利用有限的土壤养分有关,草地沙化引起了放线菌门相对丰度的增加,放线菌最适生长环境土壤pH值偏碱性,因此重度沙化草地土壤环境更适宜放线菌的生长。
大量研究表明,草地沙化、破坏和干扰会改变土壤细菌的群落多样性,通过植被恢复促进土壤形成团聚体,从而提高土壤的稳定性,在植被恢复的生态环境效应方面起着重要作用[20-21]。而土壤细菌的生长主要受土壤的理化性质与环境因子的影响。不同土地利用方式因其管理措施的不同,对土壤理化性质的影响存在很大差别,对土壤细菌群落结构的影响也不同。土壤微生物多样性指数表示生物群落中的物种多寡,数值愈大表示物种越丰富;优势度指数越大,生物群落内的优势种越突出,生物种群丰富和多样性指数高是生态环境健康稳定的重要表现[22-23]。根据表3可知,未沙化草地土壤细菌多样性指数均高于沙化草地,与前人的研究结果一致,说明草地沙化降低了土壤微生物多样性。草地沙化过程中,降低了植被凋落物,从而降低了细菌对养分的吸收、利用和转化,进而影响了土壤细菌群落生长。
3.2 不同沙化草地土壤细菌群落组成与土壤养分的关系
研究区土壤细菌群落结构和α多样性与土壤pH值、土壤有机碳和全氮显著相关。土壤pH值是影响土壤细菌群落分布的最主要影响因子。Rousk等[24]对具有pH值梯度的农田土壤180 m距离(小尺度)内土壤微生物群落结构和多样性采用高通量测序分析,结果表明土壤细菌群落结构组成和多样性与土壤pH值密切相关。Fierer等[25]利用末端限制性片段长度多态性分析了美洲大陆从北到南土壤细菌群落多样性和生物地理分布模式,发现土壤细菌群落丰富度和多样性与土壤pH值相关。Shen等[26]在长白山研究6种典型植被类型,采用高通量技术研究土壤细菌群落组成和多样性随海拔的分布规律,发现土壤pH值是驱动土壤细菌分布的影响因子,与本研究结论一致。同时SOC和TN也是土壤细菌群落结构和多样性的主要影响因子。而Chu等[17]在对青藏高原西北部大尺度研究表层和亚表层土壤细菌群落分布时发现总碳和碳氮比是青藏高原微生物生物地理分布的主要影响因子。植被类型可能通过凋落物和根际分泌物影响土壤微环境并间接地改变了土壤细菌的群落结构和多样性。对于未沙化草地,具有密实的根系,土壤有机碳含量较高;而重度沙化草地草本覆盖度低,土壤有机碳和总氮含量低,土壤微环境的营养差异可能改变土壤细菌群落结构和多样性。当土壤微生物有适宜的营养物质、土壤pH值和良好的水热条件,有利于土壤微生物的生长和繁殖[27-29]。总体来看,土壤细菌群落组成与土壤pH值和含水量密切相关,而当土壤pH值相似时,土壤养分可能是细菌结构的重要影响因子。
随土壤肥力及环境状况的不同,土壤微生物种群数量也会存在不同程度的差别。本研究中,不同沙化草地之间土壤养分含量不同,土壤优势细菌门、纲的相对丰富度也不同,说明土壤营养元素含量的变化导致了土壤细菌的组成及群落结构的变化。细菌的优势菌门有Proteobacteria,Actinobacteria,Acidobacteria,Chloroflexi,Gemmatimonadetes,Firmicutes,虽然不同沙化草地之间土壤细菌群落物种组成相似,但土壤细菌门、纲、种的相对丰度不同,可能是因为植物类型不同以及其向土壤提供的营养物质的形式与含量存在差异。Actinobacteria能够降解复杂的木质素与纤维素,为土壤提供养分,图1可知,Proteobacteria是最主要的优势菌门,其结果表示Proteobacteria为碱性土壤中主要优势菌群,在本研究优势菌Proteobacteria门中,α-Proteobacteria是最主要的亚门,其次是β-Proteobacteria,然后是δ-Proteobacteria,与Zhang等[19]研究结果不一致,在其研究结果中,β-Proteobacteria是Proteobacteria门中丰富度最高的亚门,这可能是因为所选取的研究区域不一样,其土壤结构、含水率等环境因素差异较大,土壤细菌的群落组成也就不一样,优势菌主要亚门也就不相同。RDA分析发现,α-Proteobacteria主要受pH值SOC的影响,Acidobacteria与SOC显著相关,说明草地沙化明显改善了土壤的理化性质,改变了土壤细菌的群落组成。本研究表明SOC和TN是该研究区域影响土壤细菌群落组成与多样性特征的主要理化性质因素,草地沙化明显改变了土壤细菌群落组成。
