美人蕉快繁及茎尖脱毒体系的建立
2018-10-29陈志汪一婷吕永平牟豪杰
陈志,汪一婷,吕永平,牟豪杰
(浙江省农业科学院 病毒学与生物技术研究所,浙江 杭州 310021)
美人蕉(Cannaindica) 原产美洲,别名兰蕉、昙华,植株俊秀挺拔、花大色艳、花色丰富、花期长,是一种非常优良的园林和景观绿化植物,且开花时正值我国南方炎热少花的季节,可大大丰富园林绿化中的色彩。同时,美人蕉具有较强的净化环境和抗污染的能力,对氟化物、二氧化硫等有毒气体的吸收能力较强,是一种非常理想的多用途花卉。美人蕉通常利用地下根茎进行分株繁殖,但会导致母本携带病毒不断积累并传播给后代,迄今已在美人蕉属植物发现的病毒包括美人蕉黄色条纹病毒、西红柿不育病毒[1]、美人蕉黄斑驳病毒[2-3]、黄瓜花叶病毒[4-5]、菜豆黄花叶病毒[4]等,引起植株叶片产生花斑或植株坏死,极大降低美人蕉的观赏性。
关于美人蕉组织培养的报道中,刘丽萍等[6]以带芽苞根茎为外植体进行水生美人蕉组培快繁技术研究;王丹等[7]以大花美人蕉根茎茎尖为外植体进行组织培养技术研究中指出,美人蕉增殖效率低下,最高为1.67。本研究旨在建立美人蕉高效组培快繁体系,同时进行美人蕉脱毒种苗生产研究,为美人蕉脱毒苗推广奠定基础。
1 材料与方法
1.1 材料
本单位引进并种植保存的7个国外美人蕉品种。
1.2 方法
1.2.1 美人蕉无菌材料获得
选取美人蕉地下带芽的根茎作为起始材料,将根茎表面根切除,洗净附着物,将芽从根茎上切下,剥除外部1~2 层芽鳞,表面处理光滑后即可进行表面消毒。用洗洁精溶液振荡清洗20 min,然后用流水冲洗干净外植体表面残留物,在超净工作台上将洗净的外植体转移至无菌锥形瓶中,浸入75%酒精60 s,再用有效氯浓度为1%的NaClO溶液浸泡10~15 min,然后用无菌水清洗经过消毒处理的外植体4~5次,将外植体接种到MS基本培养基中培养,光照强度(40±2)μmol·m-2·s-1,光周期为16 h。
1.2.2 美人蕉茎尖培养
将株高2 cm左右美人蕉无菌萌发芽转移至放有无菌滤纸的接种盘中,在解剖镜下将芽鳞逐层剥离,最后切下顶端0.2~0.5 mm长的茎尖部分,将其接种到MS+6-BA(0.10~0.50)mg·L-1+NAA(0.05~0.20)mg·L-1+脯氨酸(50~200)mg·L-1+蔗糖30 g·L-1的培养基中,(24±2)℃下暗培养7~10 d,然后将材料移至同温下光培养(12~14)h·d-1,光照强度为(40±2)μmol·m-2·s-1,至茎尖培养材料长至1~2 cm后进行不定芽诱导及增殖。
1.2.3 美人蕉不定芽诱导及增殖
在茎尖培养获得的不定芽基部轻划造成一些伤口,接种于不定芽诱导培养基中进行不定芽的诱导及增殖,将每个芽作为1个株系进行编号,方便后期病毒检测。不定芽诱导及增殖培养基为MS+6-BA(6.0~10.0)mg·L-1+CaCl2(500~800)mg·L-1+蔗糖30 g·L-1,培养温度(24±2)℃,光照时间为(12~14)h·d-1,光照强度为(40±2)μmol·m-2·s-1。
1.2.4 美人蕉病毒检测及脱毒材料扩繁
每个株系美人蕉增殖良好材料剪取新鲜叶片100 mg左右进行病毒检测,本研究检测病毒包括黄瓜花叶病毒、菜豆黄花叶病毒和西红柿不育病毒共3种,采用双抗体夹心ELISA(DAS)检测法进行检测,所有ELISA试剂盒购于ADGEN公司,操作流程详见说明书。对于未携带检测病毒的株系,按照“1.2.3”方法进行不定芽增殖扩繁。
1.2.5 美人蕉生根诱导及移栽驯化
丛生不定芽从基部将生长至3~5 cm高的不定芽单个分开,接入生根培养基中进行诱导,生根培养基为MS+IBA 0.2 mg·L-1+蔗糖30 g·L-1,培养温度(24±2)℃,光照时间为(12~14)h·d-1,光照强度为(40±2)μmol·m-2·s-1。
不定芽基部长出2~3条1~2 cm的不定根后移至温室,散射光下培养5 d后打开瓶盖,再培养1~2 d,将生根苗表面琼脂洗干净,栽入基质中,相对湿度90%以上培养15 d,然后在温室中正常培养。
2 结果与分析
2.1 美人快繁体系建立
美人蕉快繁体系建立情况如图1所示。试验中发现,美人蕉无菌材料极易成活、生根,而且在添加有植物生长素或低浓度的6-BA的培养基中,美人蕉也极易生长出不定根,从而导致增殖系数极低,难以达到产业要求。本研究发现,作为细胞分裂活性更强的细胞分裂素噻苯隆(TDZ)对美人蕉不定芽增殖效果不佳,即使在添加低浓度TDZ的培养基中,不定芽丛生、矮化、玻璃化现象仍很明显,能获得的有效不定芽数量有限,因此增殖效率提升有限。王丹等[7]研究报告中也得出与本研究相同结果。研究还发现,在增殖培养基中增加Ca2+可有效抑制不定根的数量。当Ca2+离子浓度达到800 mg·L-1时,基本可抑制增殖过程中不定根的形成,不定芽增殖效率可提高至2.8左右,且长势正常。刘臻晔[8]的研究结果显示,Ca2+离子的加入对马铃薯试管苗生根无影响或有部分促进效果,与本研究结果相反,可能是由于不同植物造成的。

a为根茎外植体;b为不定芽增殖; c为不定芽生根;d为组培苗移栽图1 美人蕉再生体系的建立
2.2 美人蕉茎尖培养
茎尖大小对培养的成活率影响很大。根据贤武等[9]的研究结果,对2 mm长的茎尖进行培养,茎尖成活率最低为12.5%,最高为65.0%。Ramgareeb等[10]研究结果也显示,当茎尖长度介于1~2 mm时,成活率为79.2%;若小于1 mm,则成活率下降至46.0%;若培养茎尖尺寸更小,成活率将更低。但据Gosalvez-Bernal等[11]对康乃馨茎尖中病毒分布的研究结果显示,仅在茎尖顶端分生组织0.5 mm以上区域内未检测到病毒粒子的存在,因此为了避免因脱毒不彻底造成的材料浪费,本研究采用培养长度低于0.5 mm(0.2~0.5 mm)的美人蕉茎尖培养。
研究对已建立无菌体系的7个美人蕉进行茎尖剥离和培养,每个品种剥离30个茎尖,最终获得71个成活材料。表1中,成活率为成活株系与起始茎尖数量的比值,茎尖培养成活率最高约为53.3%,最低约为13.3%,平均成活率约33.8%,基本与贤武等[12]研究结果符合。茎尖培养过程如图2所示。
2.3 茎尖获得材料病毒检测情况
对本研究获得的7个美人蕉品种共71个茎尖再生株系进行黄瓜花叶病毒、菜豆黄花叶病毒和西红柿不育病毒检测。对第1次检测结果中未携带3种检测病毒的材料在接下来连续2个培养周期中重复检测,将最终3次检测均未携带检测病毒的株系确定为脱毒植株。表1中,无毒植株得率为无毒株系与成活株系的比值,共获得40个未携带3种检测病毒株系,最高脱毒率为100.0%,最低脱毒率为30.8%,平均脱毒植株得率为56.3%。
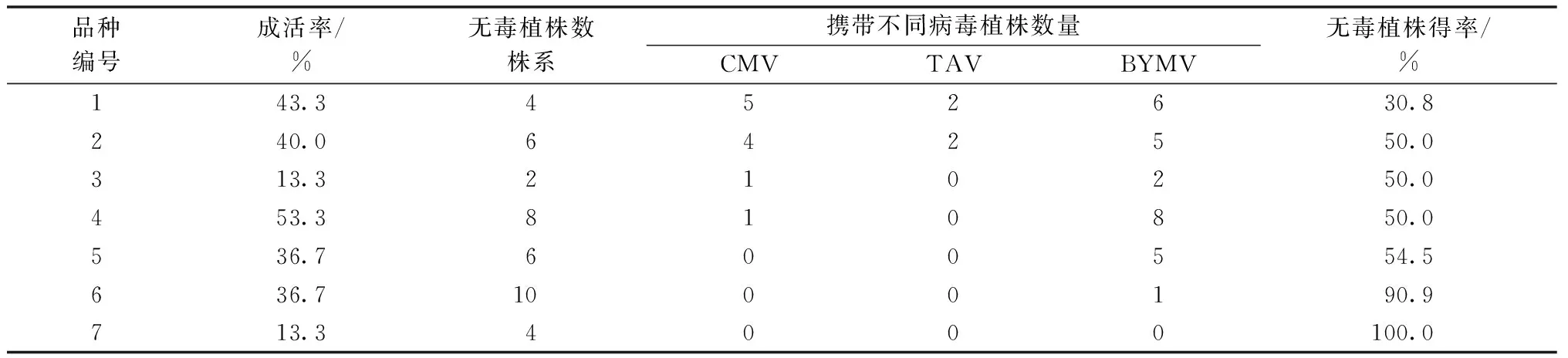
表1 美人蕉茎尖培养及病毒检测结果

图2 美人蕉茎尖剥离及培养的情况
检测株系中,携带TAV病毒植株最少,仅有2个品种4个株系携带;携带BYMV病毒植株系最多,有6个品种27个株系;携带CMV病毒植株系有4个品种11个株系。另外,检测结果还显示,美人蕉存在复合侵染的情况。本研究中,携带2种检测病毒的有6株系,携带所有检测病毒的植株有3株系。
3 讨论
已有研究结果表明,美人蕉快繁体系中极低的不定芽增殖效率在很大程度上阻碍了利用植物组培技术对美人蕉品种的推广应用,本研究前期也遇到这个问题,因此今后提高有效不定芽增殖效率是美人蕉快繁体系建立和优化的重点方向。通过在增殖培养基中加入5~8 mmol·L-1的Ca2+后,有效抑制了增殖过程中不定根的形成,使不定芽增殖效率提高到2.8左右,而且对不定芽生长及后期生根诱导无不良影响,这在美人蕉组培报道中尚属首次。
本研究的另一重点是美人蕉脱毒材料的获得。在美人蕉茎尖培养阶段,并未以茎尖成活率为重点,而是以脱毒效率为重点,因此剥离茎尖尺寸基本小于0.5 mm,虽然平均成活率约为33.8%,但种苗脱毒率超过平均56.3%。贤武等[12]在甘蔗茎尖培养研究中发现,1~2 mm甘蔗茎尖培养成活率达到60%~80%,远高于本研究结果,但其并未进行病毒检测相关方面工作,故脱毒效率未知。结合前人研究结果,本研究认为,对于植物茎尖培养而言,其主要目的就是获得脱毒植株,因此脱毒效率是首先必须要考虑的。
综上所述,本研究建立美人蕉快繁技术体系增殖效率达到2.8,茎尖培养体系中茎尖成活率达到33.8%,脱毒株系得率约56.3%,基本达到美人蕉脱毒种苗产业化生产需求。
