热疗联合化疗治疗老年进展期胃癌的临床疗效△
2018-10-26张亚萍吴稚冰王晓艳王辉王颖蒋一玲柴枫金中强万宇方红明
张亚萍,吴稚冰,王晓艳,王辉,王颖,蒋一玲,柴枫,金中强,万宇,方红明#
1浙江萧山医院肿瘤内科,杭州 311200
2杭州市肿瘤医院放疗科,杭州 310000
胃癌是世界发病率位居第4、病死率却位居第2的恶性肿瘤[1]。多数胃癌患者确诊时已进展到晚期,错失了手术治疗时机,普遍中位生存时间不超过12个月[2]。研究显示,2/3的胃癌患者确诊时大于65岁[3]。多数老年患者受器官功能减退和基础疾病增加的限制,往往难以耐受标准治疗,而且治疗相关不良反应较明显[4]。因此,对于老年胃癌患者的最佳治疗方案仍有争议。热疗是一种物理抗肿瘤治疗方式,与多种化疗药物联合应用时具有明显的增效互补及协同作用,热疗和化疗联合的综合治疗模式被认为是改善肿瘤预后的有效手段[5-7]。但既往有关热疗联合化疗治疗老年进展期胃癌的临床研究较少,需更多的临床试验进行佐证。本研究回顾性分析57例老年进展期胃癌患者的临床资料,旨在探讨热疗联合化疗的疗效和安全性,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2011年1月至2016年6月浙江萧山医院收治的老年胃癌患者的临床资料。纳入标准:①经组织病理学、影像学检查确诊为Ⅲ~Ⅳ期胃癌;②年龄≥65岁;③无明显的肝、肾功能异常和心脏疾病;④卡氏(Karnofsky,KPS)评分≥70分;⑤无热疗或化疗禁忌证。排除标准:①肝、肾、心脏等主要脏器存在严重疾病和功能障碍者;②伴有难以控制的感染和代谢性疾病者;③伴有活动性脑血管疾病者;④精神病患者。根据纳入和排除标准,本研究共纳入57例老年进展期胃癌患者。根据治疗方式的不同将患者分为热疗联合化疗组(n=28)和单纯化疗组(n=29)。热疗联合化疗组中,男23例,女5例;年龄65~86岁,平均(73.07±7.01)岁;TNM分期:Ⅲ期15例,Ⅳ期13例。单纯化疗组中,男23例,女6例;年龄65~88岁,平均(73.17±6.80)岁;TNM分期:Ⅲ期 15例,Ⅳ期 14例。两组患者的性别、年龄、TNM分期比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 治疗方法
单纯化疗组:替吉奥80 mg/m2,第1~14天口服,奥沙利铂120 mg/m2,第1天静脉滴注,每3周为1个疗程。共治疗2个疗程,热疗联合化疗组:化疗药物的用法、用量与单纯化疗组相同,并在化疗开始后,每周行3次腹部局部加热,8次为1个疗程。采用吉林迈达公司生产的NRL-001型内生场热疗仪对腹腔进行加温,输入功率为2000 W,输出功率为600~800 W,频率为36.40 MHz。根据患者治疗前的CT检查结果确定热疗中心位置,对皮肤、直肠内两处测温,测温传感器使用TCC2型高阻导线无干扰测温仪,测温精确度为±0.2℃,在直肠温度升至41℃后维持50 min左右。
1.3 观察指标
依照实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)1.1版[8]进行疗效评估:完全缓解(complete response,CR),所有目标病灶消失;部分缓解(partial response,PR),病灶最长径总和较前缩小至少30%且未出现新的肿瘤病灶;疾病稳定(stable disease,SD),病灶最长径总和较前缩小不超过30%或增大不超过20%且未出现新的肿瘤病灶;疾病进展(progressive disease,PD),病灶最长径总和较前增大至少20%或出现新的肿瘤病灶。客观缓解率=(CR+PR+SD)例数/总例数×100%。不良反应按世界卫生组织(World Health Organization,WHO)抗癌药物不良反应分级标准[9]进行评价。
1.4 随访方法
以电话和门诊就诊的方式进行随访,随访时间截至2017年2月20日,比较两组患者的生存情况。
1.5 统计学方法
采用SPSS 17.0软件-对数据进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以率(%)表示,组间比较采用χ2检验;等级资料的比较采用秩和检验。采用Kaplan-Meier法绘制生存曲线,组间比较采用Log-rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 近期疗效的比较
热疗联合化疗组患者的客观缓解率为67.86%(19/28),高于单纯化疗组的41.38%(12/29),差异有统计学意义(χ2=4.026,P<0.05)。(表1)
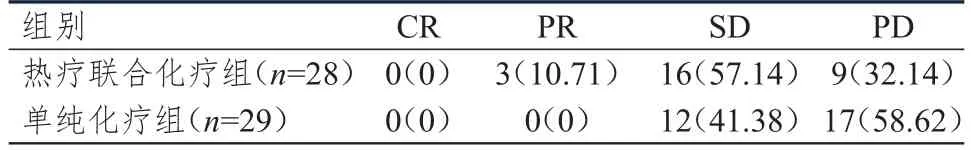
表1 两组患者的近期疗效[n(%)]
2.2 生存情况的比较
热疗联合化疗组和单纯化疗组患者的中位生存时间分别为 16.5个月(95%CI:7.89~25.11)和12.0个月(95%CI:8.82~15.18)。两组患者的生存情况比较,差异有统计学意义(χ2=4.134,P=0.042)。(图 1)
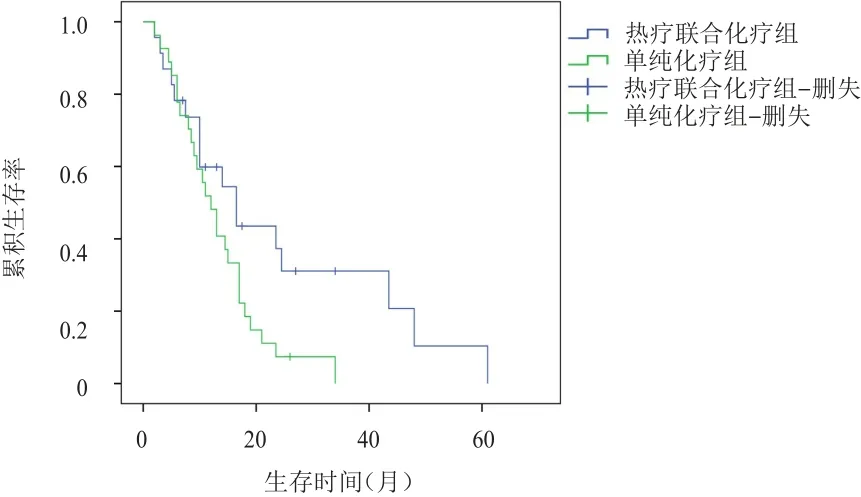
图1 热疗联合化疗组(n=28)和单纯化疗组(n=29)老年进展期胃癌患者的生存曲线
2.3 不良反应发生情况的比较
两组患者骨髓抑制、胃肠道反应、肝肾功能不全的发生情况比较,差异均无统计学意义(Z=0.236,P=0.813;Z=0.519,P=0.603;Z=0.607,P=0.544)。两组患者的不良反应程度均较轻,经相应的对症治疗后均可好转。(表2)
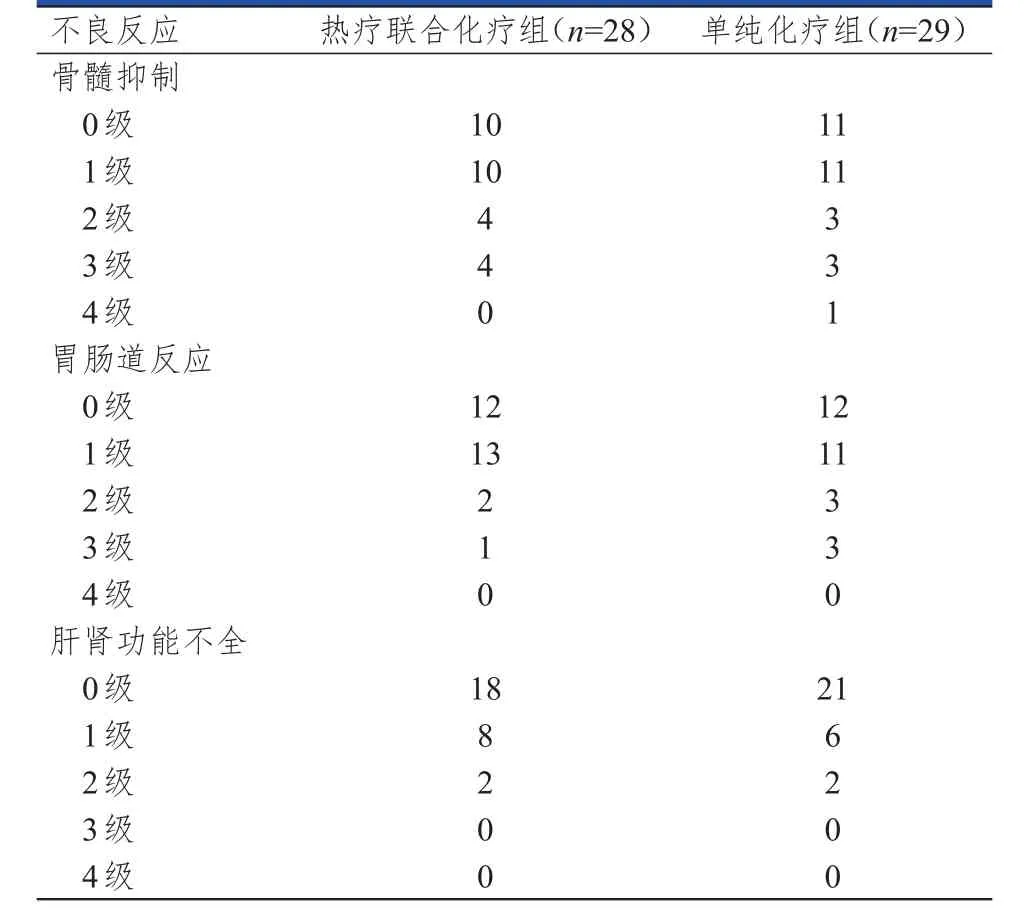
表2 两组患者的不良反应发生情况
3 讨论
与其他恶性实体肿瘤相比,胃癌的预后较差,除手术完全切除外,目前尚无有效的治疗方案。但胃癌早期症状隐匿,确诊时多数已处于中晚期,错失了手术治疗时机,局部复发或远处转移率较高。化疗是胃癌的重要治疗手段,既往研究显示迄今最常用的药物主要有5-氟尿嘧啶类、铂类、蒽环类和紫杉类等[10-11],上述药物的任一组合方案是如今中晚期胃癌的主要治疗方法,但化疗的有效率有限。
热疗是一种通过加热使肿瘤组织温度达到40~45℃,从而直接或间接地导致肿瘤细胞生长受阻或凋亡的物理治疗方法。体外研究及临床试验均显示,热疗可以增加肿瘤细胞对化疗的敏感性,与化疗联合应用能够发挥协同效应,改善肿瘤患者的预后,甚至能在晚期一般情况欠佳、不能耐受高强度治疗或已经对化疗耐药的患者中取得一定疗效[12-14]。热疗的抗肿瘤机制如下[15-16]:①肿瘤血管特殊的病理生理特性使其相比正常组织而言对热更敏感,虽然热疗时两种组织的温度均有升高,但热量更易在肿瘤组织中积聚,肿瘤组织的温度可以高于正常组织5~10℃。因此,肿瘤细胞发生热损伤时正常组织不受损害。②热疗可以抑制血管内皮细胞的生长,从而破坏和减少肿瘤血管的生成。③热疗可以破坏细胞膜的稳定性,增加细胞膜的通透性,促进药物进入细胞内,从而提高有效药物浓度。④热疗可以促进化疗药物诱发肿瘤细胞凋亡。⑤热疗可以使肿瘤中心部位达到较高的温度,从而诱导细胞凋亡,弥补化疗药物难以覆盖肿瘤组织中心乏氧细胞的缺点。⑥热疗能抑制肿瘤细胞对化学药物损伤的修复功能。⑦热疗可以明显抑制肿瘤细胞多药耐热基因的表达,从而减少耐药性的发生。⑧热疗可以有效地刺激免疫系统,提高机体的肿瘤免疫效应。
本研究回顾性分析57例老年进展期胃癌患者的临床资料,其中热疗联合化疗组患者采用3次/周的热疗联合替吉奥、奥沙利铂化疗,结果显示,热疗联合化疗组患者的近期疗效和生存情况均优于单纯化疗组。两组患者骨髓抑制、胃肠道反应、肝肾功能不全的发生情况比较,差异均无统计学意义(P>0.05);两组患者的不良反应程度均较轻,经相应的对症治疗后均可好转。
综上所述,与单纯化疗相比,热疗联合化疗治疗老年进展期胃癌疗效更好,且不增加相关不良反应,值得扩大样本量进一步研究。
