乌头酸基多色荧光碳点的制备及其分析应用
2018-10-25赵凤姣千佳丽孙圆圆王兆彦
赵凤姣,千佳丽,孙圆圆,王兆彦,周 雷*
(1.兰州大学 化学化工学院,甘肃 兰州 730000;2.兰州大学 药学院,甘肃 兰州 730000)
作为一种新兴的碳纳米材料,碳点(CDs)具有优良的光学性质、较好的生物相容性和低的细胞毒性[1-3],在生物成像、疾病诊断、化学传感和光催化等领域具有广阔的应用前景[4-8]。近年来,碳点的制备与应用受到科研工作者的广泛关注[9-10]。然而,目前报道的碳点的量子产率偏低且荧光多为蓝色,严重限制了此类材料的应用。因此,提高碳点的量子产率并调控其发射波长是该领域亟待解决的问题。
以小分子为前驱体采用“自下而上”法制备的碳点通常能获得较高的量子产率。其中以柠檬酸为前驱体,通过改变共掺杂试剂制备的系列碳点具有优异的量子产率[11-18],相对量子产率最高可达94%[14]。研究推测,柠檬酸基碳点的形成首先是柠檬酸分子中的3个羧基与氨基形成聚合物中间体,随后进一步碳化生成荧光碳点[11,19-20];也有研究者认为,柠檬酸分子在一定条件下能自组装形成层状结构,然后通过分子间脱水形成碳点[12,14-16,18,21-22]。柠檬酸基碳点虽然量子产率较高,但其所发射的荧光多为蓝色,尽管可以通过改变激发波长调控碳点的发射波长,但该方法获得的长波长发射的量子产率急剧下降,严重影响了此类碳点在生物学领域的应用[23-26]。因此,研究者通过改变不同的前驱体,以获得不同发射波长的碳点[27-28];或通过控制碳点粒径大小和表面的氧化程度来调控其荧光发射[29]。粒径大小、表面状态、掺杂元素等因素均会影响碳点的量子产率和发射波长,但上述因素如何影响碳点的荧光性质,至今尚无明晰的理论解释。基于此,发展新型的长波长碳点以及研究总结碳点的发射波长调控理论很有必要。
与柠檬酸相比,乌头酸(AA)的分子骨架中存在1个不饱和的碳碳双键,因而推测其是一种更为理想的碳点前驱体[30-31]。本实验以乌头酸为碳源,通过组合碳点制备中最常用的共掺杂试剂(乙二胺(EDA)或尿素(Urea))和碳化方法(水热法或微波法),分别制得4种光学性质优良的碳点(AA&EDA-HT-CDs、AA&EDA-MW-CDs、AA&Urea-HT-CDs、 AA&Urea-MW-CDs)。其中3种碳点发射蓝色荧光,1种发射黄色荧光。本实验选定蓝色荧光碳点中量子产率最高的AA&EDA-HT-CDs 和黄色荧光碳点AA&Urea-MW-CDs为对象,系统研究了其光学性质和形貌特征,并考察了其在分析化学中的应用潜力。
1 实验部分
1.1 试剂与仪器
乌头酸(98%,Alfa-Aesar公司);乙二胺(99%,天津百世化工有限公司);尿素(99%,天津光复化工有限公司)。其他试剂均为市售分析纯,实验用水为超纯水,所有试剂未经纯化直接用于实验。
家用微波炉(700 W,Midea公司)。碳点的紫外可见吸收光谱由UV 2800SPC分光光度计(上海舜宇恒平科学仪器有限公司)测量,荧光光谱由F97Pro荧光分光光度计(上海棱光技术有限公司)测量,测试时使用石英比色皿(10 mm×10 mm)。碳点的绝对量子产率及荧光寿命通过FLS920光谱仪(Edinburgh Instruments,U.K.)测定。透射电子显微镜照片用Tecnai F30(荷兰)拍摄,加速电压为200 kV。红外光谱用傅立叶变换红外光谱仪(NEXUS 670,Nicolet)进行测定。碳点的元素组成由Vario EL元素分析仪(Elementar,Germany)测定。粒径分布通过BI-200SM动态光散射仪(Brookhaven,USA)进行测定。X-射线光电子能谱用X-射线光电子能谱仪(XPS,PHI 5702)进行测定。RT-6100酶标分析仪(深圳雷杜生命科学股份有限公司)和激光共聚焦显微镜(Olympus FV-1000,405 nm,Japan)用于细胞毒性(MTT法)实验和细胞成像实验。
1.2 实验方法
1.2.1水热法制备乌头酸基碳点将0.087 1 g乌头酸和100.4 μL 乙二胺或0.225 1 g尿素溶于5 mL水中,反应溶液转移至聚四氟乙烯内衬水热合成釜中,置于烘箱中于180 ℃下反应5 h。反应完成后自然冷却至室温,将反应产物转移至培养皿中,在真空干燥箱中50 ℃条件下干燥8 h,得棕色粉末固体产物,分别命名为AA&EDA-HT-CDs和AA&Urea-HT-CDs。
1.2.2微波法制备乌头酸基碳点将0.087 1 g乌头酸和100.4 μL 乙二胺或0.360 4 g尿素溶于盛有5 mL水的锥形瓶中,将锥形瓶置于微波炉内,700 W功率下加热6 min或5 min。锥形瓶中的无色澄清溶液转变为褐色固体即表示荧光碳点生成。将锥形瓶置于真空干燥箱中50 ℃下干燥2 h,冷却至室温后将固体研磨成均匀的粉末用于后续实验,分别命名为AA&EDA-MW-CDs和AA&Urea-MW-CDs,其中AA&Urea-MW-CDs用反相硅胶柱进一步纯化。
1.2.3乌头酸基荧光碳点的细胞毒性实验细胞毒性用MTT 法进行评价:将肝癌细胞SMMC-7721接种在盛有RPMI-1640(Roswell Park Memorial Institute-1640)培养基(100 μL/孔,5%小牛血清、100 U/mL青霉素、100 U/mL链霉素)的96孔板中(约104个细胞/孔),在5% CO2、37 ℃下于恒温培养箱中培养。18 h后,向96孔板的实验组中加入适当浓度的碳点溶液,使其最终浓度由上到下依次为1 500、1 000、500、250、125 mg/L;对照组细胞培养过程中未加碳点溶液,于5% CO2、37 ℃下继续孵育36 h。随后更换新的培养基并向每孔加入10 μL的噻唑蓝(MTT,5 g/L)继续孵育4 h。除去培养基后,向各孔中加入100 μL DMSO并振荡摇匀,10 min内用酶标仪测定 490 nm 处的吸光度,依据下式计算并评估碳点对肝癌细胞的影响状况:Cell Viability(%)=ODTreated/ODControl×100%,其中,ODTreated为加入碳点的实验组的吸光度;ODControl为未加碳点的对照组的吸光度。
1.2.4乌头酸基荧光碳点的细胞成像实验将肝癌细胞SMMC-7721接种在盛有RPMI-1640培养基(1 mL/孔)的12孔板中(约含有106个细胞),在5% CO2、37 ℃下于恒温培养箱中培养24 h。向12孔板中加入适当浓度的AA&EDA-HT-CDs(800 mg/L)和AA&Urea-MW-CDs(800 mg/L)溶液,置于培养箱中继续孵育1 h后,弃去培养基并用磷酸盐缓冲溶液(PBS,10 mmol/L,pH 7.4)冲洗3次,用激光共聚焦显微镜采集成像结果。
2 结果与讨论
2.1 乌头酸基碳点的荧光性能
以乌头酸为碳源,乙二胺或尿素为共掺杂试剂,通过水热法和微波法分别制得3种蓝色荧光碳点(AA&EDA-HT-CDs、AA&EDA-MW-CDs、AA&Urea-HT-CDs)和1种黄色荧光碳点(AA&Urea-MW-CDs)。4种乌头酸基碳点的制备条件列于表1,后续实验以蓝色荧光碳点中量子产率最高的AA&EDA-HT-CDs和黄色荧光碳点AA&Urea-MW-CDs为研究对象。在自然光下,AA&EDA-HT-CDs和AA&Urea-MW-CDs的水溶液均澄清透明;在紫外灯(365 nm)下,AA&EDA-HT-CDs溶液发射出明亮的蓝色荧光(图1A插图),而AA&Urea-MW-CDs溶液呈黄色荧光(图1B插图)。在固体状态下,AA&EDA-HT-CDs在紫外灯下无荧光,而AA&Urea-MW-CDs在紫外灯下也能发射黄色荧光。由荧光光谱图可见,AA&EDA-HT-CDs的最佳激发波长为360 nm,最佳发射波长为441 nm,且谱线的半宽度较窄,仅为60 nm。其发射波长在激发波长由320 nm逐渐增至400 nm的过程中保持不变(图1A),显示出激发不依赖的光学性质。AA&Urea-MW-CDs的最佳激发波长为415 nm,最佳发射波长为525 nm。在激发波长由380 nm逐渐增至460 nm的过程中,其发射波长出现微弱红移(图1B)。通过绝对法测得AA&EDA-HT-CDs和AA&Urea-MW-CDs的量子产率分别为57%和44%。紫外可见吸收光谱显示,4种碳点在245 nm附近均有吸收,这是由于碳核中心存在π-π*跃迁。此外,黄色荧光碳点AA&Urea-MW-CDs还在325 nm和410 nm处有吸收,而蓝色荧光碳点AA&EDA-HT-CDs仅在350 nm处有吸收(图1)。

表1 乌头酸基荧光碳点的制备条件及光学性质Table 1 Preparation conditions and fluorescence properties of aconitic acid derived CDs

图1 AA&EDA-HT-CDs(A)和AA&Urea-MW-CDs(B)的荧光光谱及紫外可见吸收光谱(黑线)
Fig.1 Fluorescence spectra and UV-Vis absorption spectra(black line) for AA&EDA-HT-CDs(A) and AA&Urea-MW-CDs(B)insert:photographs of AA&EDA-HT-CDs and AA&Urea-MW-CDs under daylight(left) and UV lamp(right,365 nm),respectively
4种乌头酸基碳点的最佳激发/发射波长、量子产率(QY)及荧光寿命(τ)见表1。由表可知,掺杂试剂和碳化方法均会对碳点的荧光性质产生影响。就量子产率而言,乙二胺作为掺杂试剂所得碳点的量子产率整体高于尿素作为掺杂试剂的碳点。此外,以乙二胺作为掺杂试剂时,制备方法对碳点的荧光波长无显著影响,但水热法制得碳点的量子产率高于微波法。而以尿素作为掺杂试剂时,相比于水热法,微波法制得的碳点荧光波长显著红移,且量子产率更高。4种碳点的时间分辨荧光信号均为双指数衰减模式,黄色荧光碳点AA&Urea-MW-CDs的两个荧光寿命占比相差不大,分别为60.32%(4.53 ns)和39.68%(8.26 ns)。而对于另外3种蓝色荧光碳点,两个荧光寿命中的一个占比超过90%,表明虽然存在两条电子跃迁路径,但其中一条路径占绝对优势。综上,4种碳点表现出不同的荧光性质,其原因可能是由于微波法制备碳点的过程中加热速度较快,所得碳点表面产生了更多的缺陷,这些缺陷为电子的转移提供了多条路径。
2.2 乌头酸基碳点的结构表征
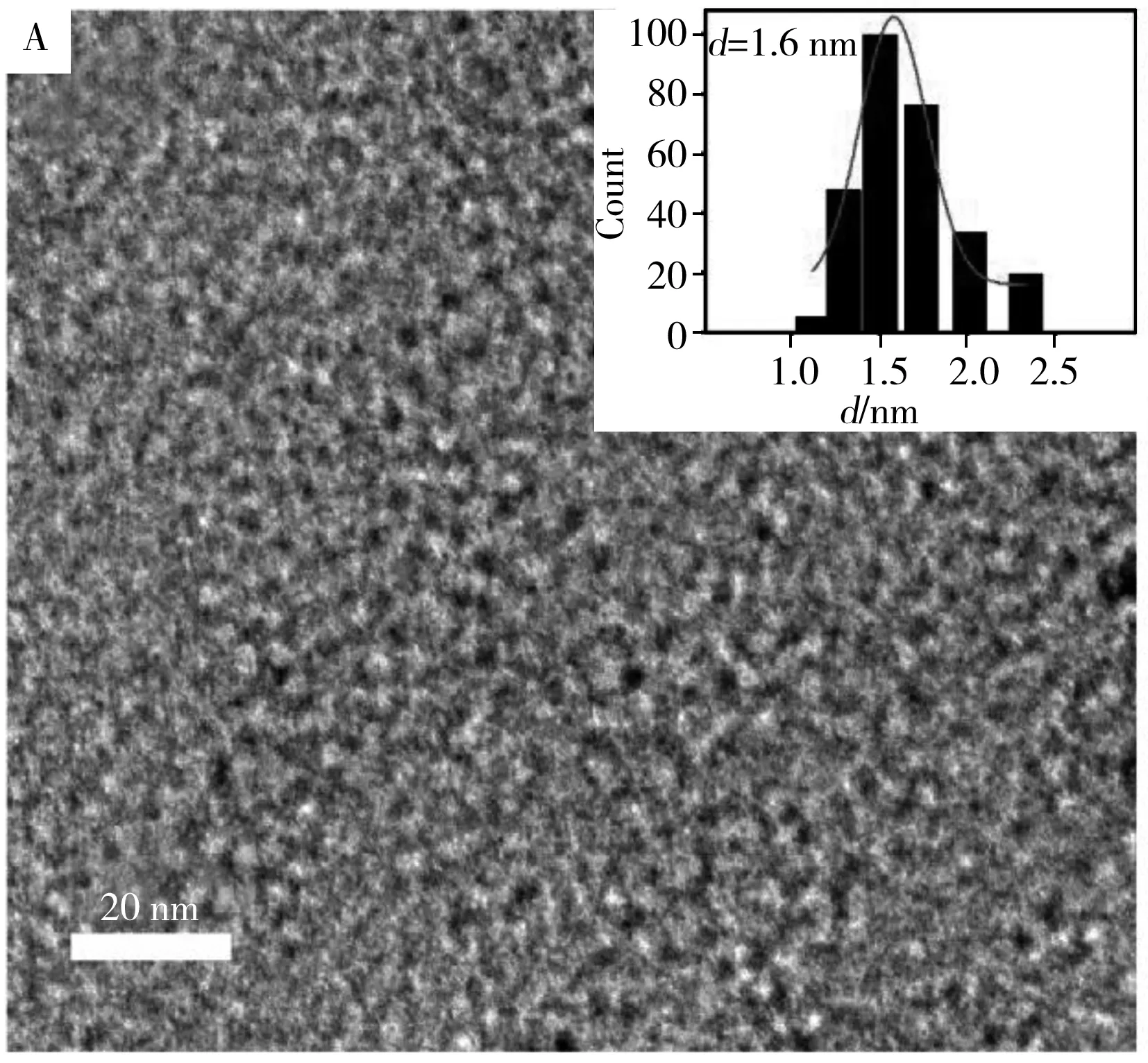
采用透射电镜(TEM)、傅立叶红外光谱(FTIR)、X-射线光电子能谱(XPS)等多种技术对蓝色荧光碳点AA&EDA-HT-CDs和黄色荧光碳点AA&Urea-MW-CDs的结构特征进行表征。由TEM照片(图2)可见,AA&EDA-HT-CDs和AA&Urea-MW-CDs均近似球形且具有良好的分散性,平均粒径分别为1.6 nm和3.6 nm。粒径统计结果则显示,水热法制备的碳点具有更均一的粒径。4种碳点的元素分析结果列于表2。与蓝色荧光碳点AA&EDA-HT-CDs相比,黄色荧光碳点AA&Urea-MW-CDs具有更高含量的氮元素和较低含量的氢元素,其原因可能是使用了不同的制备方法和共掺杂试剂,导致各碳点在元素种类及含量上的差异。

CDsCNHO(Calculated)AA&EDA-HT-CDs27.6411.454.0156.90AA&EDA-MW-CDs47.7318.636.4527.19AA&Urea-HT-CDs38.4914.935.8240.76AA&Urea-MW-CDs31.0332.442.6733.86
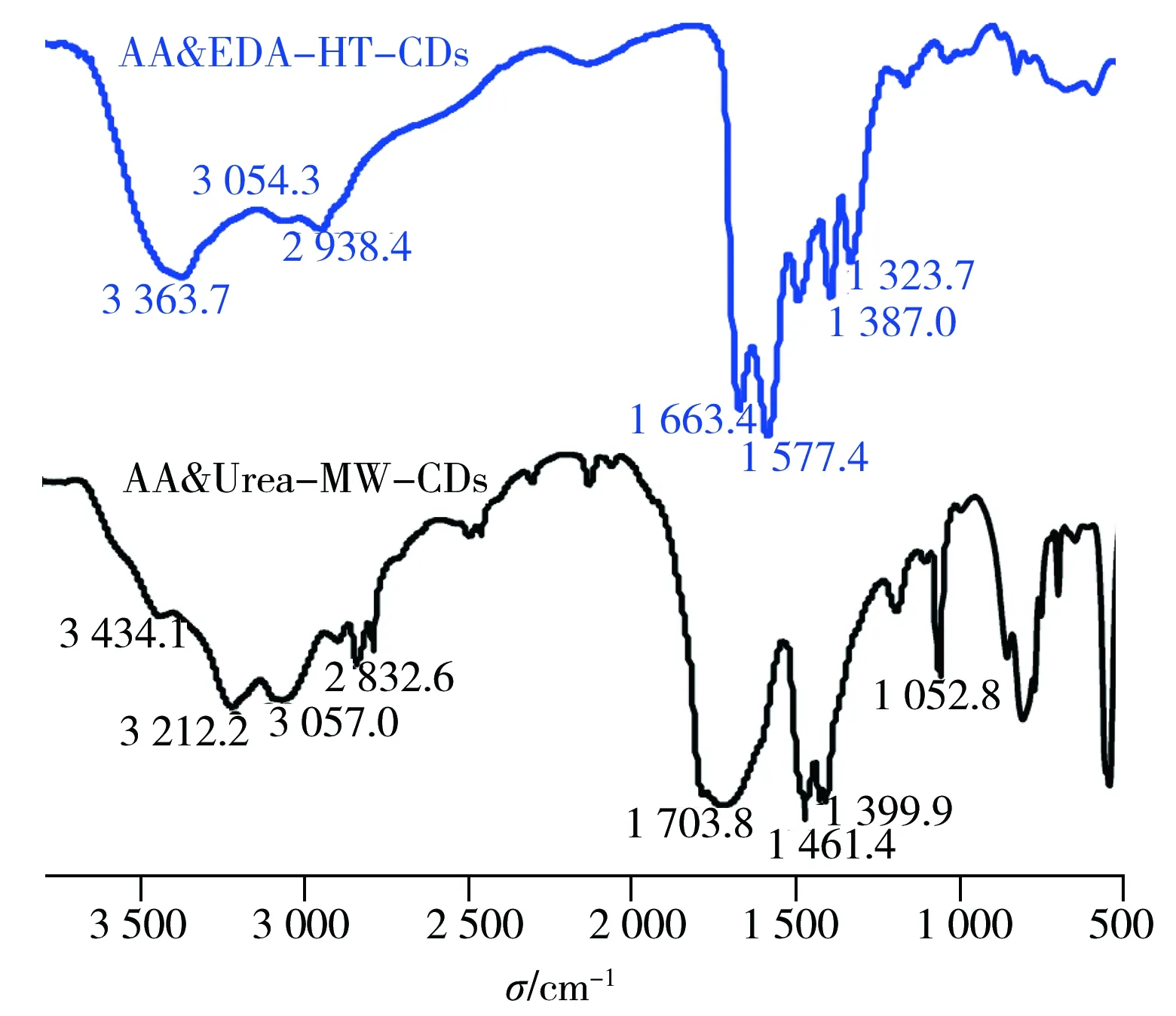
图3 AA&EDA-HT-CDs及AA&Urea-MW-CDs的红外光谱图Fig.3 FTIR spectra of AA&EDA-HT-CDs and AA&Urea-MW-CDs






2.3 乌头酸基碳点的离子响应特性
由于乌头酸基碳点的表面含有丰富的含氧和含氮基团,易与某些金属离子络合,导致碳点的荧光猝灭,据此可设计某些特定金属离子的传感测定方法。为评价乌头酸基碳点应用于分析领域的潜力,考察了溶液pH值和离子强度对碳点荧光的影响,结果显示,在强酸或强碱条件下,4种碳点溶液均出现荧光猝灭,但在溶液pH 5.0~10.0范围内,4种碳点的荧光强度均保持稳定。此外,4种碳点在不同浓度NaCl溶液中的荧光强度基本保持不变。这些特性预示了乌头酸基荧光碳点在生命分析领域具有潜在的应用价值。选择 Li+、K+、Ag+、Pb2+、Ba2+、Cd2+、Zn2+、Cu2+、Ni2+、Co2+、Mn2+、Ca2+、Mg2+、Fe2+、Hg2+、Cr3+、Fe3+、Al3+共18种常见的金属离子作为研究对象,筛查了所制备4种碳点的离子响应特性,金属离子浓度均为60 μmol/L。结果显示,AA&Urea-HT-CDs对Hg2+有较强的响应,对Fe3+也有一定的响应;AA&EDA-MW-CDs对Hg2+有较强的响应,但其荧光猝灭程度与AA&Urea-HT-CDs相比稍弱;而另两种碳点对18种金属离子均无响应。金属离子通常会与碳点表面的基团相互作用而导致碳点的荧光猝灭[5],据此可以认为,4种碳点的不同离子响应特性来源于其表面基团的差异,这与FTIR和XPS表征的结论一致。在此基础上,基于AA&EDA-MW-CDs发展了环境水体中Hg2+的测定方法[30]。
2.4 乌头酸基碳点的细胞成像实验
进行细胞染色实验前,采用MTT实验评估了蓝色荧光碳点AA&EDA-HT-CDs和黄色荧光碳点AA&Urea-MW-CDs对肝癌细胞(SMMC-7721)生长的影响(图6A、C),结果表明,经两种碳点孵育的细胞均未出现明显的死亡或形态变化,说明乌头酸基碳点具有较好的生物相容性。细胞成像实验显示,两种碳点均能很好地进入细胞,实现细胞的染色(图6B、D)。对比成像实验结果发现,蓝色荧光碳点AA&EDA-HT-CDs仅分布在细胞质中,而黄色荧光碳点AA&Urea-MW-CDs可部分进入细胞核。进一步研究了不同浓度的AA&Urea-MW-CDs孵育细胞后的成像情况,结果显示,较低浓度的AA&Urea-MW-CDs孵育细胞后,细胞核染色现象不明显,但随着碳点浓度的增加,细胞核中的荧光信号逐渐增强,说明AA&Urea-MW-CDs具有细胞核染色能力。通常而言,粒径小于8 nm,且能够与核酸和染色质发生相互作用的纳米颗粒才能够进入细胞核[32]。本实验中,粒径较大的AA&Urea-MW-CDs(3.6 nm)比粒径较小的AA&EDA-HT-CDs(1.6 nm)更易进入细胞核,推测是因为AA&Urea-MW-CDs的表面基团使其更易与核酸和染色质发生相互作用。


3 结 论
本文以乌头酸为前驱体,乙二胺或尿素为共掺杂试剂,分别采用水热法和微波法,制备了4种光学性质优良的荧光碳点,其中3种发射蓝色荧光,1种发射黄色荧光。蓝色荧光碳点AA&EDA-HT-CDs 的绝对量子产率为57%,黄色荧光碳点AA&Urea-MW-CDs的绝对量子产率为44%,采用多种手段对比研究了此2种碳点的粒径分布、元素组成以及表面基团等,讨论了导致光学性质差异的可能原因。并进一步对比研究了4种乌头酸基碳点的离子响应特性,实验结果显示了碳点表面基团的不同,同时也说明此类碳点具备作为荧光纳米探针的潜力。细胞毒性实验则显示,所制备的乌头酸基碳点具有良好的生物相容性,并成功用于细胞染色,尤其是黄色荧光碳点AA&Urea-MW-CDs,初步显示了其具备细胞核染色的能力。
