胰腺癌增强CT检查及报告的规范化
2018-10-25边云陆建平
边云 陆建平
胰腺癌(pancreatic cancer,PC)的早期诊断、规范整治是改善预后的关键因素,分期不同的PC患者预后差异较大。从治疗角度考虑,肿瘤的位置、大小、有无血管侵犯、淋巴结转移以及其他脏器转移或累及是决定手术策略的主要因素,因此客观、准确、全面的影像检查及诊断报告对术前分期预测至关重要。然而在临床实际工作中,鉴于对PC认识和多学科之间协同的差异,大部分PC影像学检查和诊断报告的主观性强、检查方案不到位、描述内容不全面、语言自由度高,术语使用不规范,导致影像学的价值受限,多学科交流困难,并且给患者带来不必要的重复检查和经济浪费。笔者结合美国癌症联合会(AJCC)第8版[1]和日本胰腺学会(JPS)第7版[2]TNM分期更新要点阐述影像学检查及诊断报告的规范化。
一、规范的影像检查技术
1.多层螺旋CT增强扫描技术:高质量的CT增强检查仍是PC诊断和分期的首选方法。在确保受检者无任何禁忌证前提下,受检者需空腹、禁食不禁水6 h。扫描前20~30 min对受检者进行呼吸训练,并饮入1 000 ml水作为肠道的阴性对比剂。如有条件可给受检者注射少许解痉剂以防止肠道过度蠕动产生气体而影响图像质量。
对可疑或确诊的PC患者均需行胰腺多层螺旋CT(multislice spiral CT, MSCT)增强扫描,扫描范围包括从胸腔到盆腔[3],对比剂通常选用非离子型碘胺。胰腺CT扫描分为平扫期、动脉早期、动脉晚期(胰腺实质期)、门脉期和延迟期。动脉早期胰腺实质强化不明显,主要评估肿块周围的重要动脉。动脉晚期可以获得正常胰腺组织和肿块间的最佳对比度,是诊断PC的最佳期相,该时相选用小视野扫描(240 mm×240 mm)可明显提高空间分辨率和密度对比分辨率,有助于细节显示(图1)。门脉期主要用来评估肿块周围重要静脉和肝脏转移情况。延迟期正常胰腺实质内造影剂基本退出,若此时仍可见局灶性强化,多为残留正常胰腺组织和炎症间质的延迟强化,此期也可评估肝脏转移情况。

(陆建平,海军军医大学附属长海医院影像医学科主任、主任医师、教授、博士生导师。总后勤部优秀中青年技术专家、中央军委保健会诊专家、上海市优秀学科带头人及国务院特殊津贴获得者;国家临床重点专科及全军影像医学中心带头人。担任全军放射医学专业委员会副主任委员、中国消化医师分会影像专委会副主任委员、中国胰腺病医师分会常委;《放射学实践》杂志副主编、多篇SCI及核心期刊审稿专家。擅长CT和MRI高新技术综合应用、腹部疾病及血管病变影像诊断。获国家科技进步二等奖1项、军队医疗成果二等奖3项;承担国家、军队和省部级以上项目11项;主编或副主编专著6部;作为通信作者发表SCI论文30余篇。)
增强CT检查中对比剂注射速率、各期扫描延迟时间、扫描的层厚设置均会明显影响胰腺图像质量。Tublin等[4]研究表明对比剂注射速率5 ml/s的图像质量优于2.5 ml/s。目前,大多数研究认为对比剂注射速率4~5 ml/s可获得肿瘤与胰腺实质的最佳对比度[5]。Schueller等[6]认为,对比剂注射速率提高到8 ml/s可进一步提高胰腺实质和病灶的对比度;各期扫描时间对图像的质量也非常重要,通常采用小剂量测试和对比剂自动追踪技术(阈值为200 HU)两种方法来决定,对比剂注射速率为4 ml/s、动脉延迟期为28 s时可获得最佳胰腺图像。此外,为了得到良好的三维后处理图像,胰腺MSCT的层厚应该尽量薄,要求<1 mm。长海医院MSCT在常规胰腺扫描的基础上增加了小视野、动脉晚期扫描,大大提高了小肿瘤的可视化程度。具体扫描条件:120 kV,300 mA。扫描参数:准直2.5 mm,层厚0.5 mm,重建间隔3.0 mm,螺距5.3,矩阵512×512,视野348 mm×348 mm。扫描时间15~20 s,延迟时间根据小剂量试验确定,阈值为180 HU。对比剂为非离子型普碘胺,355 mgI/ml,总量90~95 ml,注射流率5.5 ml/s,由高压注射器经前臂静脉团注,继之注射98 ml生理盐水以同样流率冲洗。分别于注射对比剂后20~25 s、30~35 s、60~70 s、110~130 s行动脉早期、动脉晚期、门脉期和延迟期扫描,扫描范围包括从膈肌至盆腔。
2.增强后数据的三维后处理:MSCT主要的后处理技术有多平面重组(multi-plane reformation, MPR),最大密度投影(maximum intensity projection, MIP)、曲面重建(curve plane reformation, CPR)、容积再现(volume rendering, VR)。每种技术都有自身的优点,可以从不同角度显示肿瘤的特征。MPR技术与薄层MIP技术类似,可以在多个平面上显示肿瘤与附近重要血管的关系以及淋巴结转移的情况;厚层MIP技术可以进一步显示血管受侵的程度;CPR技术采用曲面截取三维容积数据,可以将弯曲的主胰管或血管全程在一个平面完整清晰地显示,可观察到PC继发的胰管改变,明确血管受侵程度;VR技术可以直观、立体地呈现出受侵犯血管的狭窄和迂曲(图2)。
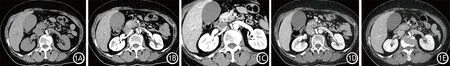
图1 胰腺多层螺旋CT扫描的平扫期(1A)、动脉早期(1B)、动脉晚期(1C)、门脉期(1D)、延迟期(1E)图像。动脉早期利于胰周动脉评价,动脉晚期病灶与正常胰腺实质对比度最佳(钩突部病灶,箭头),门脉期利于胰周静脉和肝转移的评价,延迟期正常胰腺实质内造影剂基本退出,呈低密度
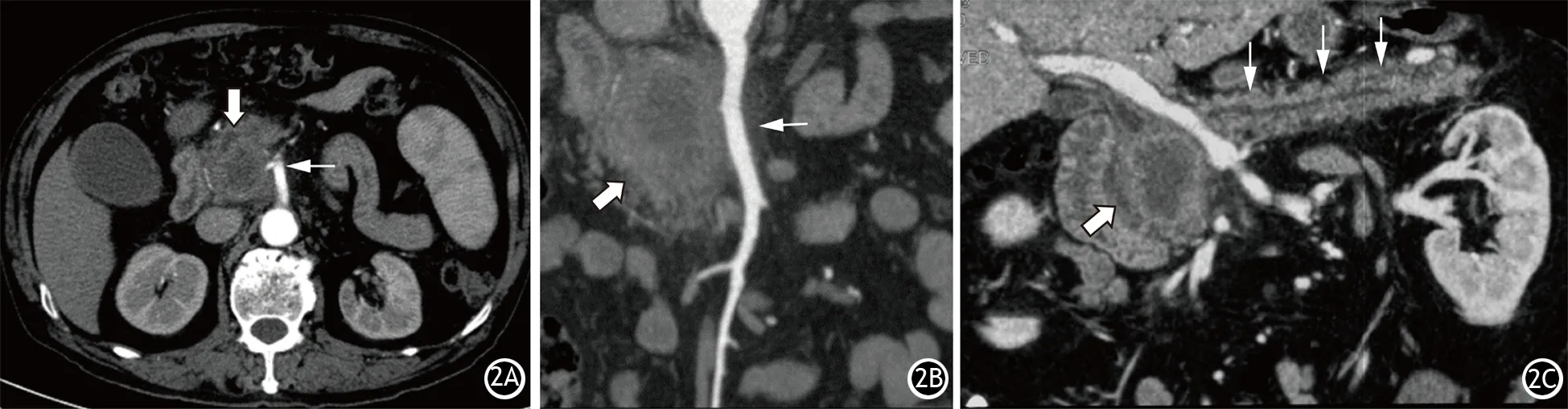
图2 胰腺癌各种三维后处理图像。胰腺横断面动脉早期示钩突部类圆形低密度肿块影(粗白箭头),与肠系膜上动脉接触角度>180°(细白箭头,2A),沿肠系膜上动脉的图像更清楚地显示肿块(粗白箭头)与肠系膜上动脉(细白箭头)接触的角度和长度(2B),沿主胰管的图像见钩突部低密度肿块(粗白箭头)导致上游胰管明显扩张(细白箭头,2C)
二、肿瘤的影像报告
1.位置:通常将肿块部位分为胰头、胰体和胰尾。胰头位于肠系膜上静脉(superior mesenteric vein, SMV)和门静脉(portal vein, PV)汇合处的右侧缘,胰体位于SMV和PV汇合处至腹主动脉,胰尾位于腹主动脉至脾门,此外还要关注两个特殊解剖部位,即钩突和胰颈。
2.大小:采用RECIST1.1实体肿瘤疗效评价标准[7]的单径测量法测量肿瘤大小,该方法简单、误差小,可重复性高,且可更加客观准确地评价放化疗治疗前后的疗效。笔者推荐在增强后的动脉晚期测量肿块大小,因此期肿瘤与正常胰腺对比度最大。在横断面上寻找肿瘤最大CT层面,并放大图像后测量肿瘤最长径(图3)。
肿块的大小与肿瘤T分期预测密切相关。在临床实践中判断肿瘤是否侵犯至胰腺外主观因素很大,且胰腺相对较薄,无包膜,较多PC常伴有慢性胰腺炎,致使胰腺实质与周围组织分界不清晰,所以较多PC往往被列入T3期。Allen等[8]为验证AJCC第7版PC分期系统的准确性及可重复性,分别评估了美国纪念斯隆-凯特琳癌症中心、麻省总医院和约翰·霍普金斯医院的胰腺外科中心2 318例

图3 胰腺癌影像T分期预测。横断面CT动脉晚期图像示胰头部一类圆形低密度灶(箭头,3A),预测为T1期;胰颈部一边界不清的低密度影(箭头,3B),预测为T2期;胰尾部一类圆形低密度灶(箭头,3C),预测为T3期;胰体部一类圆形低密度灶(箭头),肿块与腹腔动脉干接触<180°(3D),预测为T4期(图左上角给出肿块测量方法)
R0切除的PC患者的预后,结果3家医院获得R0切除的T3N0患者的预后有差异(P=0.054),说明该分期标准在可重复性方面存在缺陷,此外肿瘤是否可切除还取决于各家医院的手术水平。因此,AJCC第8版PC分期对第7版做了以下更新:(1)T2期定义为肿瘤位于胰腺内,最大径>2 cm~≤4 cm,替换了第7版的肿瘤位于胰腺内,最大径>2 cm;(2)T3期定义为肿瘤最长径>4 cm,但尚未累及腹腔干(celiac axis, CA)或肠系膜上动脉(superior mesenteric artery, SMA),替换了第7版的肿瘤累及胰腺外组织,但未侵及CA或SMA;(3)T4期定义为肿瘤累及CA、SMA和(或)肝总动脉(common hepatic artery, CHA),不考虑肿瘤大小,替换了第7版的肿瘤侵犯CA和SMA(局部不可切)。为此,影像科医师需要对肿瘤的测量更加准确与精细化,同时对小PC和早期PC的影像诊断也提出更高要求。
3.密度:以动脉晚期正常胰腺实质的密度为参照,将肿块分为低密度、等密度、高密度。此外需对肿瘤内部出血、钙化或者液化等改变进行描述。
4.胰胆管系统:胰胆管改变有时是PC的重要间接征象,需要表述肿块附近胰管和胆管情况,包括狭窄、中断、伴或不伴有上游胰胆管的扩张及扩张程度。
三、胰周血管的影像报告
美国腹部放射学会及美国胰腺协会制定的胰腺导管腺癌放射学结构化报告共识[9-10]的内容中包括胰周动脉和静脉的评价。
1.胰周动脉:胰周动脉包括CA、SMA、CHA和腹主动脉(abdominal aorta,AA)。影像报告需要明确给出动脉与肿瘤有无接触面、接触面≤180°还是>180°,血管管腔口径是否变窄、变形。当血管与实性肿瘤接触面出现云雾状或索条状密度增高影时需要明确这些密度增高影与血管之间的接触关系。
在临床工作中也要描述以下动脉变异或分支:(1)SMA第一分支。肿瘤浸润到SMA第一分支,如空肠动脉、结肠动脉,将会影响到血管重建及肿块是否可切。(2)CHA。需要注意的是该分支变异度极大,因此影像重建及报告中需要详细指出肿瘤与CHA的接触关系及其变异类型。(3)动脉变异。CA和SMA的个体变异度较大,尤其是肝右动脉起自SMA的变异,均可能影响手术计划,因此需要三维重建血管并明确肿瘤是否侵犯变异血管。也需要清楚表述AA硬化、CA和SMA狭窄等情况。
2.胰周静脉:胰周静脉包括PV、SMV和下腔静脉(inferior vena cava,IVC)。静脉的影像学评价内容与动脉类似,此外还需描述SMV第一属支与肿瘤的关系,静脉内是否有瘤栓或者非感染性血栓、局部管径的狭窄、管腔的不规则变形或泪滴样变形、是否伴有门脉高压和侧支循环等。
四、淋巴结的影像报告
AJCC第7版将淋巴结转移情况简单分为N0期和N1期,即区域淋巴结无或有转移。Vatsangkar等[11]回顾性分析了美国SEER数据库14 907例PC患者资料,结果表明足够的淋巴结检出数量是N分期准确的基础,并建议PC切除标本的淋巴结检出数目应为13~16枚。Strobel等[12]回顾性研究德国海德堡大学医院811例胰头癌切除资料,结果表明足够的淋巴结检出数量有助于准确判断N分期,提高根治率。转移性淋巴结数较淋巴检查数目更有助于判断患者预后,标准的胰十二指肠切除标本淋巴结检出数目应>20枚。因此,AJCC第8版对第7版中“N1”的笼统表述进行了分层,即区域淋巴结转移1~3枚为N1期,区域淋巴结转移≥4枚为N2期,并强调N2期的意义及其对患者预后的影响。JPS第7版更新中将N1期又分层为N1a期(1~3枚转移性淋巴结)和N1b期( 4枚转移性淋巴结)[2],与AJCC接轨,但两者均未给出淋巴结检查的数目。AJCC和JPS在N分期上的更新可以看出阳性淋巴结对PC患者预后的重要性,体现了N分期的权重。
一项Meta分析研究结果表明CT对PC淋巴结诊断的汇总敏感度为25%,汇总特异度为86%,阳性预测值为31%,阴性预测值为84%,但大部分文献的主要缺陷是很难得到与病理对应区域淋巴结转移的印证[13]。方旭等[14]对病理证实的30例PC淋巴结转移患者的CT进行回顾性研究表明,CT诊断阳性淋巴结为53/63枚,诊断准确率为84.1%。CT对PC胰周淋巴转移敏感度较低的主要原因是淋巴结转移与其大小无明确相关性,与肿瘤大小也不成比例,此外病理对胰周淋巴结取材缺乏规范与标准,区域淋巴结无明确界定。然而影像诊断仍有一定规律可循,JPS描述的18组淋巴结均与胰周血管伴行,具有明确的分布特征,胰头癌常发生6、8、13、14、17组淋巴结转移,胰体尾癌常发生8、9、10、11、18组淋巴结转移。胰头癌第13组(胰十二指肠后组)为前哨淋巴结,体尾癌第11组(脾动脉周围组)和第9组(腹腔干周围组)为前哨淋巴结[15-16]。复旦大学胰腺肿瘤研究所研究表明,第16组淋巴结转移的14例患者均同时伴有第13、l4组淋巴结转移,所以推测肿瘤细胞从第13组经第l4组转移至第16组[17]。因此在诊断时要根据胰腺肿块的位置,循着淋巴结分布路径仔细观察,当淋巴结的短轴直径>10 mm,密度不均匀,不均匀强化,内部有坏死、融合,边缘模糊、累及周围脏器或血管[1,18]等特征时高度提示转移。
五、胰外局部侵犯和转移的影像报告
JPS第7版对周围组织或器官的肿瘤浸润制定了细化标准,分别用远端胆管、十二指肠、胰前、胰后、门静脉系统、动脉系统、胰周神经丛、其他器官侵犯等予以表述。“0”为无浸润,“1”为有浸润,“X”为不能明确。由此可见,在影像报告中描述肿瘤与周围脏器的关系也十分重要。笔者认为需要给出的胰外评价如肝脏、腹膜和网膜等要明确有无转移、可疑转移、性质能否确定;胃、十二指肠、空回肠、结肠、肾上腺等有无直接侵犯,有无腹水或胸腔积液等(图4)。

图4 胰腺横断面门脉期CT增强图像。胰头部见类圆形低密度灶,伴局部假性囊肿,肿块与十二指肠降段(箭头)和胃壁分界不清(箭头,4A);胃底、脾门、肝内门静脉属支增粗、迂曲(箭头,4B);肝内多发低密度结节影(4C);大网膜多发结节灶(箭头,4D)
由此可见,AJCC第8版和JPS第7版是以循证医学为依据对PC分期系统进行更新,这一修订对放射科医师提出了新的要求和挑战。PC的影像报告是影像科与多学科交流的重要手段,也是PC诊治规范的依据,为PC个体化治疗以及判断预后提供重要的指导信息。然而,很多评价内容会给临床工作带来较重的负担,也可能会因日常工作的惯性和惰性导致胰腺影像报告的随意化。因此,长海医院采用底层格式结构化的报告模板可能有助于规范PC的影像报告,也有利于多学科交流和科学研究,仅供参考(图5)。

图5 胰腺癌多层螺旋CT结构化报告模板
