HS/SPME-GC/MS法研究大菱鲆和南美白对虾冷藏中的典型TVB-N组分变化规律
2018-10-24晁晴晴周贺彩曹立民隋建新
晁晴晴,周贺彩,曹立民,林 洪,隋建新
(中国海洋大学食品科学与工程学院,山东青岛 266003)
大菱鲆(Scophthalmusmaximus)又称蝴蝶鱼、多宝鱼,口感优良、营养价值高,主要产于大西洋东侧沿海,是名贵的低温经济鱼类,我国山东地区养殖量较大[1]。南美白对虾(Penaeusvannamei)又称白肢虾、白对虾,学名为凡纳滨对虾,肉质鲜嫩、富含氨基酸蛋白质,是目前世界上三大养殖对虾中单产量最高的虾种,也是我国最主要的养殖品种[1]。TVB-N是动物性蛋白质在酶和微生物的作用下产生的氨以及胺类等碱性含氮物质,与腐败过程中产生的有机酸相结合,形成的一种具有挥发性的盐基态氮,主要包括NH3、MA、DM和TMA[2]。TVB-N作为评价水产品鲜度的指标已被广泛使用[2],但是TVB-N在贮藏过程中会出现下降或出现波动,用于评价某些水产品的鲜度并不可靠[2,3-5],有报道称TMA[6]、TMA/TVB-N[7]等作为鲜度的评价指标会比TVB-N更为可靠。不同水产品在腐败过程中TVB-N的变化不同,其各组分的变化也存在差异,因此准确、系统地分析表征不同种类水产品腐败过程中TVB-N各组分的变化规律,可为更加深入、全面地分析评价各种水产品的鲜度提供新的依据和思路。
目前关于TVB-N主要组分的检测方法有苦味酸比色法、气相色谱法、气相色谱-质谱联用法等。苦味酸比色法是测定火腿中TMA的国标方法,其实际检测的是各种能与苦味酸结合的有机胺的总和,结果偏高,且需要用到高毒试剂甲苯[8];气相色谱法是挥发性物质的常用检测方法,但是挥发性胺类物质分子质量小且具有高水溶性[9],在大多数色谱柱上会很快溜出[10],一般需要有机溶剂提取,导致灵敏度降低[11];顶空固相微萃取技术可使取样和富集同时进行,与气相色谱、质谱联用,不仅快速高效,还可以减少样品流失,目前已用于水产品[12-15]及其它食品中[16-17]多种挥发性物质的分离鉴定,顾强等[18]利用HS/SPME-GC/MS技术检测了食用油中6种苯系物残留量,吕光等[19]利用该技术同时检测了生活饮用水中9种半挥发性有机物含量,利用该方法进行水产品中TVB-N多种组分的同时定量检测分析却鲜有报道。
本研究旨在利用HS/SPME-GC/MS技术,优化萃取条件,建立同时检测NH3、MA、DMA和TMA的方法,然后探究不同种类水产品大菱鲆和南美白对虾冷藏过程中TVB-N四种主要组分含量的变化,为分析理解不同水产品中挥发性胺类物质在加工流通过程中的变化及其对鲜度评价的影响提供进一步的参考。
1 材料与方法
1.1 材料与仪器
鲜活大菱鲆(规格一致,1.0~1.5 kg/条)、鲜活南美白对虾(规格一致,15~20 g/只) 青岛市利群超市;氯化铵(NH3)、甲胺盐酸盐(MA)、二甲胺盐酸(DMA)、三甲胺盐酸盐(TMA) 上海麦克林生物科技有限公司;三氯乙酸 天津市凯信化学工业有限公司;无水碳酸钾 国药集团化学试剂有限公司;其它试剂 均为分析纯。
GCMS-QP2010SE 日本SHIMADZU;50/30 μm二乙烯苯/碳分子筛/聚二甲基硅烷(Divinylbenzene/Carboxen/Polydimethylsiloxan,50/30 μm DVB/CAR/PDMS)、65 μm PDMS/DVB、65 μm PDMS/DVB+OC、75 μm CAR/PDMS、85 μm CAR/PDMS萃取纤维 美国SUPELCO;SPME手动进样手柄 美国SUPELCO;CP-Volamine色谱柱 美国Agilent Technologies;DF101S集热式恒温加热磁力搅拌器 河南省予华仪器有限公司;西贝乐2119F食品加工机 上海帅佳电子科技有限公司。
1.2 实验方法
1.2.1 不同水产品在冷藏过程中TVB-N主要组分的变化规律
1.2.1.1 样品处理 鲜活大菱鲆和南美白对虾运至实验室,大菱鲆敲头致死,去头去尾去皮去内脏,取鱼肉;南美白对虾碎冰休克致死,去头剥壳去肠线,取虾肉。将大菱鲆肌肉和虾肌肉沥干,每20 g分装用于TVB-N组分的测定。所有样品均置于4 ℃冰箱中冷藏。每隔两天取大菱鲆样品进行测定,每天取虾肉样品进行测定。
1.2.1.2 样品TVB-N主要组分的测定 取分装好的试样,搅碎至糜状,精确称取10 g置于具塞锥形瓶中,准确加入100 mL 5%三氯乙酸,不时振摇,使试样在样液中分散均匀,浸渍30 min后过滤。准确吸取1 mL滤液于8 mL样品瓶中,按照1.2.3.1的方法进行测定,计算样品NH3、MA、DMA和TMA的质量浓度。
1.2.2 TVB-N各组分检测条件的确定
1.2.2.1 气相色谱-质谱联用条件 色谱条件:CP-Volamine色谱柱(30 m×0.32 mm×5 μm),载气He,分流进样,分流比5∶1,流速1.5 mL/min,进样口温度200 ℃,柱温程序为35 ℃,保持4 min,以15 ℃/min升高至100 ℃,保持3 min。质谱条件:接口温度250 ℃,离子源温度230 ℃,检测电压0.88 kV,溶剂延迟0.5 min。选择全扫描(SCAN)模式定性,离子扫描(SIM)模式定量,在SIM模式下,四种挥发性胺类物质的保留时间、目标离子、参考离子见表1。
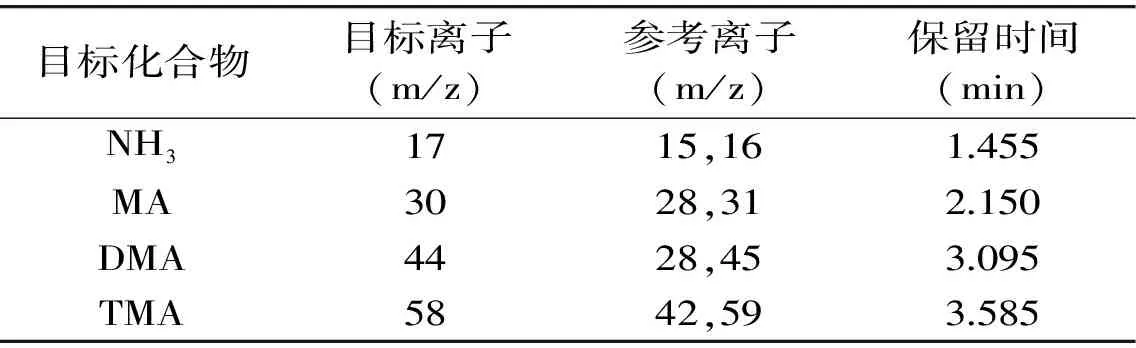
表1 SIM模式下NH3、MA、DMA和TMA的保留时间及特征离子Table 1 The scanned ions and retention times of NH3,MA,DMA and TMA under SIM mode
1.2.2.2 萃取纤维的确定 分别配制100、300、500、700、900 mg/100 mL的NH3、MA、DMA和TMA标准溶液,40 ℃条件下,使用50/30 μm DVB/CAR/PDMS,65 μm PDMS/DVB,65μm PDMS/DVB+OC,75 μm CAR/PDMS,85 μm CAR/PDMS五种萃取纤维分别进行萃取,比较各萃取纤维的吸附萃取能力,确定是否达到各个纤维的饱和吸附量,选择出同时萃取NH3、MA、DMA和TMA的最佳萃取纤维。
1.2.2.3 萃取温度的确定 用NH3、MA、DMA和TMA配制浓度为30 mg/100 mL的混合标准溶液,固定萃取转速200 r/min,萃取时间5 min,分别考察20、30、40、50、60、70 ℃时85 μm CAR/PDMS萃取纤维对NH3、MA、DMA和TMA的萃取能力,选择出合适的萃取温度。
1.2.2.4 萃取时间的确定 固定萃取温度40 ℃,转速200 r/min,分别考察萃取时间为1、3、5、7、10、15、20 min时,NH3、MA、DMA和TMA的萃取量,选择出合适的萃取时间。
1.2.3 HS/SPME-GC/MS萃取方法对TVB-N组分检测效果的鉴定
1.2.3.1 TVB-N各组分标准曲线测定 标准储备溶液:使用5%三氯乙酸分别配制浓度为1 g/100 mL的NH3、MA、DMA和TMA标准储备液,4 ℃条件下保存。标准使用溶液:分别吸取一定体积的NH3、MA、DMA和TMA标准储备液,使用5%三氯乙酸将标准储备溶液梯度稀释至0.1、0.5、1.0、3.0、5.0、7.5、10、15、20、30、50、100 mg/100 mL的混合标准溶液。准确吸取1 mL混合标准溶液于8 mL样品瓶中,密封,使用2 mL无菌注射器加入2 mL饱和碳酸钾,选择85 μm CAR/PDMS 萃取纤维,设定萃取温度40 ℃,转速200 r/min,萃取5 min。萃取完成后,将萃取纤维迅速从顶空瓶中抽出,插入进样口进行解吸,解吸时间1 min。每个混合标准溶液浓度做三次平行。
1.2.3.2 精密度实验 配制浓度为5 mg/100 mL混合标准溶液,按上述方法进行六次平行实验。
1.2.3.3 回收率实验 向大菱鲆和南美白对虾提取液中分别加标准溶液,分别计算NH3、MA、DMA和TMA的加标回收率,每种挥发性胺类物质分别添加三个浓度,每个实验重复三次。
1.2.3.4 方法检测限 配制低浓度混合标准溶液,以该实验条件下仪器能检出的最低样品浓度为方法检出限,以仪器显示的信噪比S/N=3计算仪器检出限。
1.3 数据统计与分析
利用Origin 8.5软件进行绘图,采用SPSS 19.0软件进行单因素方差分析,同时采用LSD法进行两两比较,p<0.05为显著性差异。
2 结果与分析
2.1 TVB-N各组分萃取条件的确定
2.1.1 萃取纤维的确定 使用不同的萃取纤维进行萃取,探究不同萃取纤维对NH3、MA、DMA和TMA萃取能力,结果如图1所示,85 μm CAR/PDMS萃取纤维对NH3、MA和DMA吸附能力最强,尤其在浓度低于300 mg/100 mL时,85 μm CAR/PDMS萃取纤维吸附优势明显;而五种萃取纤维对TMA的吸附效果没有显著差异(p>0.05)。综合考虑食品中TVB-N要远低于300 mg/100 g,本研究确定采用85 μm CAR/PDMS萃取纤维测定TVB-N组分及含量。

图1 不同萃取纤维对NH3、MA、DMA和TMA的萃取能力Fig.1 Extraction ability of different extraction fibers to NH3,MA,DMA and TMA
2.1.2 萃取温度的确定 固定萃取转速和萃取时间,探究萃取温度对NH3、MA、DMA和TMA萃取能力的影响。萃取温度对富集过程的影响具有双重性[20-21],对于HS-SPME来说,加热有助于分析物脱离复杂的基体进入顶空气相,但吸附是放热过程,平衡条件下,温度的升高会使分析物在涂层和样品中的分配系数减小,灵敏度降低[20]。由图2可知,四种物质的萃取效果均随温度的升高先上升后下降,超过50 ℃四种物质的吸附能力均下降,说明高温下低沸点成分在萃取纤维上更容易被解吸[22]。NH3、MA、DMA和TMA分别在40、30、50、30 ℃萃取效果最好。30 ℃时MA和TMA的萃取精密度低,重复性较差;50 ℃时除DMA外其余三种物质的萃取效果明显下降;40 ℃时,四种物质的精密度均较高,且萃取效果良好,综合精密度及萃取效果,确定萃取温度为40 ℃。

图2 萃取温度对NH3、MA、DMA和TMA萃取量的影响Fig.2 Effect of extraction temperature on the extraction of NH3,MA,DMA and TMA
2.1.3 萃取时间的确定 固定萃取温度和转速,探究萃取时间对NH3、MA、DMA和TMA萃取能力的影响,85 μm CAR/PDMS为多孔固相涂层,萃取纤维对样品的吸附属于竞争吸附,为避免样品中的组分的竞争吸附影响定量,应在非平衡态下较短时间内萃取[18]。由图3可知,当萃取时间为3 min时,NH3的萃取量最大,但此时重复性差;MA在15 min时萃取效果最好,但其它三种物质在15 min时萃取效果均有所降低,DMA和TMA在萃取时间为5 min时萃取量最大,且重复性好。综合考虑重复性与萃取量,选择萃取时间5 min。
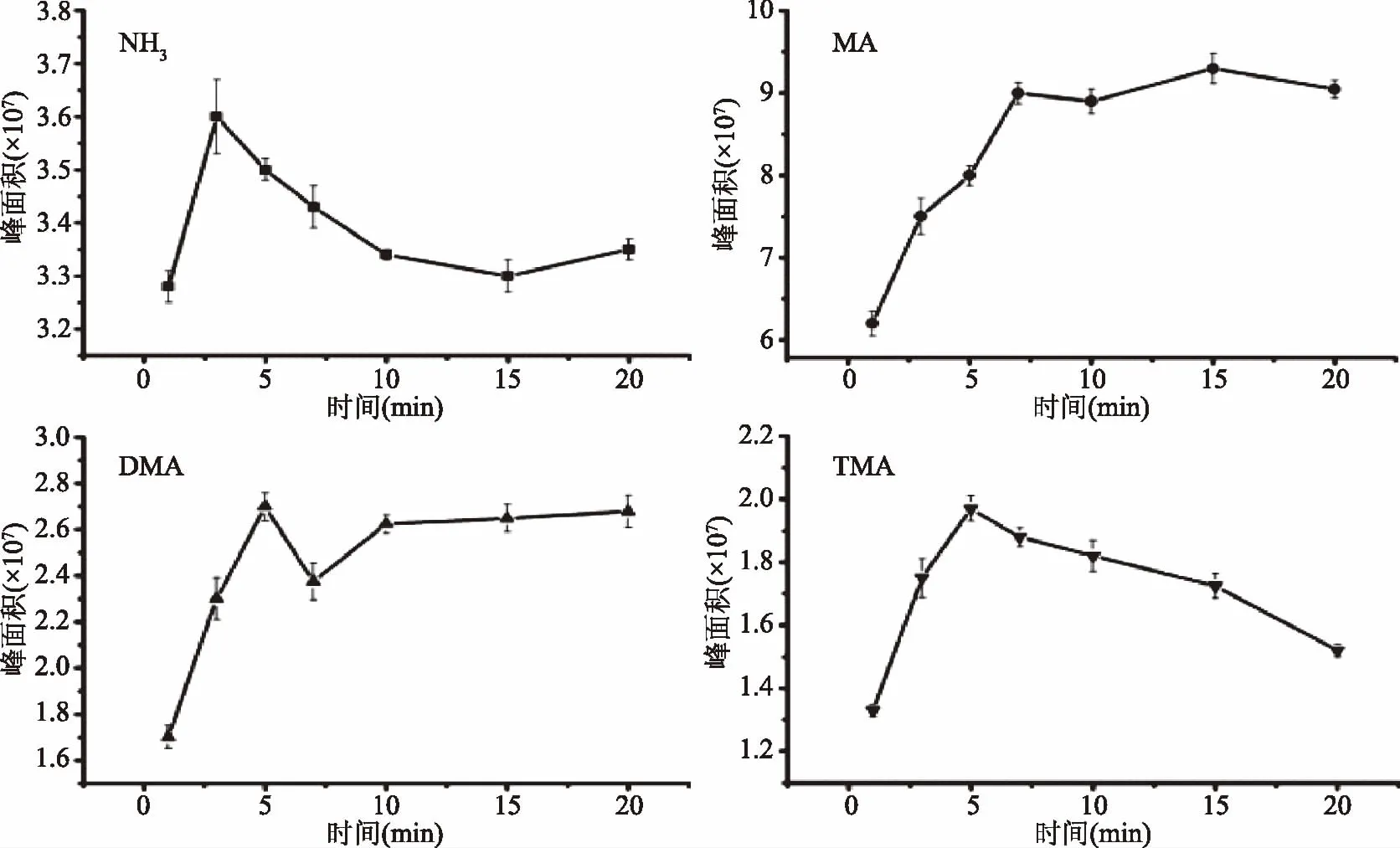
图3 萃取时间对NH3、MA、DMA和TMA萃取量的影响Fig.3 Effect of extraction time on the extraction of NH3,MA,DMA and TMA
2.2 HS/SPME-GC/MS对于TVB-N组分的检测效果
2.2.1 标准曲线的测定 由于竞争性吸附效应的存在,不同浓度的物质在萃取纤维上的吸附程度不一致会导致线性范围较窄[23]。由表2可知,建立的HS/SPME-GC/MS方法测得的NH3、MA、DMA、TMA线性范围良好,相关系数均在0.999以上,可用于样品检测。
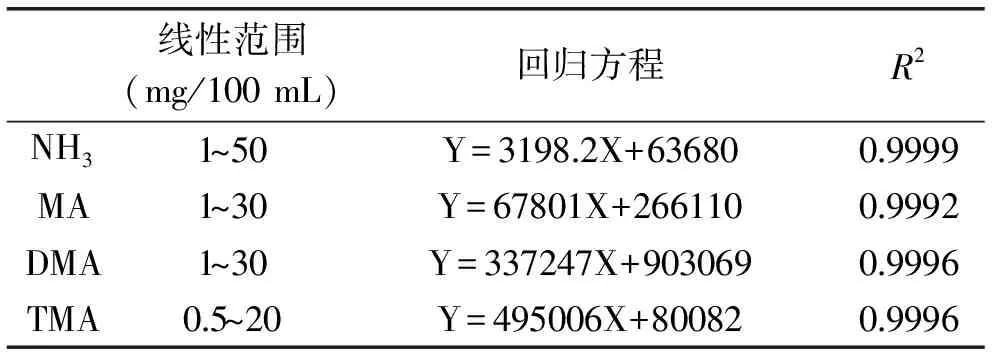
表2 NH3、MA、DMA和TMA的线性范围、回归方程、相关系数Table 2 Linear range,regression equation and correlation coefficient of NH3,MA,DMA and TMA
2.2.2 精密度的测定 由表3可知,该方法条件下四种物质的相对标准偏差(RSD)在2.21%~5.64%,精密度较好,稳定性较高,杨宇川等[23]指出由于竞争吸附效应使得低沸点物质精密度低于高沸点物质。
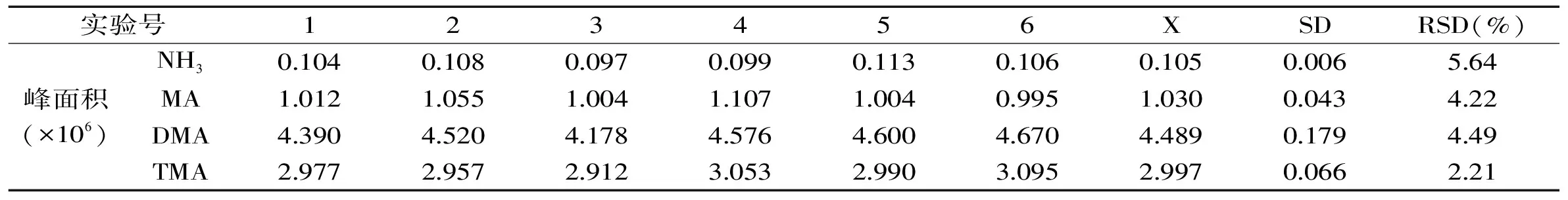
表3 NH3、MA、DMA和TMA的精密度Table 3 The RSD levels of NH3,MA,DMA and TMA
2.2.3 回收率的测定 由表4可知,大菱鲆NH3、MA、DMA和TMA的加标回收率分别为97.10~98.60%、88.72%~93.50%、91.80%~96.00%、86.23%~91.13%;由表5可知,南美白对虾NH3、MA、DMA和TMA的加标回收率分别为81.00%~108.78%、78.27%~94.27%、88.67%~94.33%和99.7%~103%,回收率较高,符合一般检测的回收率要求。
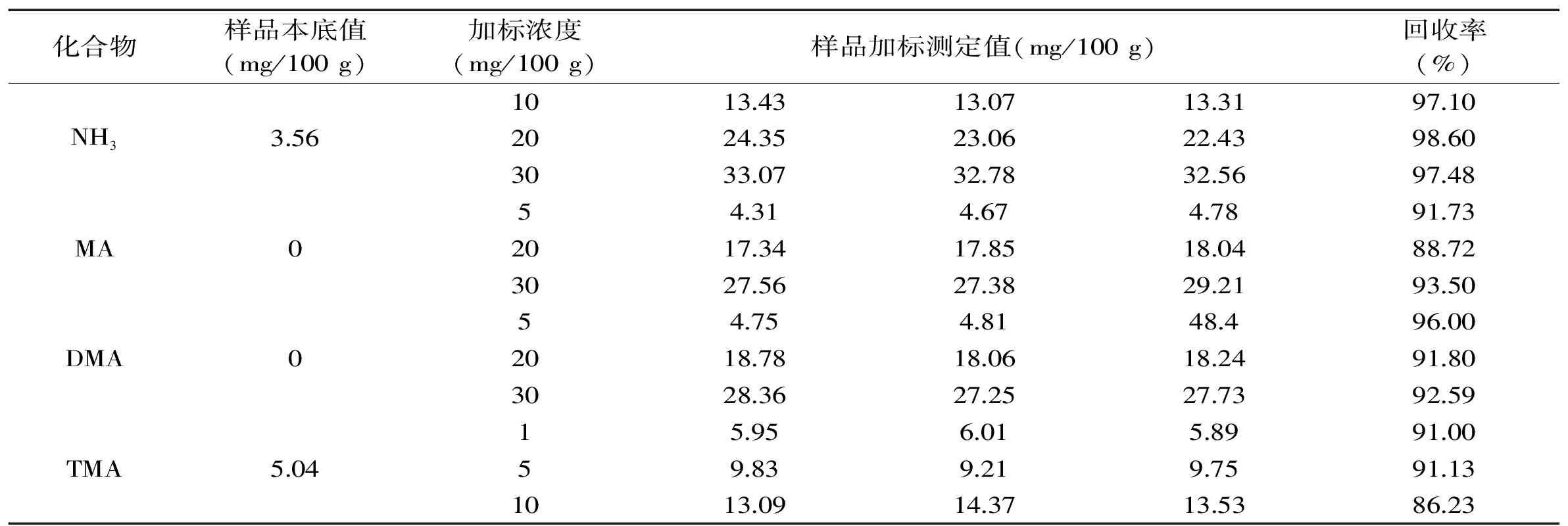
表4 大菱鲆NH3、MA、DMA和TMA的回收率Table 4 The recoveries of NH3,MA,DMA and TMA of Scophthalmus maximus
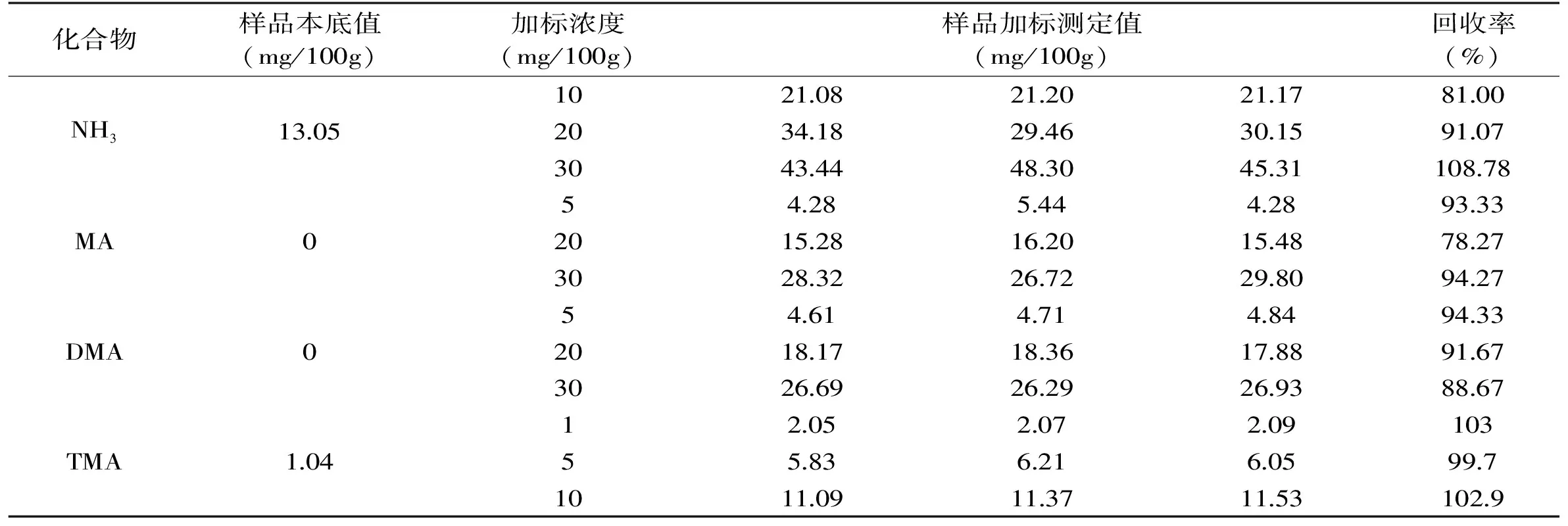
表5 南美白对虾NH3、MA、DMA和TMA的回收率Table 5 The recoveries of NH3,MA,DMA and TMA of Penaeus vannamei
2.2.4 检测限的测定 在本实验条件下,NH3、MA、DMA和TMA的方法检出限分别为0.5、1、1、0.1 mg/100 mg;仪器检出限分别为0.021、0.029、0.025和0.003 mg/100 mg,符合一般检测要求,可进行样品测定。
整体来看,本研究所建立的HS/SPME-GC/MS检测技术,具有较高的灵敏度、准确度和精密度,充分满足实际检测要求;利用5%三氯乙酸进行样本提取,有效避免了甲苯等有机溶剂的使用,充分体现出绿色安全的特点。与传统的TVB-N检测技术相比,该方法首次实现了水产品中四种TVB-N主要组分的同时定量检测;样本提取过程集采集、萃取、浓缩、富集于一体,简便快速,从而为水产品中TVB-N组分的精准表征和分析提供了一种更加有效的技术手段。
2.3 冷藏过程中不同水产品TVB-N主要组分的变化规律
2.3.1 大菱鲆4 ℃冷藏期间NH3和TMA的变化 利用HS/SPME-GC/MS方法测定的大菱鲆冷藏过程中TVB-N主要组分的变化情况,实验结果如图4所示,大菱鲆在腐败过程中未检测到MA与DMA的存在;NH3含量在第1 d为2.26 mg/100 g,第13 d为5.94 mg/100 g。TMA在冷藏第1 d时未检测出,第4 d为1.44 mg/100 g,随后显著增加(p<0.05),第7 d时已达到20.03 mg/100 g,此时大菱鲆已到达腐败期,之后TMA含量无显著性差异(p>0.05),冷藏至第13 d TMA为23.94 mg/100 g。一般而言,深海鱼类TMAO含量较高,鲽鱼体内大约含有300 mg/100 g TMAO[24],在冷冻条件下,TMAO由内源酶还原成DMA,在冷藏条件下,TMAO由微生物作用分解成TMA[25],在本实验中大菱鲆在冷藏条件下贮藏,DMA的产生量可能低于其检出限,结果显示未检测出。大菱鲆冷藏后期,TMA急剧增加可能由于腐败加剧TMAO被微生物大量还原。另外,有报道称冷水鱼类产生的TMA远大于NH3,且贮藏期间TVB-N的增加主要是因为TMA的增加[26-27],与本文结果相一致。据Connell等报道,TMA指示鱼类新鲜度的最高接受范围为10~15 mg/100 g[28]。

图4 大菱鲆4 ℃冷藏期间TVB-N主要组分的变化Fig.4 Changes of TVB-N main components in Scophthalmus maximus during 4 ℃ storage
2.3.2 南美白对虾4 ℃冷藏期间NH3和TMA的变化 利用HS/SPME-GC/MS方法测定的南美白对虾冷藏过程中TVB-N主要组分的变化情况,实验结果如图5所示,虾肉在腐败过程中没有检测到MA与DMA的存在;NH3的含量较高,TMA含量较低。冷藏第1 d未检测到TMA,随着冷藏时间的延长,TMA含量呈增加趋势,第4 d达到3.21 mg/100 g,冷藏至第6 d为4.46 mg/100 g。虾肉冷藏第1 d NH3含量达到15.03 mg/100 g,随着冷藏时间的延长NH3含量不断增加,第4 d显著增长(p<0.05)达到22.64 mg/100 g,此时南美白对虾出现腐败特征,第6 d为39.59 mg/100 g。同样,冷藏条件的南美白对虾未检测出DMA。南美白对虾属于温水带水产动物,体内的TMAO含量低,其优势腐败菌主要产生NH3而不是TMA[29],随着鲜度降低,蛋白质逐渐被分解成氨基酸,氨基酸发生脱酰胺作用生成NH3。
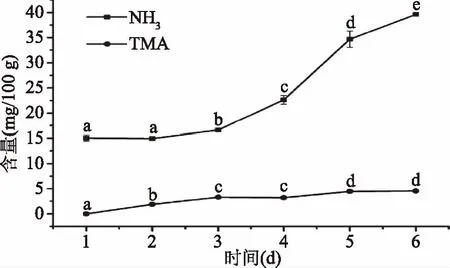
图5 南美白对虾4 ℃冷藏期间TVB-N主要组分的变化Fig.5 Changes of TVB-N main components in Penaeus vannamei during 4 ℃ storage
上述实验结果进一步证实:不同水产品在腐败过程中,TVB-N组分的动态变化存在显著的差异,单纯以TVB-N总量或者其中某一种特定组分作为通用指标,难以准确反映不同品种的品质变化规律;而依据其各自TVB-N组分的变化规律,分别从中选择最具代表性的指示物,则具有更好的合理性和准确性。尤其在实验中发现,南美白对虾在冷藏过程中NH3的动态变化规律,与大菱鲆等鱼类截然不同,不仅含量达到大菱鲆的6倍左右,而且在贮藏时间的中后期呈现出快速增长的趋势,而这一点在以往的研究中,并未见有相关报道。这一现象背后的具体机理是怎样的,与水产品中蛋白质及氨基酸的代谢存在怎样的关联,以及能否利用NH3的这一特殊变化特征、为研究南美白对虾等甲壳类水产品的品质变化及控制技术开拓新的思路,值得在今后的研究中予以重点关注。
3 结论
本文利用HS/SPME-GC/MS技术,首次建立了同时检测水产品中NH3、MA、DMA和TMA等TVB-N组分的方法,该方法简便快捷,对四种目标物质的检测线性范围良好,准确度和精密度较高,可实现鱼虾等水产品贮藏过程中TVB-N各组分的同时分析。利用该技术研究分析了大菱鲆和南美白对虾两种水产品在冷藏过程中TVB-N主要组分的动态变化,发现其TVB-N组分的变化规律存在显著差异,尤其是南美白对虾中NH3变化规律,呈现出与鱼类截然不同的特征,从而为今后更加准确、合理地研究评价该类水产品的腐败机理及调控手段,提供了新的线索。这些变化规律的差异可能与其自身的贮藏条件、生长环境以及微生物构成有关,需要在今后的研究中进一步明确。
