尿路感染金黄色葡萄球菌的耐药性及相关基因分布分析
2018-10-23李晓芹赵晓红李明安
李晓芹,魏 迁,赵晓红,李明安△
(1.江苏省宿迁市沭阳县中心医院检验科 223600;2.徐州医科大学附属沭阳医院生殖医学科,江苏宿迁 223600;3.徐州医科大学附属沭阳医院检验科,江苏宿迁 223600)
人体定植是金黄色葡萄球菌(SA)引发感染的主要原因,20%的人鼻腔长期定植此菌,多种酶类及毒素是SA致病和引起耐药性的重要原因。SA引起的泌尿系统感染可引起菌血症,严重者可导致中毒性休克[1],有些感染甚至导致慢性肾炎,最终发展成尿毒症[2]。近年来,随着抗菌药物的滥用,出现了多重耐药菌株,多重耐药菌的高发生率且难治愈性,已经成为临床面临的治疗难题,特别是耐甲氧西林金黄色葡萄球菌(MRSA)作为生殖泌尿系统感染的常见病原菌[3],近年来的耐药率不断上升,常表现为多重耐药性,需要临床密切关注。本研究对176株尿液分离的SA进行耐药基因和耐消毒剂基因的检测分析,以期为临床合理应用抗菌药物和消毒剂提供依据。
1 资料与方法
1.1菌株来源 176株SA分离自2014年7月至2016年7月江苏省宿迁市沭阳县中心医院和徐州医科大学附属沐阳医院门诊及住院患者的尿液标本,所有标本均为晨起第1次中段尿液,放置尿液培养专用培养杯中送检,标本接种于血琼脂平板35~37 ℃培养18~24 h。所有分离菌株均先通过革兰染色初步镜检后再用梅里埃VITEK2 Compact型细菌自动鉴定仪鉴定,所有菌株均为首次培养阳性菌株。
1.2仪器与试剂 细菌鉴定仪及其配套试剂购于法国梅里埃公司,细菌鉴定仪型号为VITEK2 Compact型;M-H琼脂购自美国BD公司;聚合酶链反应(PCR)分析仪为美国ABI公司的9700型;电泳仪为上海天能公司300型;PCR试剂盒购于大连宝生物公司。药敏纸片购自北京天坛药物技术开发公司,包括青霉素G、苯唑西林、头孢西丁、四环素、庆大霉素、利福平、环丙沙星、红霉素、克林霉素、利奈唑胺、呋喃妥因、替考拉林、万古霉素共计13种。
1.3MRSA的筛选 按美国临床和实验室标准化协会(CLSI)2016年标准筛选MRSA[4]。采用头孢西丁纸片法,抑菌直径<22 mm为MRSA;抑菌直径≥22 mm为MSSA。质控菌株为ATCC25923。
1.4菌株鉴定及药敏试验 采用VITEK2 Compact型细菌检定仪进行细菌鉴定及药敏试验,再用K-B法进行药敏结果的确认,细菌鉴定先行革兰染色后根据菌落形态初步分类,再按照仪器说明书进行操作鉴定。K-B法步骤为将菌液调制成0.5麦氏浊度,取出平板放置,35~37 ℃培养箱中放置30 min,待培养基上的水分被吸收后取出,用无菌棉拭子将调制好的菌液涂布于M-H培养基表面3次,每涂布1次旋转60°,最后沿平板内侧边缘擦绕一圈,室温放置,待培养基表面干燥后贴药敏纸片,药敏纸片距平板边缘≥15 mm,药敏纸片间距≥24 mm,倒置于35~37 ℃温箱孵育18~24 h后,测量并记录抑菌圈直径,每株细菌做3次取平均值,作为最终抑菌圈直径,按CLSI 2016年标准,判断药敏结果。
1.5耐药基因检测
1.5.1细菌总DNA的提取 挑取单个菌落放入含250 μL的双蒸水中充分混匀,加入蛋白酶K和葡萄球菌素混匀后置35 ℃水浴40 min,100 ℃煮沸15 min,以8.7 cm的离心半径,1 000 r/min,离心10 min,取上清液于-20 ℃冰箱保存。
1.5.2耐药基因及耐消毒剂基因检测 耐药基因与耐消毒剂基因检测均为PCR,耐药基因引物设计参照文献[5-6],耐消毒剂基因引物设计参照文献[7-8],引物均由生工生物工程(上海)有限公司合成。PCR操作按说明书进行,产物经琼脂糖凝胶电泳后,用凝胶成像系统分析。各引物序列见表1。
2 结 果
2.1MRSA阳性率 采用头孢西丁纸片法,根据抑菌圈直径的大小筛选出92株为MRSA,占52.27%,甲氧西林敏感金黄色葡萄萄球菌(MSSA)84株,占47.73%。
2.2药敏试验结果 SA对青霉素G均耐药,MRSA呈多重耐药性,对苯唑西林、四环素、庆大霉素、利福平、环丙沙星、红霉素、克林霉素的耐药率依次为100.00%、96.74%、94.57%、93.48%、86.96%、86.96%、77.17%,对利奈唑胺、呋喃妥因、替考拉林、万古霉素耐药率为0;MSSA对四环素、庆大霉素、环丙沙星、红霉素、克林霉素的耐药率依次为17.86%、19.05%、19.05%、61.90%、34.52%。见表2。
2.3耐药基因及耐消毒剂基因携带情况 本次分离176株SA,其中携带MecA基因为92株,占比为52.27%,这与头孢西丁筛选出的92株一致,且一一对应;MRSA的耐药基因aph′-Ⅲ、aac(6′)/aph(2″)、ant(4′4″)、ermA、ermB、ermC携带率分别为41.30%、70.65%、5.43%、68.48%、0、66.30%;MSSA的耐药基因aph′-Ⅲ、aac(6′)/aph(2″)、ermB、ermC携带率分别为13.10%、25.00%、28.57%、14.29%,其余均为0。耐消毒剂基因携带情况:MRSA的qacA/B、smr(qacC+qacD)、qacEΔ1携带率分别为56.52%、5.43%、7.61%;MSSA的qacA/B、smr(qacC+qacD、qacEΔ1携带率分别为45.24%、0、4.76%。见表3。

表1 PCR引物序列与目的产物长度

表2 176株SA对抗菌药物的耐药率分析[n(%)]
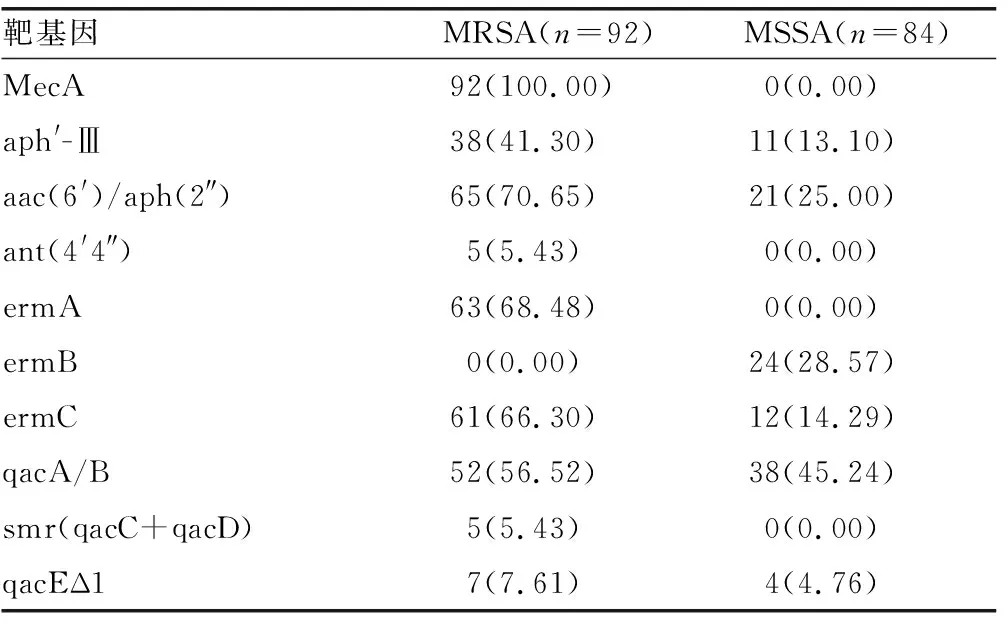
表3 176株SA耐药基因及耐消毒剂基因携带率情况[n(%)]
3 讨 论
SA是临床最常见的革兰阳性球菌之一[9],可引发各种不同类型的感染。近年来SA已成为医院和社区获得性感染的重要病原菌之一,尤其是MRSA,作为临床常见致病菌[10],其常携带各种耐药基因及耐消毒剂基因,致病性较强,常表现为多重耐药性。SA也是尿路感染的主要病原菌之一,尤其对有基础疾病的患者,抵抗力较差,又要接受各种侵入性操作,增加了感染机会。
青霉素问世后,对SA有比较好的控制作用,但随着时间的发展,有的菌株产生了能水解β-内酰胺环的酶,从而对青霉素产生了耐药。本研究显示SA对青霉素G的耐药率达到了100.00%,表明目前SA引起的感染已不适合用青霉素进行治疗。MecA基因能够编码青霉素结合球蛋白2a(PBP2a),而青霉素结合球蛋白PBP2a不能被β-内酰胺类药物抑制,而代替正常的青霉素结合蛋白,从而产生耐药[11]。本研究分离的176株SA,其中携带MecA基因的为92株,占比为52.27%,这与用头孢西丁筛选出的92株一致,且一一对应。SA的aph′-Ⅲ和aac(6′)/aph(2″)基因检出率较高,MRSA与MSSA携带率分别为41.30%、70.65%和13.10%、25.00%,表明尿路感染MRSA对氨基糖苷的耐药率较高;而药敏试验显示MRSA与MSSA对庆大霉素、环丙沙星的耐药率较高,也说明对于泌尿系统分离的SA,特别是MRSA已不适合应用氨基糖苷类抗菌药物。erm基因是引起SA对大环类酯类抗菌药物耐药的重要原因,主要是因为位于SA质粒或染色体上的erm基因能够编码产生红霉素核糖体甲基化酶,从而使23S rRNA发生甲基化,降低大环类酯类抗菌药物与核糖体的结合率,从而使细菌耐药。erm基因主要包括ermA、ermB和ermC[12],本研究显示,MRSA的ermA和ermC的携带率分别为68.68%和66.30%,MSSA的ermB和ermC的携带率分别为28.57%和14.29%,所以SA,特别是MRSA的erm基因携带率较高,与MRSA和MSSA对红霉素的耐药率(86.96%、61.90%)也较一致。
随着临床大量、不规范应用抗菌药物,SA的耐药情况已非常严峻[13],临床为了预防和控制感染,大量、广泛地使用了各种类型的消毒剂,这就导致了大量耐消毒剂菌株的出现[14]。qac基因家族的耐消毒剂机制与外排泵系统密切相关[15]。qac基因家族可分为qacA、qacB、qacC、qacD、qacE、qacEΔ1、qacF、qacG、qacH、qacJ。其中,qacA的底物主要有一价和二价有机阳离子,如新洁尔灭(一价)、溴化乙啶(一价)、洗必泰(二价)等;qacB底物主要为一价和少量二价有机阳离子,如新洁尔灭、溴化乙啶等。qacA和qacB基因相似度极高,普通PCR无法分辨;qacC外排季铵盐类等消毒剂[16];另外,qacG、qacH、qacJ对消毒剂的耐药机制还不是很明确。全世界范围MRSA的qacA/B基因检出率有较大的区别,亚洲地区和巴西检出率较高,日本较低。本研究显示,MRSA qacA/B的检出率为56.52%,MSSA qacA/B的检出率为45.24%,携带率均较高,这可能与基层医院消毒剂不规范使用有关。qacEΔ1为Ⅰ类整合子的标记基因,其主要介导革兰阴性菌对磺胺类药物和消毒剂的耐药。其能通过位点特异性重组从而获取外源性基因盒,从而有利于某些耐药基因的播散。本研究显示MRSA和MSSA qacEΔ1分别检出7株(7.61%)、4株(4.76%),这些应该引起感染控制部门的重视,注意监测和防止此类耐消毒剂基因的变迁及播散。
尿液分离出的SA对常见抗菌药具有一定的耐药性;其耐药基因MecA、aac(6′)/aph(2″)、ermA、ermC及耐消毒剂基因qacA/B检出率较高,可能是泌尿系统SA,特别是MRSA耐药及耐消毒剂的重要原因,临床应该根据药敏结果合理应用抗菌药物,规范各类消毒剂的应用,预防耐消毒剂基因的变迁。
