思茅松SSR-PCR反应体系优化研究*
2018-10-23王大玮保云莹唐红燕段安安蔡年辉许玉兰李思广
王大玮 保云莹 唐红燕 段安安 蔡年辉 许玉兰 周 军 李思广
(1. 西南林业大学云南省高校林木遗传改良与繁育重点实验室,云南 昆明 650224;2. 云南林业职业技术学院,云南 昆明 650224;3. 普洱市林业科学研究所,云南 普洱 665099;4. 云南省林业科学院,云南 昆明 650201)
思茅松 (Pinuskesiyavar.langbianensis) 是我国云南省特有树种,是优良的家具用材及纸浆原料,同时还是我国重要的松脂资源[1]。目前思茅松已成为滇南地区人工造林的主要树种,在林业产业结构中占有重要地位[2]。
SSR (single sequence repeats) 分子标记技术凭借其共显性、多态性高、操作简便等优点,已经广泛应用于林木遗传连锁图谱构建、遗传多样性分析等研究中[3-4]。思茅松的遗传基础研究比较薄弱,随着分子生物学的飞速发展,思茅松的RAPD、ISSR、AFLP等分子标记反应体系已经逐步建立[5-8],但至今尚未见有关SSR标记反应体系的报道。本研究的目的在于利用正交设计对思茅松的SSR-PCR反应体系的各参数进行优化,在此基础上建立一套适合思茅松的SSR-PCR反应体系,为思茅松遗传连锁图谱的构建及遗传多样性研究提供技术参考。
1 材料与方法
1.1 材料来源
研究材料为构建思茅松遗传连锁图谱作图群体的11个杂交亲本 (优良单株或无性系),分别为:JG1、JG7、PW2、PW3、PW12、ZY1、JD5、NR7、SM11、LC3、LC9号。采集其幼嫩松针,-20 ℃保存。
1.2 实验方法
1.2.1DNA的提取和检测
采用改良的CTAB法对思茅松基因组DNA进行提取[8]。提取完成后,利用0.8%琼脂糖凝胶电泳检测,再用核酸蛋白检测仪对其浓度及纯度进行测定。
1.2.2SSR-PCR反应体系的优化
思茅松SSR-PCR反应正交实验设计见表1。

表1 思茅松SSR-PCR反应正交实验设计L16(45)Table 1 SSR-PCR orthogonal design L16(45) of P.kesiya var. langbianensis
为了确定思茅松SSR-PCR反应最佳体系,以JG1号基因组DNA作为模板。正交实验所用引物组合由Thao等[9]开发,上游序列为:ACACACAA-AACCTTTTATAGGCAT;下游序列为:ATCGTTCTA-ATTGTCGCATATCGG。
针对模板Mg2+、DNA、引物、TaqDNA聚合酶、d NTPs 5种因素进行L16(45) 正交实验,共16个处理,每个处理重复2次。PCR反应程序为:94 ℃预变性,5 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1.5 min,35个循环;72 ℃再延伸7 min。扩增产物1.0%琼脂糖凝胶电泳检测。
1.2.3最佳反应体系的验证
利用11个杂交亲本的DNA作为模板进行SSR扩增,对优化的SSR-PCR反应体系稳定性进行验证,扩增产物1.0%琼脂糖凝胶电泳检测。
2 结果与分析
2.1 DNA检测
8%琼脂糖凝胶电泳检测结果 (图1) 表明,各泳道主带清晰,点样孔无滞留物亮点出现。核酸蛋白检测仪测定结果表明,所有个体DNA的OD260/OD280值为1.8~2.0,浓度为100~200 ng/μL。因此,采用改进的CTAB提取的思茅松基因组DNA质量和纯度均较高,蛋白质、酚类等杂质去除彻底。

图1基因组DNA提取结果
Fig.1 Result of DNA extraction
2.2 正交实验各因子对结果的影响
16个处理由于5个因素浓度组合不同,扩增结果有着比较明显的差异 (图2)。除第1、2、5、6 组合由于各因素浓度太低扩增条带较弱外,其余12个处理均能扩增出条带。其中第12组合扩增效果最好,其扩增条带清晰,主带明显,在3次重复中表现稳定,可以确定为最佳组合。
思茅松最佳SSR-PCR反应体系为:在25 μL体系中,Mg2+浓度为2.0 mmol/L,模板DNA浓度为60 ng,引物浓度为0.50 μmol/L,TaqDNA聚合酶用量为0.25 U,dNTP浓度为0.20 mmol/L。

M为marker,1~16为试验号。
图2SSR-PCR正交实验结果
Fig.2 Result of orthogonal design for SSR-PCR
2.3 SSR最佳反应体系验证
利用优化的思茅松SSR-PCR反应体系,以11个杂交亲本的DNA作为模板进行SSR扩增 (图3)。结果表明,扩增条带清晰,有丰富的多态性,且稳定性高。说明优化的思茅松SSR-PCR反应体系可应用于后续的遗传连锁图谱构建及遗传多样性等研究。
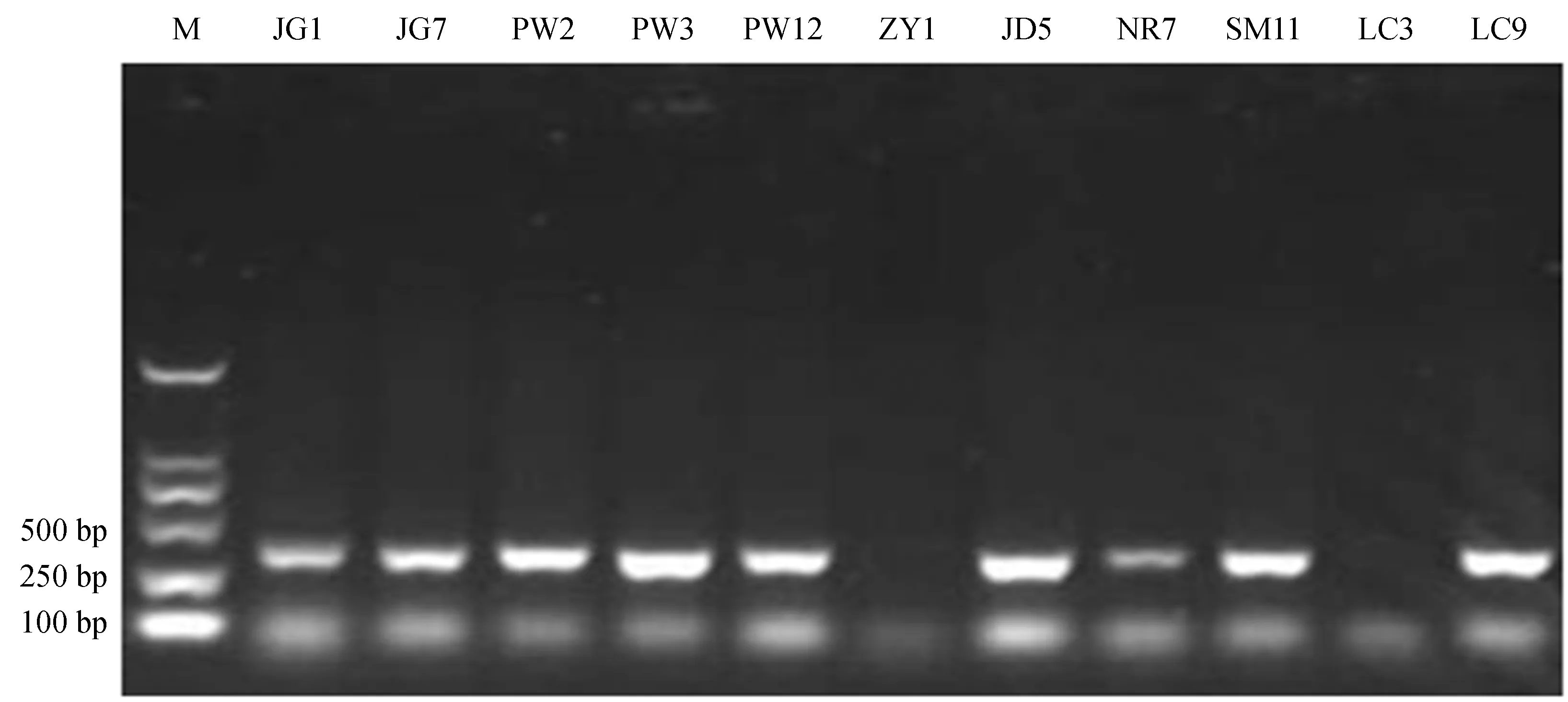
图311个杂交亲本的SSR-PCR扩增结果
Fig.3 SSR-PCR products of 11 hybrid parents
3 结论与讨论
稳定的SSR-PCR反应体系的建立及优化是SSR标记后续应用的基础[10]。建立一个各因素浓度最合适的PCR 反应体系是SSR 标记在林木遗传育种研究应用中的基本条件之一[11]。所以为了后续思茅松遗传连锁图谱构建及遗传多样性研究工作的顺利开展,一套优化的思茅松SSR-PCR反应体系必须建立。
本研究结果与2个云南松SSR-PCR反应体系[12-13]相比,模板DNA用量和引物浓度均高于云南松反应体系,其中DNA用量分别为60 ng和30 ng,用量相差了1倍;引物浓度分别为0.50和0.20 μmol/L,相差了2.5倍;但TaqDNA聚合酶用量又低于云南松体系,分别为0.25 U和1 U,相差了4倍,并且在2个云南松SSR-PCR反应体系中dNTP和Mg2+2个影响因子的用量也不同。说明SSR-PCR反应体系得到的扩增条带是多因子综合作用的结果[14],在不同树种中,各因子对PCR 结果的影响作用不同[15],其最佳反应体系也不同,即使同一植物,不同科研人员得出的结果也不会完全相同[16-17]。
目前,SSR-PCR体系建立的主要有单因子、完全及正交3种试验方法[18],相比较而言,多因素正交实验是优化SSR-PCR反应体系的一种有效方法[19-20]。本研究通过L16(45) 正交实验对思茅松SSR-PCR反应体系中的各因素进行优化,得到了一套能够稳定扩增且能重复利用的反应体系,为今后的遗传多样性分析及遗传连锁图谱的构建等研究提供了有力的支持。
