15个北方杨树栽培品种倍性检测与SSR遗传分析*
2018-10-23张金旺李代丽尚峰男阿茹娜
张金旺 李代丽 尚峰男 阿茹娜 铁 龙 王 君 姜 鹏
(1. 内蒙古通辽市林业科学研究院,内蒙古 通辽 028000;2. 北京市黄垡苗圃,北京 102601;3. 北京林业大学林木育种国家工程实验室,林木花卉遗传育种教育部重点实验室,生物科学与技术学院,北京 100083)
杨树 (Populusspp.) 是中国北方地区重要的造林树种,尤其在 “三北防护林体系” 建设中发挥重要价值[1]。近年来,随着林木育种技术的不断进步以及国家对林木种业的高度重视,杨树速生优良新品种的选育速度逐渐加快。然而,由于杨树驯化历史相对悠久,新品种遗传基础狭窄,且生物学性状受生长发育阶段和环境影响较大,单纯以形态学差异作为品种区分标准越发困难,而且不利于新品种权的保护[2]。为保证品种的特异性,利用分子标记技术开展遗传分析并构建指纹图谱信息已逐渐成为品种鉴定的重要手段及良种审定的基本信息。
在众多分子标记技术中,简单重复序列 (SSR) 分子标记以其多态性高、重复性好、共显性、多等位位点变异、成本低廉等优点,在林木遗传育种研究中日渐受到青睐[3]。Yin等[4]在毛果杨 (P.trichocarpa) 测序[5]完成后公布了大量的杨树SSR引物信息,以及一批杨树EST-SSR信息的发表[6-7]极大地推动了杨树SSR分子标记技术在杨树品种鉴定、亲本分析、遗传图谱构建等的应用[2,8-15]。其中,贾会霞等[2]利用SSR分子标记技术构建包括 ‘中林46’ (P.×euramericanacl. ‘Zhonglin 46’)、‘中怀1号’ (P.deltoidescl. ‘Zhonghuai 1’) 等24个杨树新品种指纹图谱的同时,甚至发现其中存在5个三倍体品种。然而,对在中国东北地区广泛栽培的 ‘白城’ 系列、‘黑林’ 系列等杨树品种的分子鉴定研究较少。本研究对中国北方地区的15个杨树栽培品种进行了收集,在利用流式细胞仪和染色体技术法进行倍性分析的基础上,进一步利用SSR分子标记技术进行了遗传基础分析,丰富了杨树栽培种的指纹图谱库,为继续开展北方地区杨树遗传改良提供参考。
1 材料与方法
1.1 材料来源
供试的15份杨树品种 (表1) 收集后保存于内蒙古通辽市林科院舍伯吐苗圃,春季从扦插苗上摘取新鲜幼嫩叶片,液氮冷冻后保存于-80 ℃冰箱中待用。同时,采集少量幼嫩叶片利用流式细胞仪 (BD FACSCalibur) 分析其倍性水平;茎尖材料用于染色体制片。

表1 试验材料Table 1 Experimental materials
1.2 研究方法
1.2.1倍性检测
对所有15个品种首先通过流式细胞仪进行倍性分析。参考Galbraith等[16]的方法,取50 mg待测植株的幼嫩叶片,置于冰上,加入1 mL预冷的细胞核分离缓冲液 (45 mmol/L MgCl2·6H2O, 20 mmol/L MOPS, 30 mmol/L Sodium citrate, 1% PVP-10, 0.5% Triton X-100, pH 7.0),用刀片迅速剁60 s成碎片。包含细胞核的分离缓冲液经40 μm孔径纱网过滤后,向滤液中加入含有50 μg/mL RNA酶的50 μg/mL PI (propidium iodide) 溶液,混合均匀,置冰浴中孵育染色30 min。使用BD公司生产的FACSCalibur流式细胞仪进行细胞核DNA含量分析。
对经流式细胞仪筛选出的多倍体品种,利用压片法进行了体细胞染色体计数。参考王君等[17]的方法,取生长旺盛的茎尖材料,经饱和对二氯苯预处理3~4 h后,用卡诺固定液在4 ℃下固定2~24 h,然后用解离液 (V(38%HCl)∶V(乙醇)=1∶1) 解离20~25 min,改良卡宝品红染色压片,Olympus BX51显微镜下观察15~20个分裂相,并采用Olympus DP70数码摄像系统拍照。
1.2.2叶片DNA的提取
各样品叶片DNA采用植物基因组DNA提取试剂盒 (天根生化科技 (北京) 有限公司),根据说明书进行提取。抽提的DNA经1%琼脂糖凝胶电泳检测含量后保存于-20 ℃待用。
1.2.3SSR引物的筛选
从Yin等[4]和Du等[7]所报道的杨树SSR引物中选取150对进行序列合成,对遗传背景差异较大的4份品种样品通过聚丙烯酰胺凝胶电泳法进行引物筛选,选出12对扩增条带清晰、具有多态性且重复性好的引物 (表2) 进行毛细管电泳检测。

表2 筛选出的12对SSR引物信息表Table 2 Information of screened 12 pairs of SSR primers
1.2.4毛细管电泳检测与数据分析
采用TP-M13-SSR法进行PCR扩增,PCR产物的毛细管电泳检测由北京睿博兴科生物科技有限公司完成。SSR-PCR体系为20 μL,包括10~15 ng基因组DNA,10 μL 2 × Master Mix (北京擎科新业生物技术有限公司),0.4 pmol正向引物,1.6 pmol反向引物和1.6 pmol通用荧光引物。PCR反应程序为:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火45 s,72 ℃延伸45 s,30个循环;94 ℃变性30 s,53 ℃退火45 s,72 ℃延伸45 s,8个循环;72 ℃继续延伸10 min。
1.2.5数据分析
参照麻丽颖等[18]的方法,利用Gene-Marker软件 (Soft Genetics LLC, USA) 对毛细管电泳检测结果进行数据分析。Gene-Marker软件获得的原始数据经Flexibin程序[19]修正后转化成0,1格式,建立原始矩阵后用NTSYS-pc 2.10e软件[20]进行后续分析。其中,多态性等位变异百分率=(k/n)×100%,式中k是多态等位变异数,n为所测等位变异总数;特异性等位变异百分率=(s/n)×100%,式中s为特异等位变异数,n为所测等位变异总数。利用NTSYS-pc 2.10e软件计算任意2个品种间的相似系数 (GS):GS=2Nij/(Ni+Nj),式中Nij为材料i和j共有的扩增片段总数,Ni为材料i中出现的扩增片段数,Nj为材料j中出现的扩增片段数。对各供试材料采用非加权组平均法 (UPGMA) 进行聚类分析。
2 结果与分析
2.1 三倍体种质的发现
经流式细胞分析及染色体计数发现,在供试的15个品种中,存在2份三倍体 (2n=3x=57,图1) 种质,分别为 ‘黑林1号杨’ 和 ‘白林3号杨’,其余均为二倍体 (2n=2x=38),表明在北方地区栽培的杨树品种中存在一些三倍体种质,这些品种在选育过程中正是由于其生长优势而被选中。

a和b分别为二倍体 ‘哲引3号杨’ 的流式细胞分析及染色体压片;c和d分别为三倍体 ‘黑林1号杨’ 的流式细胞分析及染色体压片。
图1‘哲引3号杨’和‘黑林1号杨’的倍性分析
Fig.1 Determination of ploidy levels ofP. × ‘Zheyin3’ andP. × ‘Heilin 1’
2.2 SSR引物多态性分析
利用筛选的12对SSR引物在供试的15个品种中共扩增出106个等位变异,其中多态性等位变异105个,多态性等位变异百分率为99.06%。各对引物扩增的多态性等位变异数量为2~13个,平均每对引物能扩增出8.75个多态性等位变异,引物LG1216扩增的多态性等位变异数最少 (2个),而引物LG1714扩增的多态性等位变异数最多,达13个。12对引物共扩增出特异性等位变异46个,特异性等位变异率为43.40%。各引物扩增的特异性等位变异数量变化为0~8个,平均每对引物能扩增出3.83个特异性等位变异,引物LG1216和LG1930没有扩增出特异性等位变异,而引物LG1224扩增出了8个特异性等位变异 (表3)。
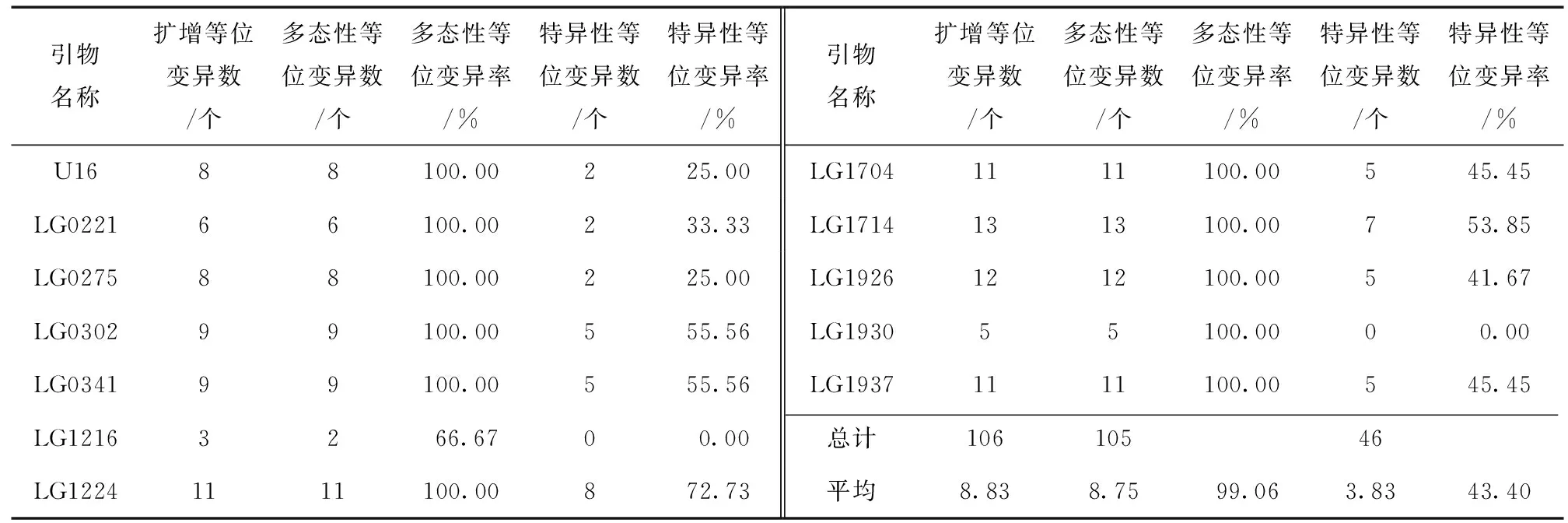
表3 SSR引物的多态性检测Table 3 Polymorphism detection of SSR primers
图2是引物LG1926在对部分品种中的扩增图谱。
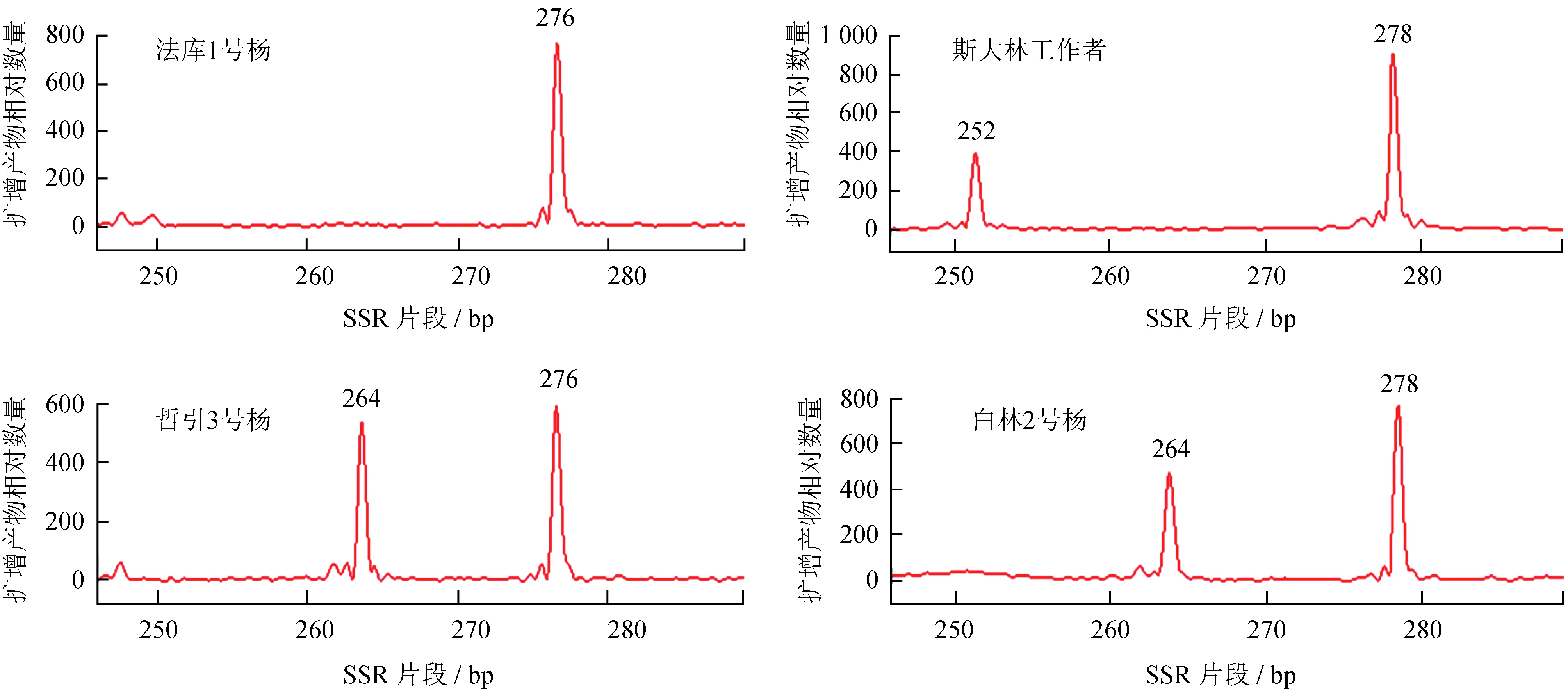
图2引物LG1926在4个品种中的毛细管电泳检测
Fig.2 Analysis of capillary electrophoresis detection of 4 samples with LG1926 primer
2.3 指纹图谱构建
引物LG1926可区分除 ‘黑林3号杨’ 和 ‘法库1号杨’ 之外的13个品种,而利用引物LG1937可区分除 ‘箭黑杨杨’ 和 ‘法库1号杨’ 之外的13个品种,将两者进行组合,可对本研究的所有15个品种进行有效区分。因此,选择LG1926和LG1937这2对引物,对毛细管电泳的等位位点进行统计,以每个标记在样本上扩增的等位位点分子量大小作为带型编号,按照固定引物排列顺序综合不同引物扩增结果,串联各带型编号,构建了本研究15个品种的SSR指纹图谱,具体结果见表4。

表4 15个杨树栽培品种的SSR指纹图谱Table 4 SSR fingerprint of 15 Populus cultivars
2.4 聚类分析
以各品种经12对引物扩增的等位变异为基础,建立0,1矩阵,利用NTSYS-pc 2.10e软件分析遗传多样性,并使用UPGMA法绘制聚类分析图 (图3)。各品种间的相似系数范围为0.622 6~0.886 8,平均相似系数0.733 7。其中,‘西丰25号杨’ 与 ‘西丰77号杨’ 相似系数最大,为0.886 8,这2个品种都是从美洲黑杨与青杨杂交子代中选育产生的;‘白城2号杨’ 和 ‘法库1号杨’ 都是小叶杨与钻天杨的天然杂种,其亲源关系也较近,相似系数为0.858 5,它们共同与 ‘汇林88号杨’ 聚成了一个小类群,表明作为小叶杨对其遗传差异造成了较大的影响; ‘汇林88号杨’ 与 ‘西丰25号杨’ 和 ‘西丰77号杨’ 的相似系数分别为0.622 6和0.641 5,说明 ‘汇林88号杨’ 与2个西丰系列的品种之间的亲缘关系均较远。

图3基于SSR等位变异的15个杨树品种聚类分析
Fig.3 Dendrogram of 15Populusgermplasms based on SSR markers
3 结论与讨论
近年来,三倍体杨树种质在中国林业生产中广泛推广的杨树品种中陆续被发现, ‘中林46’、‘银中杨’ (P.alba×P.berolinensis‘Yinzhong’)、‘中怀1号’、‘森海1号’(P.deltoides×P.cathayanacl. ‘Senhai 1’)、‘森海2号’ (P.deltoides×P.ca-thayanacl. ‘Senhai 2’) 等原本通过杂交选育的杨树杂种均被证明是三倍体品种[2,21-23]。本研究发现的 ‘白林3号杨’ 和 ‘黑林1号杨’ 2个三倍体品种进一步丰富了杨树三倍体种质资源库,也进一步证明了三倍体育种在杨树遗传改良中的优势。鉴于杨树天然未减数配子在自然界普遍发生[24-25],推测这些三倍体种质可能来源于天然未减数配子的杂交。未来可以通过对这些杂交品种的双亲进行分析,研究双亲未减数配子的发生情况,探讨三倍体杂种的产生原因。
利用SSR毛细管电泳检测可对植株倍性水平进行检测[10, 26]。贾会霞等[2]发现 ‘森海1号’、‘森海2号’、‘中怀1号’、‘中林46’ 以及1份青杨种质均检测到3个不同的SSR等位位点,流式细胞仪分析也证明了这些种质都是三倍体。然而,冯锦霞等[11]对 ‘森海1号’ 和 ‘森海2号’ 进行SSR分析,都只检测到2个等位位点。2个研究间似乎存在矛盾,实则可能与等位位点的杂合性有关[26]。本研究在检测 ‘白林3号’ 和 ‘黑林1号’ 三倍体品种时,LG1937引物扩增的SSR等位位点均为2个。因此,在利用SSR分子标记手段进行植株倍性分析时,应充分利用单拷贝SSR引物结合毛细管电泳检测结果中荧光信号的倍数性变化信息加以分析,尤其能借助双亲的SSR等位位点分布及荧光强度信息综合分析更为可靠[27]。
杨树驯化历史相对悠久,品种繁多,新品种遗传基础狭窄,单纯以形态学差异作为品种区分标准容易受到环境差异的影响,因此,开发分子标记指纹图谱是开展杨树品种注册、品种鉴定的主要趋势。本研究利用毛细胞电泳检测技术,针对中国北方地区的15个杨树品种建立了SSR指纹图谱。与传统的聚丙烯酰胺凝胶电泳法相比,毛细管电泳技术具有成本低、污染少、精确度高等优点,尤其适合于大量样本的高通量检测[18]。同时,本研究筛选的12对引物,扩增位点清晰,均具有较好的多态性,可进一步用于扩展杨树种质材料的遗传分析。
