苜蓿中华根瘤菌烯酯酰ACP还原酶FABI2的原核表达纯化以及多克隆抗体的制备
2018-10-23张亚璇王海洪樊振川
张亚璇,王海洪,樊振川
(1.天津科技大学大健康生物技术研究所,天津市大健康生物技术国际联合研究中心,天津科技大学食品工程与生物技术学院,天津 300457;2.华南农业大学生命科学学院,广州 510642)
脂肪酸合成代谢是生物细胞中的基础代谢之一,是细胞膜形成的第一步,对细菌生理有关键作用.根据合成酶系统的差异,脂肪酸生物合成系统的酶被分为Ⅰ型脂肪酸合成酶系(FASⅠ)和Ⅱ型脂肪酸合成酶系(FASⅡ)[1-2].烯酯酰ACP还原酶是Ⅱ型脂肪酸合成途径中的关键酶之一,它催化延伸反应的最后一步,将反-2-烯酰 ACP还原为饱和酯酰 ACP[3].最早被鉴定的烯酯酰 ACP还原酶基因是大肠杆菌(Escherichia coli)中的fabI,随着基因组测序的完成,基因组信息揭示了苜蓿中华根瘤菌(Sinorhizobium meliloti)基因组中有这一基因的同源基因 fabI1和fabI2.这两个基因都位于环状的染色体上,fabI1由smc00005编码,fabI2由 smc00326编码[4-5],与脂肪酸合成基因fabBA相邻.它们与大肠杆菌FABI蛋白的相似度为51%,和50%,,且fabI2的序列与fabI1有66%,的一致性[6],但两个基因及相应酶存在差异.
苜蓿中华根瘤菌(Sinorhizobium meliloti)[7-8]是一类能与豆科苜蓿类植物共生形成根瘤的革兰氏阴性细菌.目前对其研究主要集中在共生固氮机制和抗逆性两个方面[9],并证明了脂肪酸合成系统对苜蓿中华根瘤菌的共生固氮和抗逆性均有显著影响,但对于基因 fabI2功能研究还未深入.本实验制备苜蓿中华根瘤菌烯酯酰 ACP还原酶基因 fabI2的抗体,是顺利完成FABI2在蛋白水平表达模式以及FABI2与其他蛋白互作机制研究的重要前提,有利于进一步对fabI2基因在脂肪酸合成中的功能进行深入研究.
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
大肠杆菌(Escherichia coli)XL1-blue、BL21(DE3)感受态细胞为本实验室保存.pET-28b-FABI2质粒为华南农业大学王海洪教授提供.
1.1.2 试剂
实验所用的酶及相对应的缓冲液、DNA相对分子质量marker和蛋白marker,美国Thermo公司;Ni SepharoseTM6,Fast Flow、Glutathione SepharoseTM4B蛋白纯化填料和 Protein A SepharoseTMCL-4B抗体纯化填料,美国 GE Healthcare 公司;弗式完全佐剂和不完全佐剂,美国Sigma公司;HRP标记的羊抗兔抗体,美国Cell Signaling公司;其他试剂均为国产分析纯.
1.1.3 试验动物
新西兰大白兔 2只,普通级,体质量 1.5~2.0,kg,由北京市海淀区兴隆实验动物养殖场提供,许可证号为SCXK(京)2016-0003.
1.2 方法
1.2.1 pGEX-2T-FABI2原核表达载体的构建
设计带有 BamHⅠ和 HindⅢ酶切位点的引物从pET-28b-FABI2质粒中扩增目的片段,引物设计为上游引物加入 BamHⅠ酶切位:5′-ATGGATCCATG AACGGATTGATGAAC-3′,下游引物加入 HindⅢ酶切位点:5′-ATAAGCTTTTAATCCGCGTCTGCGAC-3′.反应条件:95,℃ 2,min;95,℃ 30,s;56,℃ 30,s,30个循环;72,℃ 1,min;72,℃终延伸 15,min.利用琼脂糖凝胶回收试剂盒回收扩增产物后,再用 BamHⅠ和HindⅢ分别将回收的目的基因片段、pGEX-2T载体进行酶切;然后用 T4,DNA连接酶连接后,转入E.coli XL1-blue感受态细胞,经 PCR、双酶切验证后,筛选出符合要求的阳性克隆,并进行测序鉴定.
1.2.2 融合蛋白的诱导表达及鉴定
采用化学转化的方法将 pET-28b-FABI2和pGEX-2T-FABI2转入大肠杆菌 BL21(DE3),分别挑取单菌落至5,mL LB液体培养基(分别含100,µg/mL卡那霉素和 120,µg/mL氨苄青霉素),37,℃摇床过夜培养.再以1∶50的比例放大培养至A600为0.6~0.8时,加入0.1,mmol/L IPTG于20,℃、185,r/min条件下诱导 6,h使蛋白大量表达.4,℃、6,000,r/min离心5,min后收集菌体,用PBS溶液漂洗两次后用细胞破碎仪超声裂解 30,min.分别取诱导前、全蛋白、上清液和沉淀与 2×蛋白质上样缓冲液混合后进行 13%,SDS-PAGE电泳检测蛋白表达[10-11].
1.2.3 融合蛋白的纯化
6×His-FABI2融合蛋白诱导表达后,将收集的菌体于裂解液(20,mmol/L NaH2PO4、200,mmol/L NaCl、20,mmol/L 咪唑)中超声破碎,4,℃、12,000,r/min离心 15,min.取上清液用 0.45,µm 滤膜过滤后加入到预先用裂解液平衡好的Ni SepharoseTM6,Fast Flow纯化柱中,室温结合 1,h后,分别用含有50,mmol/L、100,mmol/L咪唑的裂解液进行漂洗,除去结合不牢的蛋白.最后用含有 500,mmol/L咪唑的裂解液进行洗脱,得到纯化后的目的蛋白.将上述收集的流出液组分、漂洗液组分以及洗脱液组分分别用13%, SDS-PAGE检测蛋白纯度[12].
pGEX-2T-FABI2融合蛋白诱导表达后进行超声破碎,4,℃、12,000,r/min离心 15,min.取上清液过膜后加入到预先平衡好的 Glutathione SepharoseTM4B纯化柱中,室温结合1,h后,用10倍柱体积的裂解液(1×PBS)进行漂洗,除去结合不牢的蛋白.最后用含有 20,mmol/L还原型谷胱甘肽的裂解液洗脱目的蛋白,得到纯化后的目的蛋白.将上述收集的流出液组分、漂洗液及洗脱液组分分别用13%, SDS-PAGE检测蛋白纯度.
1.2.4 免疫
将纯化后的 6×His-FABI2融合蛋白稀释到1,mg/L,取 2,mL蛋白与等体积的弗氏佐剂混合后乳化完全,免疫新西兰大白兔.采用颈背部多点注射法,初次免疫使用弗氏完全佐剂且免疫前进行耳缘静脉采血[13]作为阴性对照血清.之后每 10,d进行加强免疫,使用弗氏不完全佐剂,一共加强免疫 3次.最后 1次加强免疫后进行耳缘静脉采血,利用间接ELISA法测定抗血清的效价.效价合格后,股动脉采血,4,℃静置过夜后收集血清,分装冻存.
1.2.5 多克隆抗体效价的检测
采用 ELISA法检测抗血清的效价,以 GSTFABI2蛋白作为包被抗原,4,℃包被过夜,用 PBST洗3次以去掉结合不牢的蛋白.用5%,的脱脂乳粉封闭 1,h后,以所得的抗血清为一抗,一抗的稀释倍数分别为 1∶1,000、1∶2,000、1∶4,000、1∶8,000、1∶16,000、1∶320,000、1∶640,000、128,000,HRP 标记的羊抗兔抗体为二抗,稀释倍数为 1∶20,000,最后经过TMB显色,测定450,nm处的吸光度,并计算出抗血清的效价.以实验组血清 A450与阴性对照血清A450的比值大于2即为阳性,其最高稀释度即为抗血清的效价.
1.2.6 多克隆抗体的Protein A亲合纯化
由于 Protein A专一性吸附 IgG,可以去除 IgG之外的其他抗体分子,所以采用 Protein A对抗血清进行亲合纯化.取 1,mL抗血清加入 13,mL 结合液(20,mmol/L Na2HPO4,pH 7.0)平衡血清.将平衡后的血清经 0.45,µm 滤膜过滤后加入预先平衡好的纯化柱中,室温下与填料结合 30,min.结合完毕后放出流出液,用 0.1,mol/L 甘氨酸洗脱后得到纯化后的抗体,经 1,mol/L Tris-HCI(pH 9.0)调节洗脱液至中性后于-80,℃保存.
1.2.7 免疫印迹法检测多克隆抗体的特异性
对 4次免疫后经 Protein A 纯化后的抗体进行免疫印迹检测多克隆抗体的特异性.样品为诱导表达的另一标签抗原 GST-FABI2,将诱导表达后的细胞超声破碎后离心取上清液,进行13%, SDS-PAGE,转膜后,用5%,脱脂乳粉封闭1,h.将纯化后的多克隆抗体按一定的比例稀释,稀释度分别为 1∶300、1∶600、1∶1,000、1:1,200、1∶2,400、1∶4,800,室温摇床孵育1,h,PBST洗3次.将AP标记的羊抗兔抗体稀释 10,000倍后,室温摇床孵育 1,h,最后进行 AP显色.
1.3 数据统计分析
用 Excel 2010软件分析数据,计算标准偏差并制图.
2 结果与分析
2.1 pGEX-2T-FABI2原核表达载体的构建
为了获得 5′-末端携带 GST标签的 FABI2融合蛋白,构建了 pGEX-2T-FABI2表达载体.以提取的pGEX-2T-FABI2质粒为模板,用之前设计好的FABI2引物进行 PCR验证和双酶切验证,获得条带大小约为 807,bp的片段.最后经测序验证序列完全正确,没有突变位点,表明表达载体构建成功(图1).

图1 fabI2的PCR验证和重组载体的双酶切验证Fig. 1 PCR amplification of fabI2 and restriction identification of recombinant expression plasmids
2.2 6×His-FABI2和 GST-FABI2融合蛋白的诱导表达
SDS-PAGE检测重组表达载体 pET-28b-FABI2和pGEX-2T-FABI2在E.coli BL21(DE3)中的表达,结果如图2所示.由图2可知,在0.1,mmol/L IPTG、20,℃、185,r/min条件下诱导 6,h后,含有 pET-28b-FABI2和 pGEX-2T-FABI2质粒的大肠杆菌BL21(DE3)菌株分别在约 2.8×104和 5.4×104处大量表达目的蛋白,且蛋白的表达主要集中在上清液.

图2 SDS-PAGE检测重组表达载体 pET-28b-FABI2 和pGEX-2T-FABI2在E. coli BL21(DE3)中的表达Fig. 2 SDS-PAGE analysis of the expression of recombinant vectors pET-28b-FABI2 and pGEX-2TFABI2 in E. coli BL21(DE3)
2.3 6×His-FABI2和GST-FABI2融合蛋白的纯化
选用 6×His-FABI2融合蛋白作为免疫用抗原.将 6×His-FABI2融合蛋白破碎离心后取上清液,加入含有Ni SepharoseTM6,Fast Flow填料的重力柱中室温结合1,h或者4,℃过夜.由于融合蛋白的His标签特异性与上述填料结合,最后经过洗涤、洗脱等步骤可得到纯度较高的目的蛋白,纯度达 95%,以上(图3(a)),作为免疫动物所用抗原.
GST-FABI2融合蛋白用于效价的测定和免疫印迹.将破碎后的 GST-FABI2 融合蛋白离心后取上清液,加入含有Glutathione SepharoseTM4B填料的纯化柱中进行亲和纯化,经20,mmol/L还原型谷胱甘肽洗脱后得到目的蛋白(图3(b)).
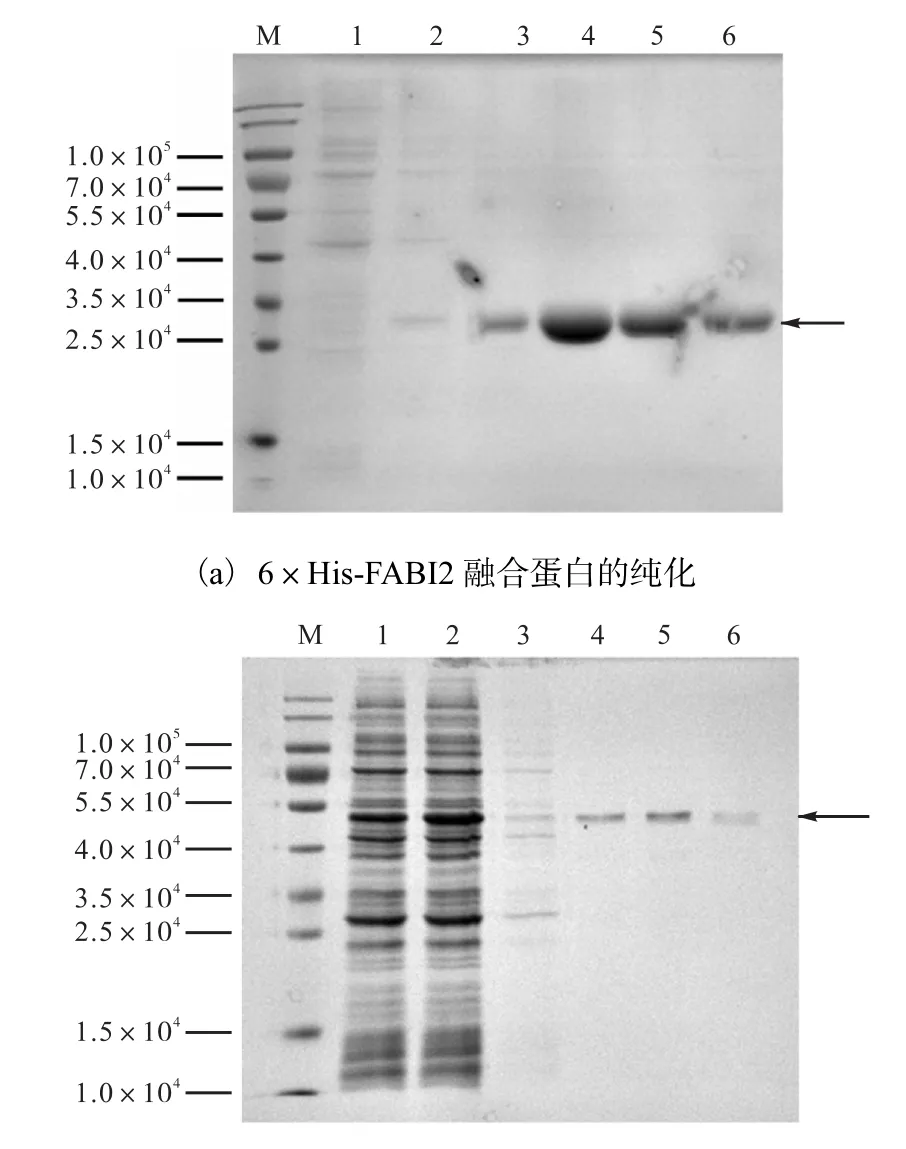
图3 pET-28b-FABI2重组蛋白和 pGEX-2T-FABI2重组蛋白的SDS-PAGE检测Fig. 3 SDS-PAGE analysis of the purified recombinant proteins pET-28b-FABI2 and pGEX-2T-FABI2
2.4 抗血清效价的检测
用纯化得到的6×His-FABI2蛋白免疫新西兰大白兔,4次免疫后从耳缘静脉处取少量血,室温静置2,h或4,℃过夜后获得析出血清,通过ELISA法测定抗血清的效价,利用酶标仪测定A450后计算抗血清的效价,结果如图4所示.由图4可知1号兔抗血清的效价大于128,000,2号兔抗血清效价大于256,000.
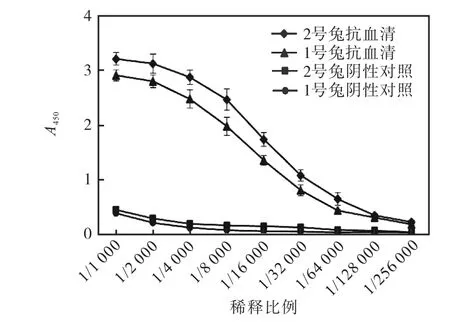
图4 间接ELISA法测定抗血清的效价Fig. 4 ELISA test results of anti-FABI2 polyclonal antiserum
2.5 免疫印迹法检测抗血清灵敏度和特异性
本研究对4次免疫后经过Protein A纯化的抗血清进行免疫印迹,结果如图 5所示,在 5.4×104处出现单一的特异性条带,证明抗血清与 FABI2蛋白特异性结合良好.

图5 免疫印迹法验证抗体特异性Fig. 5 Antibody specificity detected by Western blot
3 结 语
设计带有 BamHⅠ和 HindⅢ酶切位点的引物,从实验室已有的 pET-28b-FABI2质粒中扩增出目的片段后,构建带有 GST标签的表达载体.通过摸索合适的诱导条件,发现在 0.1,mmol/L IPTG、20,℃、185,r/min条件下诱导 6,h,pET-28b-FABI2和 pGEX-2T-FABI2质粒分别在2.8×104和5.4×104处大量表达蛋白,且集中在上清液中.由于表达的蛋白为水溶性,因此纯化得到的融合蛋白空间结构完好.除此之外,选择 6×His-FABI2融合蛋白作为免疫用抗原,由于其标签相对分子质量小,因此与 GST标签相比而言,免疫动物产生的免疫反应更小.4次免疫后测效价,合格后股动脉取血.最后对血清进行Protein A亲和纯化并进行特异性检验,发现血清可与 FABI2蛋白特异性结合,标志着多克隆抗体制备成功.在进行免疫印迹法检测时,以所得的抗体为一抗,另一个标签的抗原进行上样,排除了His标签产生的抗体对标签的识别作用.后续将会采用免疫荧光技术对该抗体进行定位.
