重组大豆铁蛋白受食源活性小分子诱导的还原释放性质
2018-10-23刘玉茜张志平吴丹丹唐禹馨徐晶晶周中凯
刘玉茜,杨 瑞, ,张志平,吴丹丹,唐禹馨,徐晶晶,周中凯,
(1. 食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津 300457;2. 天津科技大学新农村发展研究院,天津 300457;3. 广东环境保护工程职业学院,佛山 528216)
铁蛋白是广泛存在于生命体内的一种贮铁关键蛋白质[1].典型的铁蛋白分子是由 24个亚基组成的中空球状分子[2],每两个亚基反向平行形成一组,再由这 12组亚基对构成一个近似正八面体,成 4-3-2重轴对称的球状分子[3].一分子铁蛋白包括 12个二重轴通道、8个三重轴通道和 6 个四重轴通道[4](图1).这些通道负责铁蛋白与外界环境的物质交换,是铁蛋白内部与外部离子进出铁蛋白的必经之路,起着沟通铁蛋白内部空腔与外部环境的作用[5].
铁蛋白的铁还原释放现象是指当细胞需要铁时(Fe2+浓度低),铁蛋白在还原剂的帮助下将储存于铁蛋白内部空腔内的Fe3+还原为Fe2+,使铁释放出来并转移到铁蛋白外部供机体利用的过程,释放的快慢与还原剂的浓度、蛋白的种类以及溶液 pH有很大关系[6].研究铁蛋白的铁还原释放是了解铁蛋白铁代谢途径及其机理的重要手段之一,同时也为了进一步阐明铁蛋白的性质,为开发新型天然补铁功能产品提供良好的基础资料.目前,对于铁蛋白的铁吸收途径研究比较清楚,由于铁蛋白的铁释放过程比较复杂,无法采用简单动力学公式阐明铁还原释放全过程及其规律[7],因而相关的研究进展报道并不多.

图1 铁蛋白壳状结构图Fig. 1 Ferritin structure
本实验中利用食源活性小分子表没食子儿茶素没食子酸酯(EGCG)、维生素 C(VC)、烟酰胺腺嘌呤二核苷酸(NADH)3种还原成分,研究食品多组分分子对铁的还原释放的影响.其中:EGCG是从绿茶中提取出的一种抗氧化极强的多酚类物质.VC是食品工业中非常常用的活性组分,是一种高活性物质和抗氧化剂,能使难以吸收的三价铁还原为易吸收的二价铁,促进了铁的吸收.实验中另一种原料 NADH为还原态,具有将三价铁还原为二价铁的性质[8].这 3种成分均为还原性分子,但是其相对分子质量大小和性质各不相同,它们对铁还原释放的影响非常值得研究.
1 材料与方法
1.1 材料
重组 H-2亚基铁蛋白(rH-2)大肠杆菌(Escherichia coli)BL21(DE3)表达菌株(菌液,实验室保存);胰蛋白胨、酵母抽提物,上海富雪生物科技有限公司;NaCl、NaOH,天津市科密欧化学试剂有限公司;HCl、乙二胺四乙酸(EDTA)、NaN3,天津市风船化学试剂科技有限公司;过硫酸铵,天津市北方天医化学试剂厂;丙烯酰胺、甲叉双丙烯酰胺、十二烷基硫酸钠(SDS)、三羟甲基氨基甲烷(Tris)、考马斯亮蓝 R-250、硫酸亚铁(FeSO4)、金属螯合剂菲洛嗪(Ferrozine)、表没食子儿茶素没食子酸酯(EGCG)、维生素 C(VC)、NADH、氨卡青霉素(AMP)、异丙基硫代半乳糖苷(IPTG)(分析纯)、蛋白 marker(分析纯)、牛血清白蛋白(BSA)(分析纯)、福林酚,北京索莱宝科技有限公司;溴酚蓝、四甲基乙二胺(TEMED),上海北诺生物科技有限公司;β-巯基乙醇,美国 Amresco公司;丙烯葡聚糖凝胶 Sephacryl S-300(分析纯),江西丰临医用器械有限公司;硫酸铵(分析纯),天津市光复科技发展有限公司;其他试剂为国产分析纯.
TGL-16A型医用离心机,长沙平凡仪器仪表有限公司;K36616D型微量移液器,德国 Eppendorf公司;DYY-2C型电泳槽,北京市六一仪器厂;EMS-19型磁力搅拌器,天津市欧诺仪器仪表有限公司;SCIENTZ-D型超声波细胞粉碎机,宁波新芝生物科技股份有限公司;GZX-9146MBE型电热鼓风干燥箱、DV-908型立式压力蒸汽灭菌器,上海博迅实业有限公司医疗设备厂;SIM-F140AY65-PC型制冰机,松下电器产业株式会社;BS-100A型自动部分收集器,上海青浦沪西仪器厂;89090A型紫外分光光度计,Agilent公司.
1.2 重组H-2亚基铁蛋白(rH-2)的制备与纯化
1.2.1 rH-2的制备
rH-2的制备在 Masuda等[9]的方法上稍作修改.将含有 rH-2目的基因表达载体的大肠杆菌(E.coli)接种至含50µg/mL AMP的 LB培养基,37℃培养.当细菌细胞浓度达到 A600=0.6时,加入工作浓度为100µmol/L的IPTG诱导目的蛋白表达,37℃摇床培养12~14 h;4℃、10 278 r/min离心15 min,取沉淀.将收集得到的沉淀菌体悬浮于纯净水中,将菌体进行超声破碎20 min,超声时间为2 s,工作间隔为 2.5 s.超声后菌液4℃、10000g离心15min,收集上清液于50℃水浴加热10 min,4℃、10 278 r/min再次离心15min,取上清液.在上清液中加入 40%硫酸铵盐析沉淀,在4℃层析柜中静置过夜.4℃、10278r/min离心15 min,收集沉淀,将沉淀用缓冲液(20 mmol/L Tris-HCl,pH 8.0,100mmol/L NaCl)进行复溶即可得到 rH-2粗蛋白.使用 Tris-HCl缓冲液(pH 7.5,20mmol/L)透析 rH-2粗蛋白,每隔 6h 换一次缓冲液,透析 3次除去硫酸铵.最后将透析后得到的蛋白溶液用0.22µm水系膜过滤.
1.2.2 rH-2的纯化与表征
将粗蛋白进行凝胶柱层析,上样前均需过0.22µm 滤膜.用含 0.15mol/L NaCl的 50mmol/L Tris-HCl缓冲液(pH 7.5)平衡Sephacryl S-300柱,待凝胶柱平衡后,取样品上样后再洗脱,流量为0.5mL/min,每管5mL收集样品,并用聚丙烯酰胺凝胶电泳检测蛋白纯度.蛋白纯化过程均在4℃下低温操作.最后将纯化的 rH-2蛋白超滤浓缩后置于 4℃备用.
参照 Laemmli[10]方法,采用 SDS-PAGE电泳测定分离纯化后的rH-2的纯度.其中SDS-PAGE 电泳蛋白质 marker相对分子质量:磷酸化酶 B 9.74×104,牛血清清蛋白 6.62×104,兔肌动蛋白 4.30×104,牛碳酸酐酶 3.10×104,胰酶抑制剂 2.01×104,溶菌酶 1.44×104.凝胶为 4%~20%梯度胶,胶板大小为 80mm(W)×73mm(H)×0.75mm(T).每孔点样 10µL,marker 6µL.电泳在 17mA 恒流下进行,电泳完成后用考马斯亮蓝R-250进行染色.
1.2.3 rH-2铁蛋白浓度的测定
蛋白浓度测定参照 Lowry法[11],以牛血清蛋白(BSA)作标准曲线.
标准曲线的绘制:取6支1.5mL离心管,编号后分别加入 0、20、40、60、80、100µL 0.5mg/mL BSA,用蒸馏水补足 400µL,使每管蛋白含量分别为 0、10、20、30、40、50µg,每支离心管中加入 400µL 标准蛋白工作液,剧烈震荡后静置10min.继续加入20%福林酚 200µL,立即混匀,室温下静置 30min.用石英比色皿测定 750nm 处吸光度 A750,以蛋白浓度为横坐标,吸光度为纵坐标,绘制标准曲线,其方程为y=0.009x+0.0958,R2=0.9787.
样品测定:根据溶液蛋白浓度的高低,选择合适的加样量,每样作 3个平行.用超纯水补足 400µL.后续处理同上述标准曲线的绘制.根据吸光度对照标准曲线,得出比色液中蛋白质含量.
1.3 rH-2铁蛋白还原释放动力学测定
菲洛嗪是一种螯合剂,当其遇到 Fe2+时,相互结合形成螯合物[Fe(ferrozine)3]2+,这种螯合物在562nm波长处有紫外吸收,其紫外吸收强度可以间接判断 Fe2+的释放量[12].反应在 25℃下进行,以不加还原剂的体系作为空白对照.
FeSO4溶液的配制:用浓硫酸配制50mL pH 2.0的酸化水.称取 0.0834g FeSO4溶于酸化水中,定容,配制成 50mL浓度为 6mmol/L的 FeSO4母液,摇匀后避光保存.
螯合剂溶液的配制:称取 0.04924g菲洛嗪溶于1mL的蒸馏水中,配制成 0.1mol/L的菲洛嗪母液,摇匀后避光保存.
在 rH-2的提取过程中,从大肠杆菌生长和表达的培养基至蛋白的提取纯化过程都没有铁离子的加入,所以制备出来的铁蛋白是不含铁的空蛋白[9].因此,参照文献[13]报道的方法先将纯化得到的 rH-2制备成含铁的铁蛋白,然后再对制备的 rH-2含铁铁蛋白进行还原释放动力学测定[14].
1.3.1 EGCG对铁蛋白还原释放的影响
取 4支 1.5mL的离心管,分别加入 1mL浓度为 1µmol/L 的铁蛋白溶液,再分别加入不同体积的浓度为 6mmol/L的 FeSO4溶液,使 Fe2+与铁蛋白的终浓度比分别为 600∶1、400∶1、200∶1、100∶1,避光摇匀,静置10min后加入浓度为0.1mol/L的菲洛嗪溶液 10µL,充分摇匀后,加入比色皿中.再加入相同体积的浓度为 1.0mmol/L的 EGCG溶液,使得EGCG 与铁蛋白浓度比均为 220∶1,在 25℃、562nm下进行测定,观察紫外强度随时间的变化,每个样本运行1800s,循环时间0.5s.
分别固定 Fe2+与铁蛋白的浓度比为 600∶1,加入浓度为0.1 mol/L的菲洛嗪溶液10µL,充分摇匀后,加入比色皿中.再加入不同体积的浓度为1.0mmol/L的EGCG溶液,使得EGCG与铁蛋白的终浓度比分别为 20∶1、60∶1、100∶1、140∶1、180∶1、220∶1、260∶1.在 25℃、562nm 处进行测定,观察紫外强度随时间的变化,每个样本运行1800s,循环时间 0.5s.
1.3.2 VC对铁蛋白还原释放的影响
依照1.3.1节相同的操作方法进行实验,观察VC对铁蛋白还原释放的影响.
1.3.3 NADH对铁蛋白还原释放的影响
实验操作方法同1.3.1节,观察NADH对铁蛋白还原释放的影响.
2 结果与讨论
2.1 rH-2的制备与表征
将纯化后的蛋白通过 SDS-PAGE进行纯度鉴定和亚基相对分子质量确定,结果如图 2所示.SDSPAGE电泳图表明纯化后的rH-2在2.8×104处呈现单一条带,与文献[15]报道相符.虽然纯化后的 rH-2有少量的杂带,但其纯度符合实验要求.

图2 rH-2的SDS-PAGE电泳图Fig. 2 SDS-PAGE of rH-2
2.2 EGCG诱导铁蛋白还原释放
铁蛋白的三重轴通道具有亚铁氧化酶活性位点,外源添加的 Fe2+在氧气存在的情况下会被该活性位点中心氧化成 Fe3+并储藏在铁蛋白内部[1,4],该结论已被广泛报道.在还原剂(如 VC、EGCG)的存在下,在植物铁蛋白内储存在铁蛋白内部的 Fe3+能通过四重轴通道被还原释放出铁蛋白[16].EGCG诱导铁蛋白还原释放变化曲线如图3所示.
当还原剂 EGCG与铁蛋白浓度比为 220∶1时(图 3(a)),且 Fe2+与铁蛋白浓度比为 100∶1时,随着时间的推移,吸光度逐渐增加,但是相同的时间范围内,其增加程度逐渐降低,表明 Fe2+释放速率降低.同时,随着 Fe2+与铁蛋白浓度比的递增,吸光度增加速率也呈递增趋势,其原因可能是 EGCG具有很强的还原性,且可以直接进入铁蛋白内腔,使铁核中Fe3+还原成Fe2+并释放出来[16],而且随着Fe2+与铁蛋白浓度比的增加,在相同浓度的还原剂 EGCG存在条件下,有更多的 Fe3+被还原成 Fe2+,因此吸光度值越来越大.
当 Fe2+与铁蛋白浓度比为 600∶1时(图 3(b)),随着 EGCG与铁蛋白浓度比的增加,吸光度在相同的时间范围内,增加程度呈上升趋势,表明 Fe2+释放速率升高.其原因可能是由于 EGCG分子质量相对较小,可以通过四重轴通道直接进入铁蛋白内腔[17-18],加之具有很强的还原性,所以随着EGCG浓度的增加,被还原释放出的 Fe2+也增加,从而导致吸光度越来越大,Fe2+释放的速率也递增.EGCG 诱导铁蛋白还原释放的研究表明,铁蛋白中铁的释放速率同时受 Fe2+装载量和还原剂 EGCG 浓度的影响,并且与这两种影响因素成正比关系.
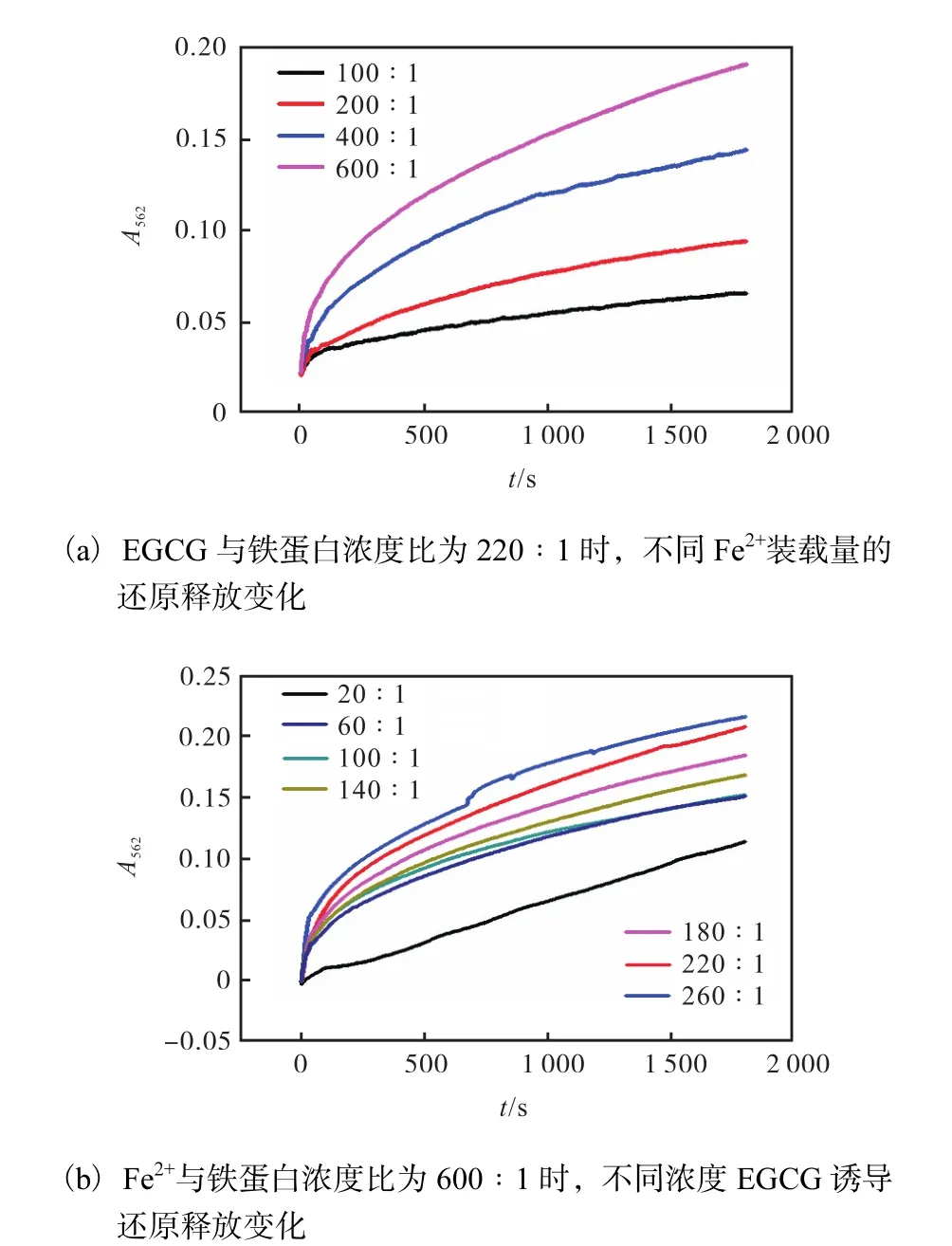
图3 EGCG诱导铁蛋白还原释放变化曲线图Fig. 3 EGCG induced changes in the reduction and release of ferritin
2.3 VC诱导铁蛋白还原释放
VC诱导铁蛋白还原释放变化曲线如图 4所示.图 4(a)表明:当还原剂 VC与铁蛋白浓度比为220∶1、Fe2+与铁蛋白浓度比为 100∶1时,吸光度随时间的增加而逐渐增加,但在相同的时间范围内,增加程度逐渐降低,表明 Fe2+释放速率降低.同时,随着Fe2+与铁蛋白浓度比的递增,吸光度增加速率也呈递增趋势.其原因可能是 VC具有很强的还原性,能进入铁蛋白内腔[19],将铁核中Fe3+还原成Fe2+并释放出来,且在相同浓度的还原剂 VC存在条件下,随着Fe2+浓度的增加,有更多的 Fe3+被还原成 Fe2+,从而吸光度越来越大.图4(b)表明:当Fe2+与铁蛋白浓度比为 600∶1、VC与铁蛋白浓度比为 20∶1时,随着时间的推移,吸光度逐渐增加,但是相同的时间范围内,其增加程度逐渐降低,表明 Fe2+释放速率降低.同时,随着VC与铁蛋白浓度比的增加,相同的时间范围内,其增加程度逐渐上升,表明 Fe2+释放速率升高.其原因可能是由于 VC相对分子质量相对较小,可以通过四重轴通道直接进入铁蛋白内腔,加之具有很强的还原性,所以随着 VC浓度的增加,被还原释放出的 Fe2+也增加,从而导致吸光度越来越大,Fe2+释放的速率也递增[19].因此,得出与 2.2节类似的结论,除 Fe2+装载量外,还原剂 VC浓度也影响铁的释放速率,且与这种影响因素也成正比关系.

图4 VC诱导铁蛋白还原释放变化曲线图Fig. 4 VC induced changes in the reduction and release of ferritin
2.4 NADH诱导铁蛋白还原释放
Fe2+与铁蛋白浓度比为600∶1时,铁蛋白受不同浓度的NADH诱导还原释放变化曲线如图5所示.
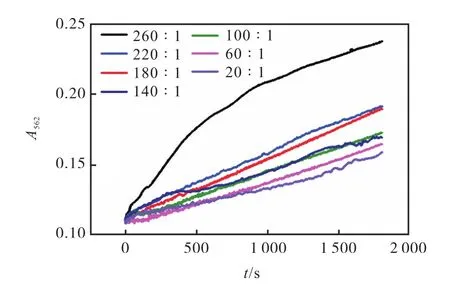
图5 Fe2+与铁蛋白浓度比为 600∶1时,铁蛋白受不同浓度的NADH诱导还原释放变化曲线图Fig. 5 Reduction and release curves of ferritin induced by different concentrations of NADH when Fe2+/ferritin=600∶1
当 Fe2+与铁蛋白浓度比为 600∶1、NADH 与铁蛋白浓度比为 20∶1时,随着时间的推移,吸光度逐渐增加,但是相同的时间范围内,其增加程度逐渐降低,表明 Fe2+释放速率降低.同时,随着 NADH与铁蛋白浓度比的增加,相同的时间范围内,其增加程度逐渐上升,表明 Fe2+释放速率升高.其可能的原因是由于 NADH具有很强的还原性,本身的分子质量相对比较大,不能直接进入铁蛋白内腔,但能在铁蛋白表面进行相互作用,从而产生能量振动转移,使铁核中 Fe3+还原成 Fe2+并释放出来,所以随着时间的增加,吸光度逐渐增大.随着 NADH浓度的增加,被还原释放出的 Fe2+也增加,从而导致吸光度越来越大,Fe2+释放的速率也递增[19].
2.5 VC、EGCG和NADH诱导铁蛋白还原释放的比较分析
铁蛋白受VC、EGCG、NADH诱导还原释放变化曲线对比结果如图 6所示.当 Fe2+与铁蛋白浓度比为 600∶1,VC、EGCG、NADH 与铁蛋白浓度比均为220∶1时,随着时间的增加,吸光度均逐渐增加,吸光度上升斜率逐渐降低,但是 EGCG、VC和 NADH还原释放 Fe2+的速率并不相同.VC诱导的还原释放整体吸光度上升最快,持续时间最长,NADH诱导的还原释放整体吸光度上升最慢,持续时间最短.其可能原因是:由于EGCG和VC都是相对分子质量较小并且还原性很强的活性物质,均可以进入铁蛋白内腔;但不同的是,由于 EGCG 的还原性比 VC更大,所以在反应初期,EGCG诱导的还原释放速率比 VC高.但是,因为 VC的相对分子质量比 EGCG 更小,VC比 EGCG更容易进入铁蛋白内腔,随着反应时间增加,铁蛋白空腔内的 VC浓度增加比 EGCG大,从而导致 VC诱导的还原释放速率持续增加时间比EGCG长.
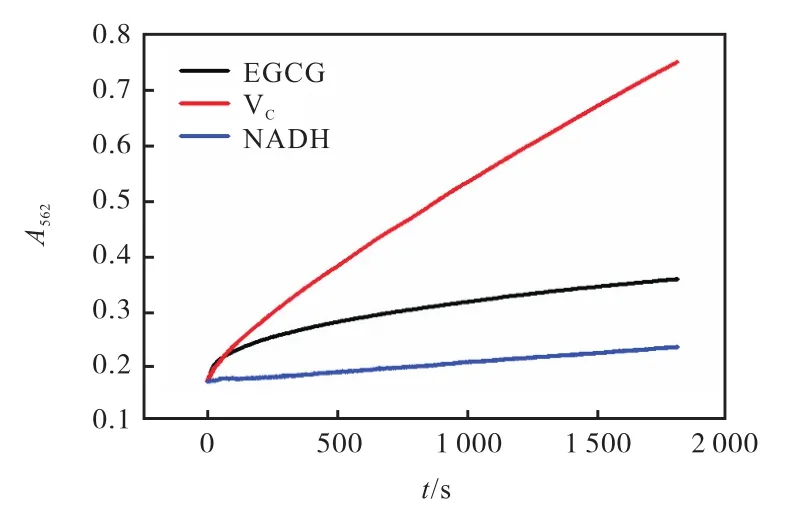
图6 铁蛋白受 VC、EGCG、NADH诱导还原释放变化曲线对比图Fig. 6 Contrast of reduction and release of ferritin induced by VC,EGCG and NADH
然而,NADH相对分子质量相对比较大,不可以直接进入铁蛋白内腔,只能与铁蛋白表面进行相互作用并结合为复合物,从而产生能量振动转移,使铁核中 Fe3+还原成 Fe2+并释放出来.这说明 NADH 诱导的铁还原释放是通过蛋白壳上的电子传递链进行的,并推断该电子传递链存在于四重轴通道上[19].由于能量振动转移过程需要时间,所以使得 Fe3+还原成Fe2+的速率相对EGCG和VC减小.
3 结 论
EGCG、VC和 NADH这 3种食源还原成分都能诱导重组铁蛋白 rH-2中铁的还原释放.其中:随着Fe2+与铁蛋白浓度比的递增,VC和 EGCG 对铁的还原释放呈递增趋势,并且 VC和 EGCG在装载相同Fe2+浓度的情况下,随着还原剂浓度的升高,其诱导的还原释放速率也上升,VC相对于 EGCG诱导的还原释放速率更大,持续时间更长.NADH诱导的还原释放整体吸光度上升速率最慢,持续时间最短.该研究对于提高铁蛋白-食源组分相互作用的认识具有重要意义,同时也可为开发基于铁蛋白的产品提供理论参考.
