风湿宁胶囊对类风湿关节炎治疗效果的转录组测序研究❋
2018-10-23王一婕王永辉刘佳维
王一婕,王永辉,刘佳维,周 然
(山西中医药大学,山西 晋中 030006)
类风湿性关节炎(rheumatoid arthritis,RA)作为自身免疫性疾病,以关节炎症过度活跃的免疫应答为特征,其免疫系统将正常细胞作为病原体错误识别并进行攻击[1],因此减轻炎症反应介导下的免疫应答是RA治疗的重点。本研究FSN胶囊主治风寒湿兼瘀血阻络型痹症,经过多年临床应用证明可明显改善患者症状、体征、延缓病情进展,且抗炎作用良好[2]。
转录组是从转录水平研究细胞或器官在特定时间段所有基因转录及转录调控规律的整体表达,其作为当前最有效的高通量技术,可快速发现和鉴定标志物和功能基因[3-5]。本研究利用转录组技术识别与RA相关的差异表达基因[6-7],为探索FSN胶囊治疗类风湿关节炎可能的靶点提供初步的科学依据。
1 材料
1.1 药品与试剂
风湿宁胶囊(FSN)由独活、川牛膝、羌活、片姜黄、青风藤、延胡索、川芎、砂仁、肉桂、三棱、麻黄、血竭、威灵仙、熟地黄、防风、甘草和生姜17味药组成,山西仁源堂药业有限公司生产(20160220); 完全弗氏佐剂(美国Sigma);免疫牛II型胶原(美国Chondrex100028); Tofacitinib(美国Selleck公司中国分公司S5001); 大鼠IL-1β、IL-6、TNF-α ELISA试剂盒(上海西唐生物科技有限公司); RNAlater® Solution (美国Thermofisher); TRIzol Plus RNA Purification Kit (美国ThermoFisher); TURBO DNA-freeTMKits (美国Sigma)。
1.2 实验仪器
StepOnePlus Real-Time PCR System (美国AB);Aligent生物分析仪(美国Aligent);Illumina HiSeq 4000 (美国Illumina)。
1.3 实验动物
156只雄性SD大鼠, 2月龄, 体质量(180±20) g, 购自北京维通利华实验动物技术有限公司(动物合格证号SCXK京20120001)。
2 方法
2.1 模型构建及分组给药
参考《中医药动物实验方法学》[8]制备CIA模型、CIA+寒湿复合模型大鼠,复合模型组大鼠置于人工气候箱中模拟诱导RA的寒湿环境[Rh=(90±4)%, T=(6±2)℃]连续刺激8 h,每日1次,连续14 d;于实验第7天,在大鼠右后肢足爪、尾根、背部各注射Ⅱ型胶原乳液(1 mg·mL-1)0.1 mL,实验14 d同法加强免疫1次,制备复合模型类风湿关节炎大鼠动物模型;CIA模型组除不进行寒湿刺激外,余同复合模型组;正常组除7 d、14 d于相同部位皮下注射等量生理盐水外,不施加任何刺激。
大鼠按随机数字表法分为正常组、CIA、复合模型组、FSN-CIA低剂量组(0.33 g/kg)、FSN-CIA中剂量组(0.66 g/kg)、FSN-CIA高剂量组(1.32 g/kg)、FSN-复合低剂量组(0.33 g/kg)、FSN-复合中剂量组(0.66 g/kg)、FSN-复合高剂量组(1.32 g/kg)、Tofacitinib组(15 mg/kg)、塞隆风湿组(0.186 g/mL)各12只。正常组和模型组等量生理盐水灌胃,各剂量FSN每日1次,Tofacitinib、塞隆风湿每日1次,连续28 d。造模28 d后观察各组大鼠关节肿胀度、关节病理改变以及相关炎性因子水平变化,观察FSN胶囊对不同模型大鼠的治疗效果。
2.2 观察评价指标
2.2.1 大鼠关节肿胀度 水容积法于造模完成后1 d对各组大鼠的后肢容积进行测量,隔7 d 记录1次容积。将d1测得的值作为基值,下一次测得的值与前一次比较计算关节肿胀度。肿胀度=(造模后容积-造模前容积)/造模容积×100%。
2.2.2 大鼠关节病理学观察(HE染色) 28 d处死大鼠后剔除表面肌肉组织,将其后肢剪下用PBS (PH7.3)溶液冲洗3次,将各组踝关节置于4%多聚甲醛溶液中固定24~48 h。按以下步骤处理:脱钙→脱水与透明→石蜡包埋→踝关节矢状面切片→HE染色。
2.2.3 ELISA法检测大鼠血清中炎性细胞因子水平 28 d灌胃结束后取各组大鼠外周血离心分离血清,用ELISA检测其中炎性细胞因子IL-1β、IL-6、TNF-α水平。
2.3 统计学方法

2.4 转录组测序研究
2.4.1 大鼠关节滑膜提取 28 d灌胃结束,取正常、CIA模型、FSN-CIA高剂量组(FSNH)、复合模型组(HSCIA)、FSN-复合高剂量组(FSN-HSCIA)5组大鼠,每组12只,乙醚麻醉颈椎脱臼处死,置于75%酒精里浸泡15 min,沿膝关节中将皮肤剪开,分离滑膜滑游离端切下置于液氮罐中,移至-80 ℃冰箱备用。
2.4.2 总RNA提取检测及测序 提取5组大鼠滑膜组织总RNA,样本检测合格后,经过mRNA的富集、片段化、反转录、末端加接头构建cDNA文库。质检合格后使用Illumina HiSeq 4000测序,获得原始测序短序列,经过滤得到短序列Clean Reads为有效数据。
2.4.3 基因表达量和差异表达基因分析 使用Bowtie2软件将clean reads比对到大鼠参考基因组序列上,RSEM软件计算大鼠滑膜组织样本中基因和转录本表达量。采用基于泊松分布原理的PossionDis法筛选差异表达基因[9]。
2.4.4 生物信息学分析 选择大鼠滑膜组织不同样本间差异表达的基因进行基因本体论GO注释功能分类和KEGG注释分类,并进行功能富集分析。
3 结果
3.1 FSN对模型组大鼠的治疗效果
表1图1、2显示,从大鼠的整体状况上看,模型组大鼠关节出现红肿,与正常组比较滑膜增生、关节肿胀度显著升高,差异有统计学意义(P<0.05),炎性细胞因子水平明显升高,差异有统计学意义(P<0.05);与CIA比较,复合模型组滑膜增生、关节肿胀度显著升高,差异有统计学意义(P<0.05),炎性细胞因子水平明显升高,差异有统计学意义(P<0.05);FSN给药组28 d后,各给药组大鼠关节肿胀度明显低于模型组,差异有统计学意义(P<0.05);大鼠外周血中炎性细胞因子IL-1β、IL-6、TNF-α的水平也有不同程度的显著降低(P<0.0);在关节病理方面,FSN治疗组可以减轻滑膜细胞增生,炎性细胞浸润也见不同程度减少,关节病理特征得到改善。
3.2 转录组测序结果
3.2.1 测序及数据过滤结果 本研究利用Illumina Hiseq 4000测序平台,每个样品均产出53.27Mb的Raw Reads,经过滤处理符合后续分析要求。

表1 FSN对模型大鼠关节肿胀度的影响
注:与正常组比较:*P<0.05;与CIA模型组比较:△P<0.05;与模型组比较:▲P<0.05

图1 FSN对模型大鼠外周血中细胞因子含量的影响注:A. FSN对模型大鼠血清IL-1β含量的影响;B.FSN对模型大鼠血清IL-6含量的影响;C.FSN对模型大鼠血清TNF-a含量的影响与正常组比较:*P<0.05;与模型组比较:#P<0.05
3.2.2 大鼠新转录本预测结果 表2显示,通过对5个样本转录组数据进行新转录本的预测分析,共获得9070个新转录本,其中蛋白编码的新转录本为6684个,非编码新转录本为2386个,获得的新变异体4084个和2600个新基因。

表2 FSN对模型大鼠滑膜组织5个样本的新转录本类型统计结果
3.2.3 基因表达量分析和差异表达基因检测 表3图3显示,通过对大鼠滑膜组织5个样品的基因和转录本的表达水平计算分析。根据5个样品的基因表达水平结果,本实验分析了各个样品间的差异表达基因。
3.2.4 差异表达基因GO功能和Pathway分析结果 图4显示,GO富集分析,大鼠滑膜组织CIA组与HSCIA组差异表达基因主要注释到生物学进程类别,包括生物学调节、免疫进程等,细胞组分类别主要包括细胞、大分子复合物等;HSCIA组与FSN-HSCIA组差异表达基因注释到生物学进程类别主要富集在细胞酰胺代谢过程等,细胞组分类别主要富集在核糖体亚基、细胞内核糖核蛋白复合物等。
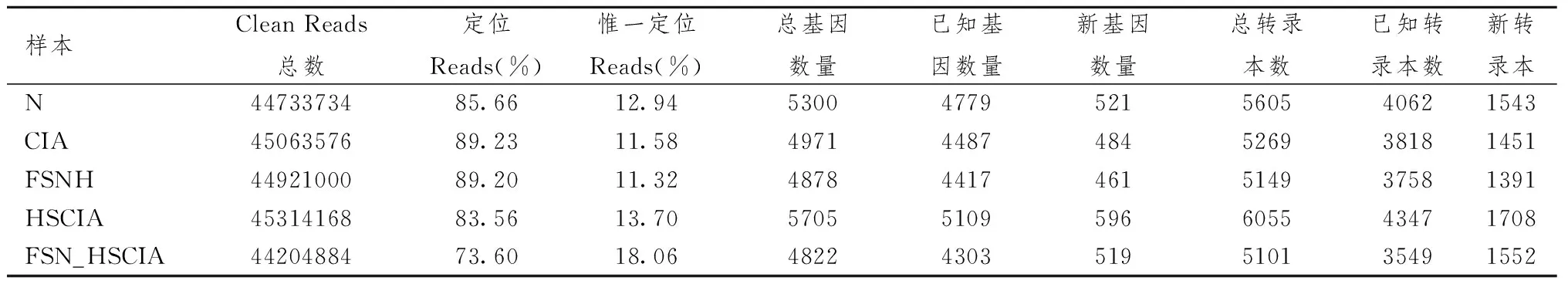
表3 FSN对模型大鼠滑膜组织5个样品基因表达量统计比较
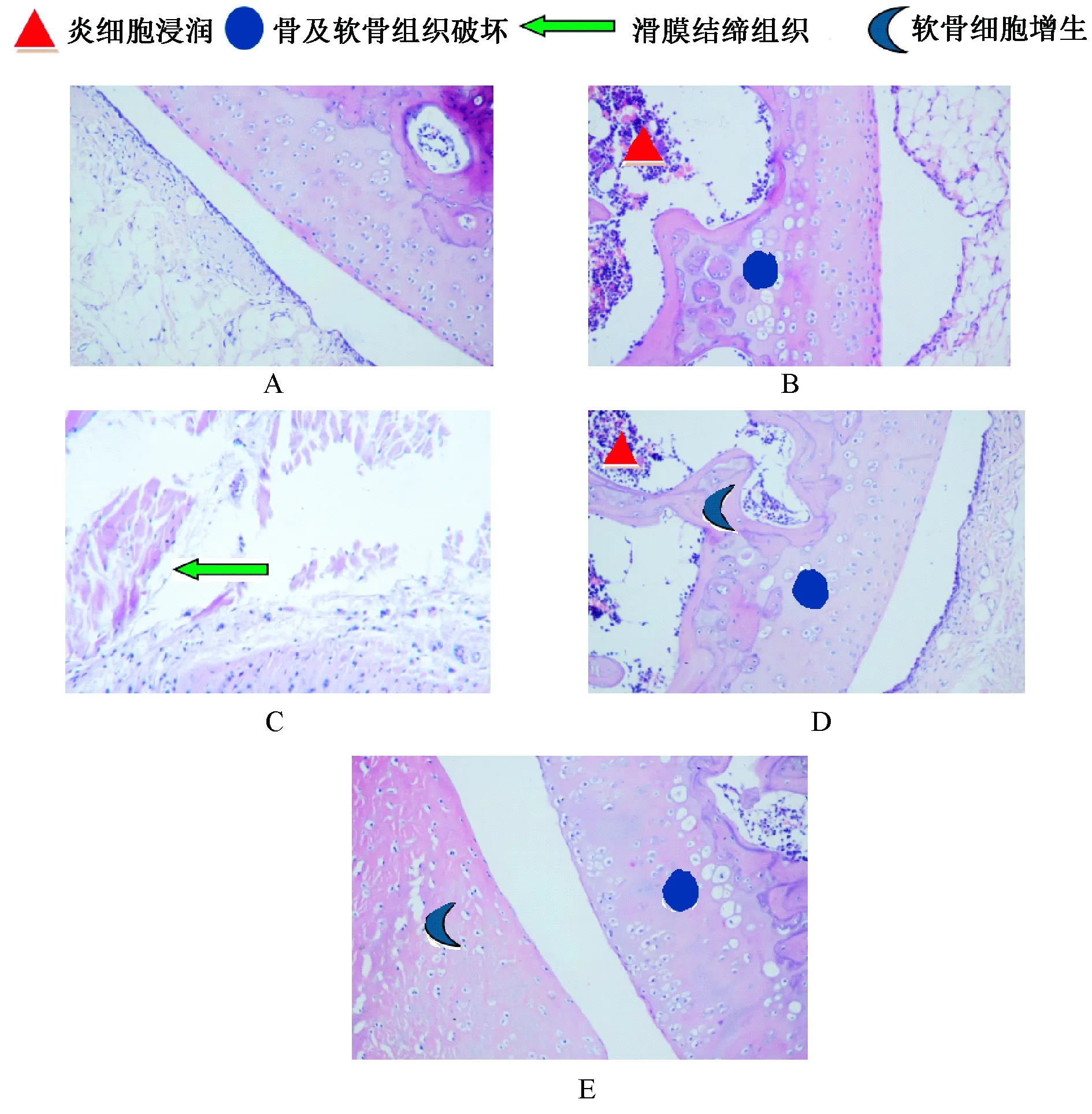
图2 FSN对模型大鼠关节病理的影响(HE×200)注:A.正常组:大鼠未见明显异常及增生,未见炎性细胞浸润、血管翳形成、骨及软骨破坏;B.CIA模型组:炎性细胞大量浸润,骨及软骨组织破坏;C.复合模型组:滑膜结缔组织大量增生,关节软骨表层纤毛状撕裂,深入软骨层、渗出明显;D.风湿宁CIA高剂量组:炎性细胞浸润减少,骨及软骨破坏减少,可见软骨细胞增生;E.风湿宁复合高剂量组:可见再生软骨基质,浅染的即为再生的软骨母细胞

图3 FSN对模型大鼠滑膜组织5个样品差异表达基因数注: X轴代表每组差异比对方案,Y轴代表相应的差异表达基因数目。浅色代表上调的差异表达基因数目,深色代表下调的差异表达基因数目

图4 A.FSN对模型大鼠滑膜组织CIA组与FSNH组差异基因GO功能分类;B.FSN对模型大鼠滑膜组织CIA组与HSCIA组差异基因GO功能分类;C.FSN对模型大鼠滑膜组织HSCIA组与FSN-HSCIA组差异基因GO功能分类
图5显示,KEGG通路富集分析,大鼠滑膜组织CIA组与HSCIA组差异表达基因富集于细胞进程、环境信息进程等总计31个通路,显著富集在泛素介导的蛋白水解、苯丙氨酸等通路中。HSCIA组与FSN-HSCIA组差异表达基因注释到细胞进程、环境信息进程等30个通路中,显著富集在甲状腺激素信号通路、吞噬体等信号通路中。CIA组与FSNH组差异表达基因富集于遗传信息进程、人类疾病总计3个通路,显著富集在类固醇生物合成、核糖体2个通路中。

图5 A.FSN对模型大鼠滑膜组织CIA组与HSCIA组差异基因Pathway分类图;B.FSN对模型大鼠滑膜组织HSCIA与FSN-HSCIA组差异基因Pathway分类;C.FSN对模型大鼠滑膜组织CIA与FSNH组差异基因Pathway分类注:X轴代表DEG数目,Y轴代表KEGG功能分类
4 讨论
RA以关节滑膜炎为基本特征,具体表现为无力、晨僵和关节酸痛、麻木等,属于中医“痹症”范畴,临床常祛风、除湿、散寒之品相须为用。白清佐提出的治痹验方风湿宁胶囊以祛风散寒除湿、活血通络为主,以祛除疾病初期之邪实,并配伍补肾温阳、护卫调营之品以护其本,可谓标本兼顾,在RA治疗中取得很好的效果。风邪善行数变,易挟寒湿之邪,故方中用大量独活、羌活以祛全身上下之风寒湿,防病邪深入;同时伍以麻黄、防风益卫解表,给寒湿之邪以出路;熟地养血和营,青风藤、威灵仙祛风,兼引湿邪于外;配伍血竭、三棱功专活血祛瘀,促进关节局部血脉运行,止痛消肿;伍以少量延胡索、川芎活血行气通滞;少量辛温之片姜黄内行气血,外散风寒湿邪;砂仁、生姜理气醒脾温阳,川牛膝、肉桂补肾温阳。纵观全方,各药配伍得当,风寒湿瘀兼顾,因此自20世纪80年代起以在医院以制剂形式进行处方用药,在晋造福广大RA患者。
FSN胶囊虽临床疗效颇显,但具体作用机制并不明确,应用转录组进行药物干预,以获得相关基因及通路信息,将为FSN胶囊的作用机制与药物关系的研究提供相关前期判断和方向。本实验发现,寒湿环境可明显加重关节炎程度,复合模型较CIA受寒湿因素影响严重,寒湿刺激加重动物模型自身免疫反应,滑膜增生、肿胀度显著升高,提示大鼠体内寒湿内阻、瘀血瘀滞之证的表现。前期FSN胶囊对模型组大鼠治疗效果研究发现,IL-1β、IL-6和TNF-α的水平下降,炎症相关因子的表达得到控制,推测RA的发病机制可能与多个蛋白异常表达及参与多条信号通路相关,其中一部分机制可能通过下调炎性细胞因子的表达起到免疫抑制作用,而缓解炎症症状。此基础上选取治疗效果较好的FSN高剂量组,对其干预前后的大鼠滑膜组织进行转录组测序研究,进一步探寻FSN胶囊治疗RA的关键作用靶点。结果表明,FSN胶囊在各个模型组和给药组中,上调基因明显要多于下调基因,表明FSN胶囊治疗RA的作用机制可能是通过下调炎性因子分泌、调节异常表达蛋白,促进抑炎因子或某些炎症负反馈调节因子表达,从而抑制炎症信号通路的激活,改善关节滑膜组织的增生及炎症,进而起到治疗RA的作用。
本实验转录组测序结果中,YB-1在CIA vs HSCIA中显著上调,在CIA vs FSNH中显著表达下调,在HSCIA vs FSN-HSCIA中显著下调,推测YB-1可能为FSN胶囊治疗RA的关键蛋白之一。Y结合蛋白1是人类细胞中广泛表达的Y-box结合蛋白家族之一,Y-box结合蛋白可能是促进某些基因的表达, 进而促进细胞增殖[10]。迄今为止,还未有相关文献报道称YB-1基因与治疗RA相关,之后的工作将进一步深入研究YB-1在FSN治疗RA的发生发展中的作用机制。本研究获得的差异表达基因可作为RA的候选致病基因进行进一步的研究,探究其在RA中的致病机制,这将有助于理解RA的发病机理,筛选RA的药物靶点。
长期以来,中药复方成分的复杂性为其机制研究带来很大难度。中医药研究借助现代生物医学的研究方法,从分子水平多方位、多角度对中医辨治理论及方药作用机制进行深入探讨。近年来,转录组测序技术应用于中医药研究,建立不同方剂处理前后的表达谱数据库,通过比对现有研究成果,构建药物影响的网络通路,有利于从基因水平解释中医辨证论治理论和作用机制等问题,为中医药复杂体系的研究和发展开辟新的道路,对中医药的发展有重要的推动作用[11]。
