生理性黄化对吐鲁番地区葡萄枝、叶形态学变化的影响
2018-10-23周龙刘春燕董凯向王包珊方海龙
周龙,刘春燕,董凯向,王包珊,方海龙
(1.新疆农业大学林学与园艺学院,乌鲁木齐 830052;2.吐鲁番现代农业科技开发中心,新疆高昌区 838000)
0 引 言
【研究意义】叶片黄化作为葡萄栽培中一种普遍发生的生产病害,近年来在吐鲁番地区葡萄栽培管理中时有发生。果树叶片黄化的诱因很多,这种病害并不是由于果树被某些病菌侵染,而是生理性黄化病害。生理性黄化会表现在内部组织结构上,而叶片作为植物进化过程中表现最为敏感的器官,其叶片厚度、栅栏组织厚度及海绵组织厚度等形态结构上发生适应性变化均是由黄化导致[1,2]。针对叶片表现出的黄化症状,及时分析树体的营养特征,对矫治黄化果树具有实际意义。【前人研究进展】李晓燕等[3]研究不同葡萄品种间组织解剖构造,发现葡萄抗寒砧木类型比栽培品种根、枝条的木质部导管体积小、数量多;葡萄叶片栅栏组织厚度占叶片厚度比率较大,海绵组织细胞较小,反映了葡萄抗寒砧木抗性强的特点。吴树彪等[4]比较不同树龄、不同品种苹果缺铁及正常叶片的解剖构造,发现缺铁叶栅栏组织细胞排列疏松、外形为较短的念珠状,叶绿体对番红呈负反应,正常叶则相反。Ranferi等[5]研究缺铁性黄化对墨西哥酸橙叶片形态等造成的影响,发现缺铁黄化使叶片解剖结构及叶片K,Fe,Mn,Fe2+含量,P/Fe和K/Ca均受到显著影响。潘学军等[6]比较4种野生葡萄品种的叶片解剖组织,发现耐旱性强的葡萄品种叶片厚度、栅栏组织厚度和海绵组织厚度及叶片组织紧密度(CRT)差异较小。【本研究切入点】吐鲁番地区出现葡萄黄化病,且黄化面积呈现逐年上升的趋势,影响葡萄生产收入。目前,国内外对葡萄黄化病虽然已经进行大量研究,但多数集中在葡萄黄化与土壤矿质营养的相关性及葡萄生长发育规律的研究,而黄化对葡萄枝叶解剖结构及叶片矿质营养差异的研究依然缺乏[7]。研究黄化病对葡萄枝叶形态、解剖结构及叶片矿质元素的影响。【拟解决的关键问题】通过测定葡萄正常株和黄化株枝叶解剖结构和叶片矿质营养等特性,分析黄化对葡萄叶片发育的影响,旨在外观诊断的基础上对葡萄叶片进行更细微的观察,为葡萄黄化诊断分析和防治提供理论参考。
1 材料与方法
1.1 材 料
供试品种为吐鲁番胜金乡色格孜库勒村葡萄黄化园无核白和无核白鸡心,葡萄园树龄8 a以上,倾斜式小棚架栽培,株行距为4 m×4.5 m。葡萄黄化病的程度划分4个等级,参考晁无疾[8]的方法,将试验地葡萄新梢叶片的黄化程度依次分为正常叶(CK)、轻度黄化叶、中度黄化叶和重度黄化叶。
在两种葡萄黄化园和正常园中选择4个果园,每个园内随机选择3株,将每个植株从架上、架中、架下3个方位分别采摘不同黄化等级的叶片50片,每级共150片叶,用硅胶干燥保存,并贴上标签带回实验室进行分析。图1
图1 葡萄叶片的黄化程度分级标准
Fig.1 Grading standard of yellow degree of grape leaves
1.2 方 法
1.2.1 叶绿素含量测定
于2017年6月进行,试验分别采取手持SPAD-502叶绿素仪测定法和丙酮研磨法[9]进行测定。
SPAD-502叶绿素仪测定法:各选取葡萄园正常株和黄化株一年生新梢枝条上第4~5片叶,向阳且无病虫害及无机械损伤的完整叶片,每个叶片再取从里到外3个点。并在当日使用便携式SPAD-502叶绿素仪测定叶片SPAD值。不同黄化程度的葡萄叶片均测定10片,将SPAD值计算平均值。
丙酮研磨法:即将样本叶片剪碎、磨浆,用80%的丙酮溶液提取,过滤后定容,分别在645、652和663 nm下测定光密度值,每组处理3个重复。叶绿素含量(mg/L)=色素浓度(C)×提取液体积(ml)×稀释倍数/样品鲜重(g)
1.2.2 茎和叶片组织显微结构观察
选取生长健壮、长势一致且在架蔓中部枝条第4~5节位的叶片及茎段。每个品种根据不同黄化程度各采集5片叶和5节茎段,用标准固定液(FAA液)固定,带回实验室后放入4℃冰箱中进行保存。
采用石蜡切片试验对葡萄茎段及叶片组织进行显微组织结构观察,切片厚度为10~12 μm,用番红固绿染色,中性树胶进行封片[10]。用Motic Type102M显微成像系统观察、拍照,用Motic Image Plus 2.0图像分析软件测量叶片厚度、上下表皮厚度、栅栏组织厚度、海绵组织厚度等指标;茎段测量主要是木质部厚度、韧皮部厚度、髓厚度等。每个品种每项指标测定10组数据。
1.2.3 叶片营养元素的测定
叶片全N采用H2SO4-H2O2消煮定氮法测定,全P采用H2SO4-H2O2消煮分光光度法,全K采用H2SO4-H2O2消煮火焰分光光度法,全Fe和全Mg采用HNO3-HClO4消煮原子吸收分光光度法,采用干灰化法测定灰分含量,即将叶片置入马福炉中经过550℃灰化5 h后测定其灰分含量,单位为%。
1.3 数据处理
试验数据采用Excel 2010和SPSS19.0软件进行单因素方差分析(One-way ANOVA)及Tukey’s多重比较,比较正常叶片和黄化叶之间指标的差异性。
2 结果与分析
2.1 不同黄化程度对葡萄叶片叶绿素含量的影响
叶绿素作为植物光合色素中是尤为重要的,其含量的多少将受逆境的胁迫而下降[11]。葡萄正常株和黄化株叶片叶绿素含量间达到显著差异。随着葡萄不同黄化程度的加剧,叶片SPAD值和叶绿素a、b和a+b含量逐渐降低。无核白正常叶SPAD值和叶绿素a+b含量分别是重度黄化叶10.56倍和5.70倍。而无核白鸡心正常叶SPAD值和叶绿素a+b含量分别是35.91倍和2.51倍。表1
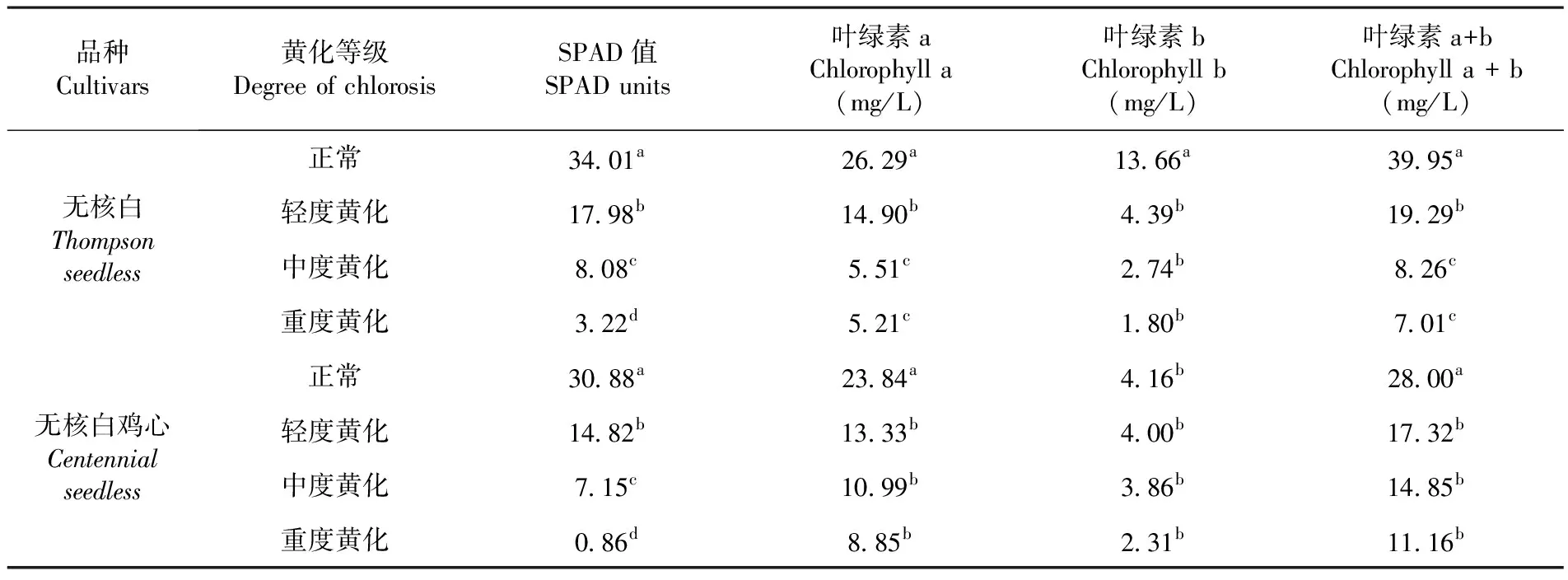
表1 不同黄化程度葡萄叶片SPAD值和叶绿素含量测定Table 1 Determination of leaf SPAD units and chlorophyll content in grape leaves with different degrees of chlorosis
注:同列数据后小写表示经Tukey法多重比较在0.05水平差异显著,下同
Notes: Same column data lowercase letters representing the same method by Tukey multiple comparisons at the 0.05 level difference was not significant.The same as below
2.2 不同黄化程度对葡萄茎、叶片形态与解剖特性的影响
2.2.1不同黄化程度对葡萄枝叶生长量的影响
黄化对葡萄的新梢节间、叶片的生长影响较为显著。随着不同黄化程度的加重,黄化株葡萄的新梢节间粗、新梢节间重、叶长和叶宽均与正常株无显著差异,而黄化株新梢节间长、叶重及单叶厚均显著低于正常株。无核白正常株的新梢节间长、叶重及单叶厚分别是重度黄化株的1.30、1.38、1.35倍;无核白鸡心正常株的新梢节间长、叶重和单叶厚分别是重度黄化株的1.23、1.80、3.54倍。表2
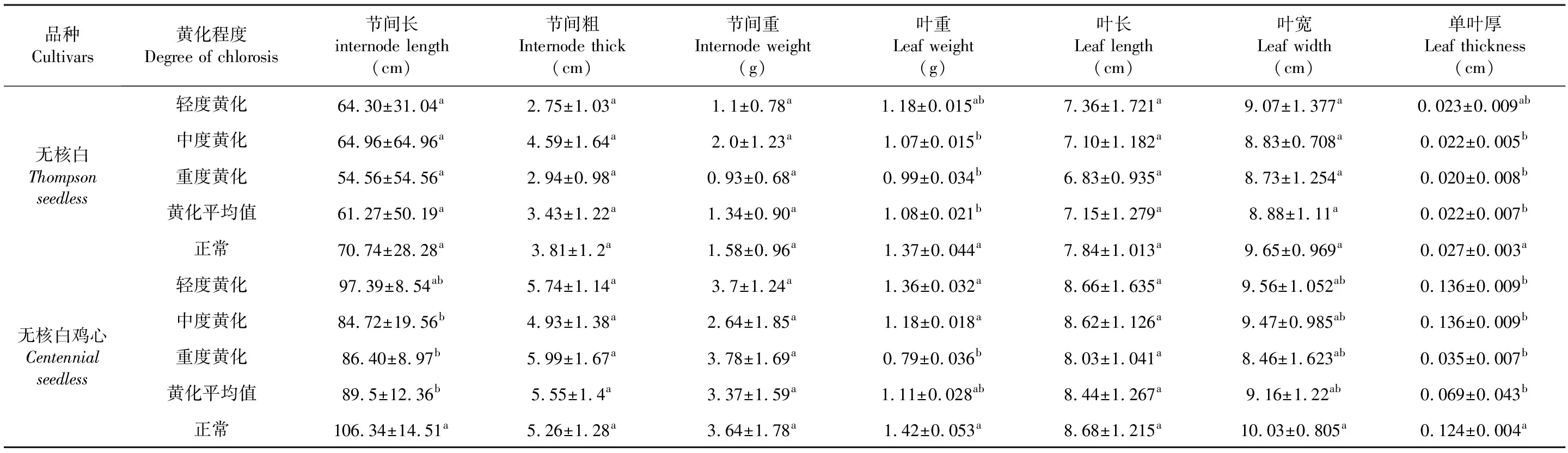
表2 不同黄化程度下葡萄枝叶生长量变化Table 2 Effects of different degrees of Chlorosis on the growth of grape branches and leaves
注:数据为平均值±标准差,表中同列数据后不同小写字母表示差异显著 (P<0.05),下同
Note:Mean±SD.The date in the same column table followed by different lowercase letter indicate significantly difference at 0.05 level.The same as below
2.2.2 不同黄化程度对葡萄茎解剖结构的影响
研究表明,正常株和黄化株茎段横切面解剖结构存在差异不显著。图中茎部横切面呈椭圆形,表皮细胞为1层,细胞体积小且排列紧密,角质层厚度较薄。外皮层是表皮层内部厚角组织细胞和薄壁细胞组成,排列分别为2~3层和5~6层,细胞体积小且排列较为松散。横切面中央是维管柱,外韧型维管组织,木质部和韧皮部排列呈环状分布,二者中有明显形成层带。维管束排列整齐,束间由3~5层的髓射线相分离。茎中间髓部发达,茎的中心由大量的薄壁细胞组成,胞间隙较小。图2
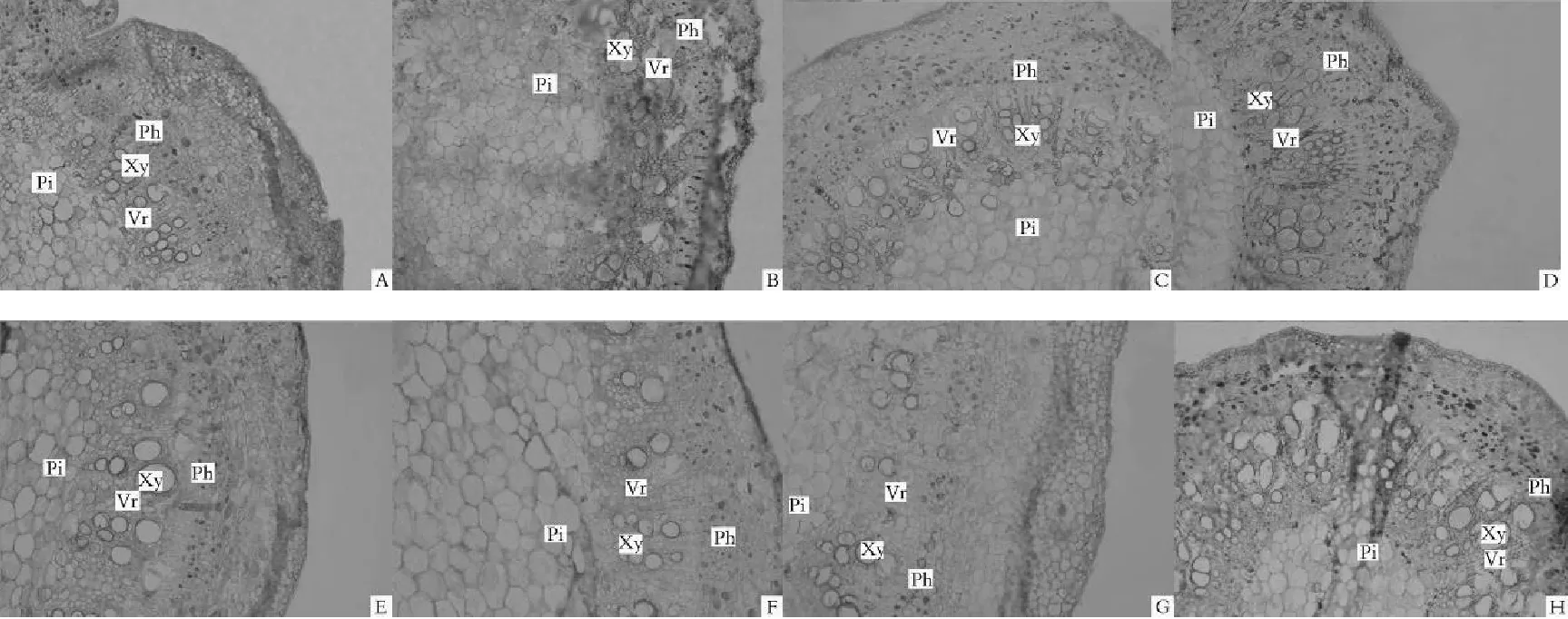
注:无核白(A.正常;B.轻度黄化;C.中度黄化;D.重度黄化);无核白鸡心(E.正常;F.轻度黄化;G.中度黄化;H.重度黄化)Pi.髓;Xy.木质部;Ph.韧皮部;Vr.木射线,标尺为100 μm
Note:Thompsonseedless(A.Normal;B.Light chlorosis; C.Middle chlorosis; D.Severe chlorosis);Centennialseedless(E.Normal; F.Light chlorosis; G.Middle chlorosis; H.Severe chlorosis) Pi.Medullary; Xy.Xylem;Ph.Phloem; Vr.xylem ray,The ruler is 100 μm
图2 不同黄化程度葡萄茎横切面显微结构观察(×10)
Fig. Observation on Microstructure of grape stem transverse section with different degrees of chlorosis(×10)
研究表明,随着黄化程度的不断加深,葡萄茎段内部结构存在明显差异。无核白正常株茎的木质部厚度、木质部厚度与韧皮部厚度比均比重度黄化株分别增厚58.33%和55.91%,而韧皮部厚度、髓厚度没有明显差异。无核白鸡心正常株分别比黄化株木质部厚度、髓厚度及木质部厚度/韧皮部厚度增厚了32.14%、56.20%和28.92%,而韧皮部厚度差异不显著。表3
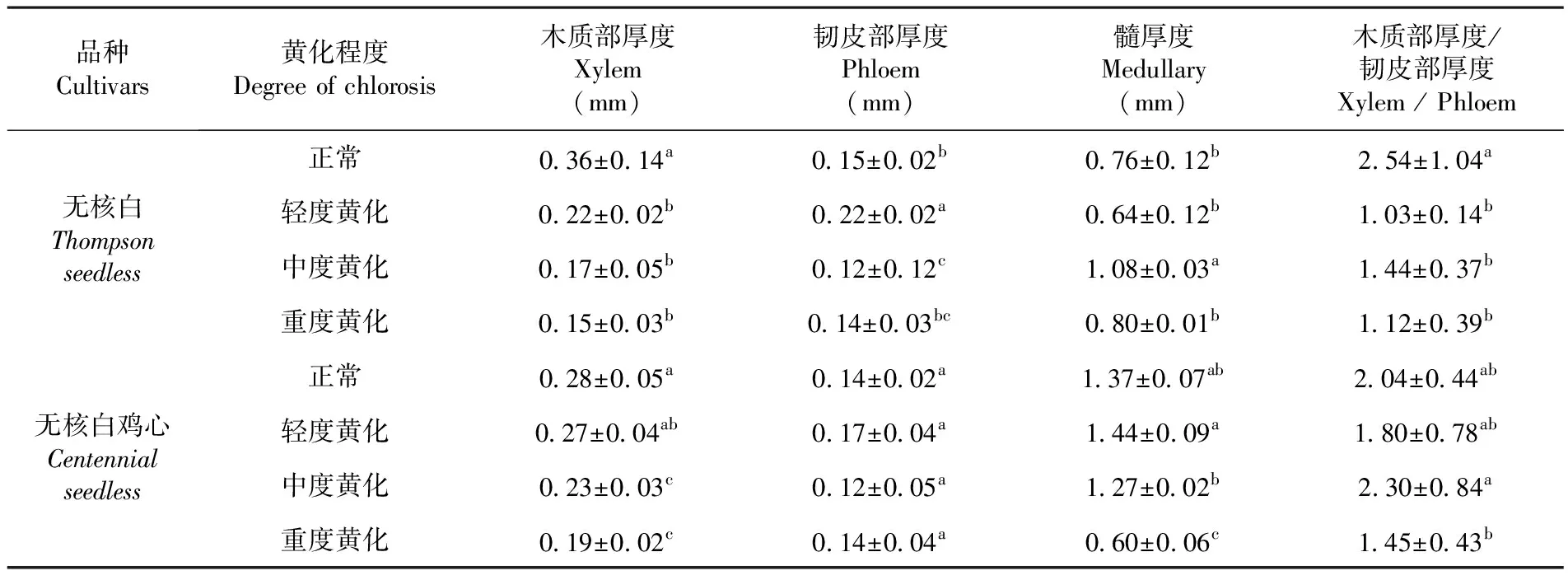
表3 不同黄化程度下葡萄茎解剖结构变化Table 3 Effects of different degrees of Chlorosis on the anatomical structure of grape stems
2.2.3 不同黄化程度对叶肉组织结构的影响
无核白叶片A-D和无核白鸡心叶片E-H所示为葡萄的叶片横切面解剖结构,两种葡萄正常植株叶片叶绿体数量较多,且排列紧密,尤其是横切面上部两层排列的有2~3层呈圆柱形的栅栏组织细胞组成;海绵组织细胞较大且排列较为密集。在重度黄化后,细胞长度和数量均显著低于正常叶,栅栏组织厚度变为原来的一层,细胞外部形态呈现不规则块状,甚至有些出现断裂状态,叶绿体数量少且细胞排列较为松散;而海绵组织细胞排列也极其疏松,细胞数量较少,栅栏组织与海绵组织界限较为模糊,整个叶肉组织变薄。图3

注:无核白叶肉组织(A.正常;B.轻度黄化;C.中度黄化;D.重度黄化);无核白鸡心叶肉组织(E.正常;F.轻度黄化;G.中度黄化;H.重度黄化)a.上表皮;b.下表皮;c.栅栏组织;d.海绵组织
Note:Thompsonseedless(A.Normal; B.Light chlorosis; C.Middle chlorosis; D.Severe chlorosis);Centennialseedless(E.Normal; F.Light chlorosis; G.Middle chlorosis; H.Severe chlorosis) a.Upper-epidermis; b.Lower-epidermis; c.Palisade tissue; d.Spongy tissue
图3 不同黄化程度葡萄叶肉组织结构观察
Fig.3 Observation on the structure of grape mesophyll with different degrees of yellowing
研究表明,随着葡萄叶片黄化程度的不断加深,叶片变薄,葡萄正常株与黄化株叶肉组织结构特征之间呈显著差异。两种葡萄正常株叶片厚度比黄化株分别增厚了20.93%和39.17%,无核白重度黄化叶上、下表皮厚度分别只有正常叶的94.11%和38.78%,但不同黄化程度间葡萄叶片上、下表皮厚度达到不显著差异。两种葡萄重度黄化叶片的栅栏组织厚度和海绵组织厚度仅仅比正常株叶片分别降低了18.94%、46.81%和126.02%、38.43%。无核白鸡心正常叶栅海比与黄化叶呈显著差异,黄化叶是正常叶的61.84%,而无核白正常与黄化叶栅海比间差异不显著。表4
2.3 不同黄化程度对葡萄叶片矿质营养的影响
葡萄正常株和黄化株叶片矿质营养元素达显著差异。随着葡萄叶片黄化程度的加深,两种葡萄叶片N、Fe、Mg含量呈不断下降趋势,而P、K含量、P/Fe、K/Mg及叶片灰分含量呈上升趋势。两种葡萄正常株叶片N、Mg含量分别比重度黄化叶高31.85%、40.97%和43.08%、40%,而无核白正常株叶片P、K含量比黄化株叶片分别减少36.51%和51.50%,达到显著差异。叶片灰分含量作为植物矿质元素的总和,无核白和无核白鸡心叶片平均灰分含量最小分别为8.13%、8.38%,最大分别为10.85%、11.04%,且无核白鸡心平均灰分含量大于无核白平均灰分含量。表5
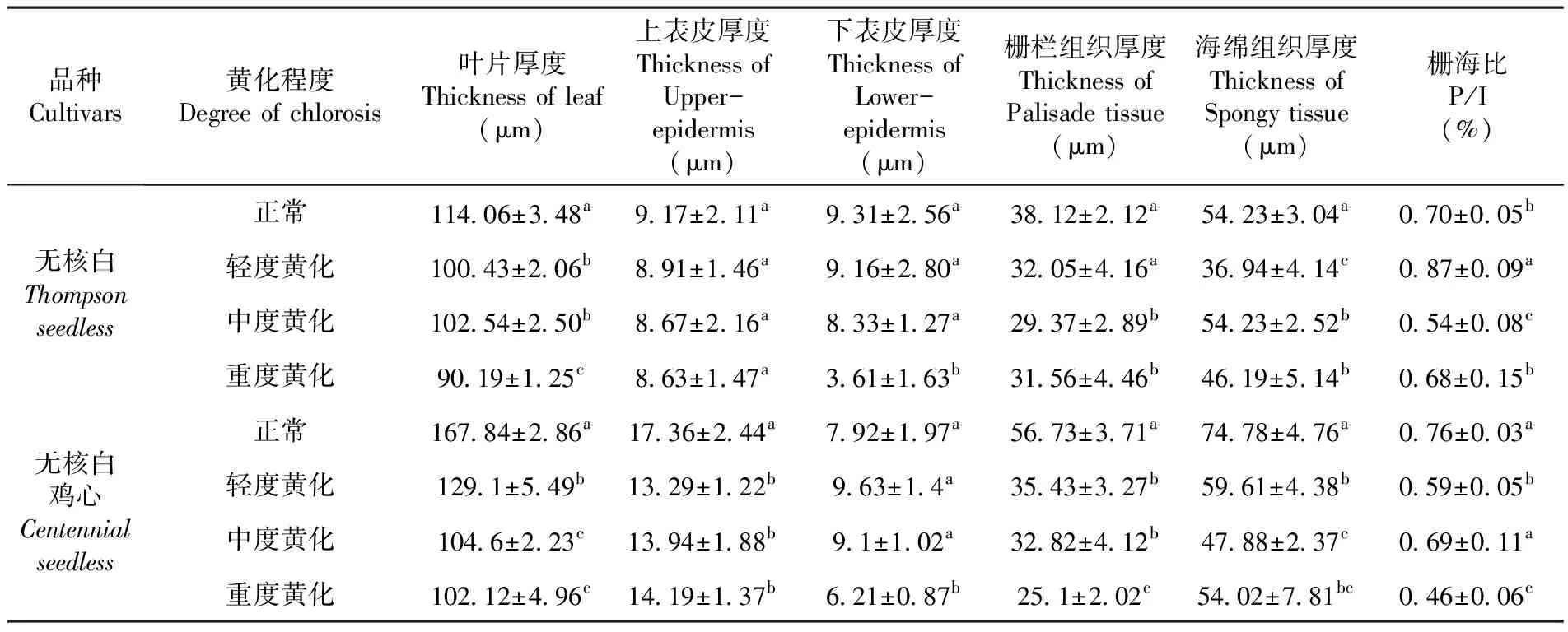
表4 不同黄化程度下葡萄叶片解剖结构变化Table 4 Effect of the degree of chlorosis on leaf anatomical structure
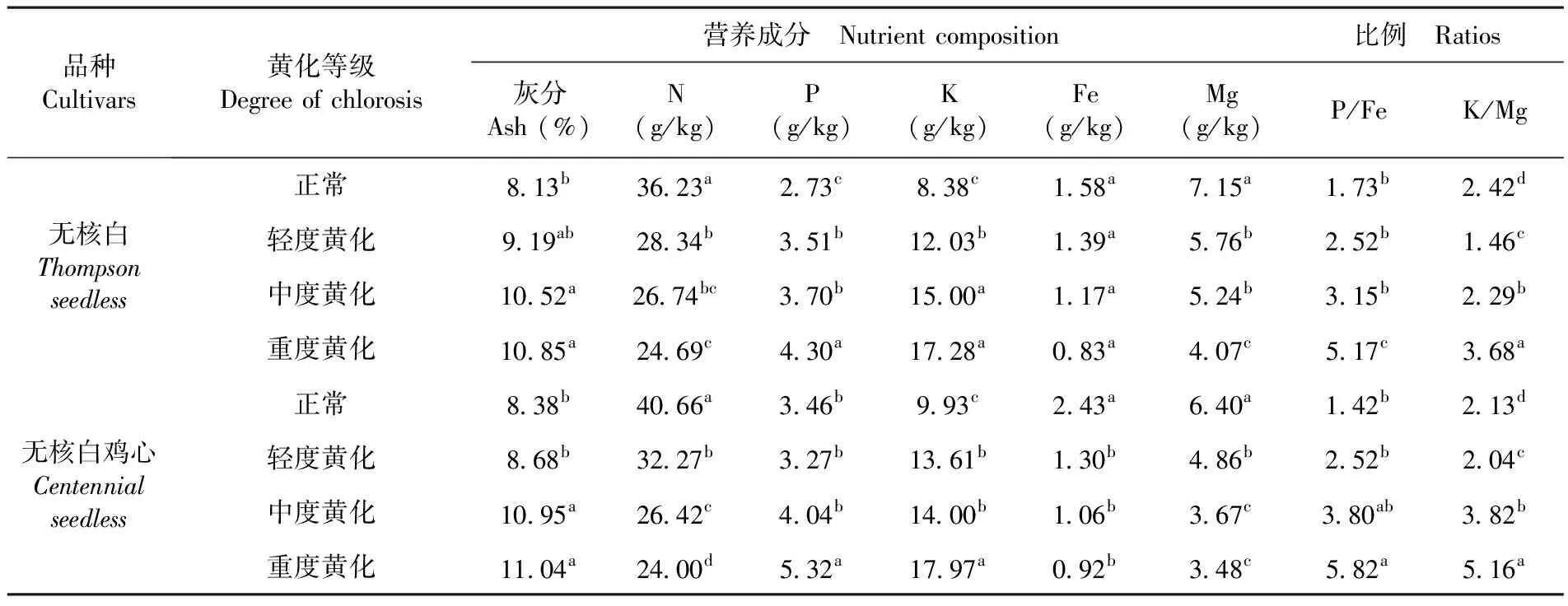
表5 不同黄化程度下葡萄叶片矿质营养变化Table 5 Effects of different degrees of Chlorosis on mineral nutrition in grape leaves
3 讨 论
3.1 不同黄化程度对葡萄叶片叶绿素含量的影响
叶绿素是植物进行光合作用的主要色素,它对光合作用中光吸收起到关键地位[12]。研究发现,正常叶SPAD值和叶绿素含量远远高于黄化叶的叶绿素含量,无核白正常叶SPAD值和叶绿素a+b含量分别是重度黄化叶的10.56倍和5.70倍。关于这方面李春霞等[13]研究不同黄化等级香樟叶绿素含量变化规律以及黎秀丽等[14]研究库尔勒香梨黄化叶片叶绿素含量时也得出了同样的结论。随着葡萄叶片黄化程度的加重,会致使葡萄叶片叶绿素含量减少,从而影响了葡萄植株的生长发育。
3.2 不同黄化程度对葡萄茎、叶片形态与解剖特性的影响
植物茎、叶片的形态在环境的变化中具有较高的敏感性和可塑造性,其解剖组织结构的特征变化能表现出植物对环境的适应能力[15]。研究发现,两种葡萄发生重度黄化时,叶片栅栏组织厚度与海绵组织厚度分别只有正常叶的84.1%、68.1%和44.2%、72.2%,达到极显著差异。关于这一点张朝红等[16]研究酥梨的叶片厚度、栅栏组织和海绵组织厚度等,发现随着黄化程度的加深而变薄,细胞排列疏松,叶绿体数量减少,酥梨重度黄化时叶片栅栏组织为正常叶的61.7%。此外,研究还发现在形态解剖上黄化叶较正常叶的叶片栅栏组织和海绵组织排列疏松,细胞外形为不规则块状甚至断裂,叶绿体数量极少,整个叶肉组织变薄。关于这一点贾晓红等[17]对土沉香进行9种缺素处理观察其叶片表型特征及叶片解剖结构的差异,发现缺硼对叶片解剖结构造成一定的变异,细胞排列较为疏松,形状变化各异,这与研究结论一致。因此,不同黄化等级之间两种葡萄叶片解剖比较研究表明,葡萄外部形态发生黄化,均由叶片组织结构及内部细胞内部细胞变化而控制的[18]。
3.3 不同黄化程度对葡萄叶片矿质营养含量的影响
矿质元素是植物生长的必需元素,若植物缺少此类元素易导致植株叶片黄化[19]、生长势衰弱甚至影响植株地上部的产量及果实品质[20]。研究发现,两种葡萄品种黄化叶P、K含量均高于正常叶。关于这方面,Ranferi等[5]对不同黄化程度墨西哥酸橙叶片进行矿质元素分析时,发现黄化叶P、K含量均超于正常叶矿质元素含量值,这与本研究结果一致。原因可能是根部细胞矿质元素通过土壤溶液进行交换吸附,即H+通过根部内细胞质膜H+-ATP酶进行离子交换,利于K+的交换和吸收[21,22]。K+的积累也导致了无核白鸡心K/Mg比值较高(2.13),且重度黄化值达5.16。而K+与Mg2+相比较使碳水化合物减少,降低了K+从叶片到韧皮部血管的运动,甚至在黄化叶片时停止,从而也减少了生物量的合成[23]。与此同时,叶优良等[24]研究苹果、梨、桃叶片营养含量的变化,也发现叶片全P含量呈升高趋势,认为可能是叶片P含量增高,导致叶片中P/Fe比失调,从而影响铁的吸收,使叶片失绿黄化。在进行葡萄黄化矫治时需要注意合理考虑矿质元素的平衡施加。
4 结 论
与正常叶相比,黄化叶SPAD值、叶绿素a+b等含量显著低于正常叶;进一步分析发现无核白正常叶N、Fe、Mg含量分别是黄化叶的1.47、1.90和1.76倍,从叶片解剖结构上发现黄化叶较正常叶的叶片栅栏组织和海绵组织排列疏松,细胞外形为不规则块状甚至断裂,叶绿体数量极少,整个叶肉组织变薄。葡萄生理性黄化从枝叶表型特征到微观解剖结构均有明显差异,叶片质量、叶绿素含量、茎木质部厚度、叶栅海比、叶灰分中P、K含量等指标的变化对于判断葡萄生理性黄化状况具有重要的参考价值。
