兔源巴氏杆菌分离与鉴定
2018-10-23韩猛立张星星吴桐忠郭强强黄新钟发刚
韩猛立,张星星,吴桐忠,郭强强,黄新,钟发刚
(新疆生产建设兵团动物疾病防控重点实验室/新疆农垦科学院畜牧兽医研究所,新疆石河子 832003)
0 引 言
【研究意义】 兔巴氏杆菌病(Rabbitpasteurellosis)是由兔多杀性巴氏杆菌(Pasteurelamultocida)引起兔的一种急性、烈性、高度接触性传染病,呈多形性、散发性或地方流行性传染病,又称为兔出血性败血症[1-2];该病是家兔的常见疾病之一,主要危害断奶到成年兔(多发于9周龄至6月龄),临床上表现为严重的呼吸道病变、中耳炎、结膜炎、子宫积脓、睾丸炎等[3];一般无季节性发病特征,在气温骤变及多雨季节发病较多;通常呈隐性感染,在感染群中,随着兔年龄的增大,多杀性巴氏杆菌在兔群中的污染率有增加的趋势;该病发病率高,传播途径多,传播速度快,发病后若治疗措施不及时可引起兔大批死亡,若治疗措施及时可明显降低死亡率,但也会引起兔生长迟缓及治疗费用增加等,该病已成为困扰我国养兔业健康发展的主要细菌性疾病之一[4-6]。【前人研究进展】 多杀性巴氏杆菌能够引起禽霍乱、牛出血性败血症、兔巴氏杆菌病、羊出血性败血症、猪肺疫和猪萎缩性鼻炎,而人可以通过被狗、猫等宠物撕咬或抓伤的途径感染巴氏杆菌,并引起人的局部感染、炎症或败血症,病情严重时甚至造成死亡[7]。我国科研人员在牛、猪、禽类、兔巴氏杆菌[3,8-12]的分离鉴定、PCR检测方法与血清分型、耐药性、致病性、免疫原型研究方面做了大量的研究工作,丰富了我国不同种动物巴氏杆菌病研究的深度和广度,对促进畜禽养殖业健康发展、控制巴氏杆菌对畜牧养殖业造成的危害、减少养殖场(户)的经济损失做出了重大贡献。【本研究切入点】 姜鸿程等[13]2002年对哈密地区发生一起兔巴氏杆菌与大肠杆菌混合感染进行报道。有禽源、奶牛源、羊源、牦牛源巴氏杆菌的相关研究[14-18],新疆地区关于兔巴氏杆菌的相关研究鲜见报道。【拟解决的关键问题】研究对引起石河子地区不同养兔合作社或专业养殖户兔死亡的原因进行探究,确定其主要病原菌为多杀性巴氏杆菌,并伴有大肠杆菌混合感染,对分离菌株的耐药性进行分析研究。掌握巴氏杆菌感染不同种动物的临床特点、致病特征、主要血清型、敏感药物、序列特点等,为制定动物源巴氏杆菌病综合防控措施提供技术支撑。
1 材料与方法
1.1 材 料
1.1.1 病料
采集和送检病料主要来自第八师石河子市辖区的145团、133团、121团、149团养兔合作社或养兔专业户,主要饲养法系獭兔、哈白、新西兰、伊普吕、宠物兔等。发病主要集中4、5月,病兔多为50~75 d龄,主要临床症状为厌食、打喷嚏、咳嗽、流脓性鼻漏的呼吸道型;部分兔用前爪抓擦鼻孔,临死前出现体温下降,全身抽搐,并伴有水样腹泻;病程一般为3~5 d,发病率45%~65%,病死率40%以上,多为急性死亡。对送检的病死兔剖解可见肺脏充血、肝变较严重,呈大理石样花纹,有纤维素性胸膜炎变化,有化脓灶;肝脏水肿、胆囊肿大、边缘顿圆、质脆,肠系膜淋巴结明显水肿出血;肠道广泛性出血。
剖解濒死期或病死兔,无菌采集肺脏、肝脏、脾脏、淋巴结等病料,4℃冷藏备用。标准牛多杀性巴氏杆菌(CVCC393)购自中监所(简称:标准株)。
1.1.2 培养基及试剂
5%绵羊血液琼脂平板培养基、普通琼脂平板培养基、麦康凯琼脂培养基、营养肉汤、脑心浸液(BHI);TaqDNA聚合酶 、dNTP、DL2000 DNA Marker购自宝生物工程(大连)有限公司;快速革兰氏染色液、瑞氏-姬姆萨染色液购自珠海贝索生物技术有限公司。临床常用新药敏纸片(30种)购自杭州滨和微生物试剂有限公司。法国生物梅里埃VITEK 2 COMPACT全自动微生物生化鉴定系统及其配套细菌生化鉴定卡;昆明系小鼠购自石河子大学动物实验中心。
1.1.3 引物合成
参照Townsend等[19]建立了多杀性巴氏杆菌PCR鉴别和荚膜血清分型方法,分别设计引物扩增多杀性巴氏杆菌种特异性基因KMT1,扩增荚膜血清A、B、D、E、F分型特异性基因hyaD-hyaC、bcbD、dcbF、ecbJ、fcbD,引物由上海生工生物工程有限公司合成。引物序列及扩增片段大小。表1
表1 巴氏杆菌鉴定及分型引物序列
Fig.1 Primer sequences and sizes used in experiments

血清型Capsular serotype引物Primers序列Sequences(5’-3’)大小Sizes(bp)Pm鉴定Identification of PmKmt-1Pm-FATCCGCTATTTACCCAGTGGPm-RGCTGTAAACGAACTCGCCAC460A型Pm鉴定Identification of A type PmhyaD-hyaCPmA-FTGCCAAAATCGCAGTCAGPmA-RTTGCCATCATTGTCAGTG1 046B型Pm鉴定Identification of B type PmbcbDPmB-FGCCCGAGAGTTTCAATCCPmB-RCATTTATCCAAGCTCCACC760D型Pm鉴定Identification of D type PmdcbFPmD-FTTACAAAAGAAAGACTAGGAGCCCPmD-RCATCTACCCACTCAACCATATCAG657E型Pm鉴定Identification of E type PmecbJPmE-FTCCGCAGAAAATTATTGACTCPmE-RGCTTGCTGCTTGATTTTGTC511F型Pm鉴定Identification of F type PmfcbDPmF-FAATCGGAGAACGCAGAAATCAGPmF-RTTCCGCCGTCAATTACTCTG851
1.2 方 法
1.2.1 染色镜检
将病料组织如肺脏、肝脏、脾脏、肠内容物涂片或触片,分别进行瑞氏染色和革兰氏染色、镜检、观察其形态特征。
1.2.2 分离培养
将无菌采集的病兔肺脏、肝脏、脾脏、淋巴结分别接种于脑心浸液置于37℃恒温培养18~24 h后,接种于血液琼脂平板、普通琼脂平板、麦康凯琼脂平板37℃恒温培养16~18 h,观察在不同培养基上的生长情况、菌落形态以及溶血情况。挑取典型菌落,分别进行单菌落涂片革兰氏染色镜检、再次接种于5%绵羊血琼脂平板进行分离纯化、观察其溶血性。
1.2.3 生化鉴定
分离菌株的生化鉴定应用常规生化鉴定与全自动微生物生化鉴定系统相结合进行。常规细菌生化鉴定管购买自杭州滨河微生物试剂有限公司,革兰氏阴性细菌鉴定卡购买自法国生物梅里埃公司。
1.2.4 动物试验
10只普通健康小白鼠(体重约在20 g左右),随即分为试验组和对照组,每组5只。将经生化鉴定的分离菌株挑单个菌落37℃过夜培养,用灭菌PBS悬浮菌体;试验组小白鼠按0.2 mL/只(6×108cfu/mL)剂量腹腔注射,对照组注射等量灭菌PBS。隔离饲养,同时观察并记录小鼠状态、发病及死亡情况。
1.2.5 药敏试验
按照常规方法进行,采用纸片琼脂扩散法(K-B法)进行药物敏感性试验,使用杭州滨河微生物试剂有限公司生产的临床常用新药敏纸片(30种),观察实验结果,并测量抑菌圈直径,按照配套说明书判定结果,以牛多杀性巴氏杆菌CVCC3933作为质控菌株。
1.2.6 PCR鉴定及分型
将分离菌株接种于营养肉汤37℃过夜培养,用碱裂解法提取细菌基因组DNA作为PCR模板;PCR扩增引物详见1.1.4;反应体系:25 μL:10 × Buffer 2.5 μL,2.5 mmol/L dNTPs 2.0 μL,上下游引物各1.0 μL(20 μmol/L),TaqDNA聚合酶 0.5 μL(5 U/μL),模板DNA 2.0 μL,ddH2O 16.0 μL;反应条件:95℃ 预变性 5 min;95℃ 变性 30 s、56℃ 退火 30 s、72℃ 延伸35 s,30个循环;72℃ 5 min。PCR产物保存于4℃备用。取5 μL PCR产物在10 g/L琼脂糖凝胶电泳检测。
2 结果与分析
2.1 细菌形态
病兔肺脏、肝脏、脾脏和肠内容物涂片革兰氏染色镜检,视野可见大量呈粉红色(革兰氏阴性)的小杆菌;瑞特氏染色观察到两极着色的短杆菌,偶见有着色均匀的短小杆菌。
2.2 细菌分离培养
将无菌采集的病料接入营养肉汤中培养72 h后,肉眼可见试管底部出现粘稠,晃动呈拉丝状;分离菌株在普通琼脂培养基上贫瘠,在麦康凯上(除其中一份肠系膜淋巴结病料,生长出粉红圆形菌落外)均不生长;在5%绵羊血琼脂平板上培养18 h后,可见表面光滑湿润、灰白色、圆形微隆起、边缘整齐的露珠样菌落,无溶血现象;革兰氏染色为阴性短小杆菌。
2.3 生化鉴定
对分离菌株应用购买自天和微生物试剂有限公司的细菌生化鉴定管和全自动微生物鉴定仪鉴定,疑似为多杀性巴氏杆菌(Pasteurellamultocida,Pm)。研究表明,全自动微生物鉴定系统鉴定结果提示为巴氏杆菌(可信度介于91%~99%);其中CVCC393为标准菌株,PmXJ12104-x为实验室保存的牦牛巴氏杆菌分离株,PmXJ08145-xby、PmXJ08132-f、PmXJ08132-x、PmXJ08121-f、PmXJ08149-xby为此次分离的兔源巴氏杆菌。分离株与标准菌株生化鉴定结果基本一致。肠系膜淋巴上分离菌株鉴定为大肠杆菌。表2
表2 分离株生化试验结果
Table 2 The result of biochemistry to experiment

菌株StrainCVCC393PmXJ12104-xPmXJ08145-xbyPmXJ08132-fPmXJ08132-xPmXJ08121-fPmXJ08149-xby葡萄糖 GLU+++++++靛基质 IMD+++++++甘露醇 MAN+++-+++麦芽糖 MAL---+-+-山梨醇 SOR+++++++乳糖 LAC-------蔗糖 SAC+++++++果糖 FRU+++++++甲基红 MR-------二乙酰 VP-------柠檬酸CIT-------尿素酶 URE-------硫化氢 H2S-------硝酸盐 CIT++++--+触酶 CAT+++++++三糖铁 TSI+++++++
注:+(阳性);-(阴性)
Note: +(positive);-(Negative)
2.4 动物试验
试验组小白鼠接种注射菌液后4 h,出现精神不振,食欲下降;14 h后,注射Pm的小鼠有1只死亡;36 h以内小鼠全部死亡;空白对照组小鼠全部存活。剖解可见心外膜有出血点、心包和胸腔呈现不同程度浆液性纤维素渗出物,肺出血严重、肝脏、脾脏、淋巴结肿大;腹腔积液、肠粘膜出血。选取心血、肺脏、肝脏、脾脏等组织病料涂片镜检,革兰氏染色可见阴性小杆菌,瑞氏染色可见两级着色显著的短杆菌,判定为巴氏杆菌感染。
2.5 分离菌株耐药率
对分离鉴定获得的14株兔巴氏杆菌(进一步鉴定明确为PmXJ08145-xby、PmXJ08132-f、PmXJ08132-x、PmXJ08121-f、PmXJ08149-xby5株菌),按照CLSI标准测定其对30种临床常用新药敏纸片的敏感性,结果显示,14株巴氏杆菌均表现出不同程度的多重耐药,对青霉素、阿莫西林、链霉素、四环素、阿莫西林、庆大霉素、克林霉素、恩诺沙星等临床常用抗生素严重耐药,较为敏感的抗生素是第三代头孢菌素类如头孢哌酮、头孢噻肟、头孢曲松、头孢他啶、头孢吡肟,部分喹诺酮类如氧氟沙星、左氧氟沙星以及氟苯尼考。按照“高敏菌株数 + 中敏菌株数 = 敏感菌株数”和“低敏率=耐药率”,确定分离菌株的耐药率。表3
表3 14株兔源多杀性巴氏杆菌分离菌株的药敏试验结果
Table 3 Susceptibility of 14 strains of Pasteurella multocida isolates

药敏片类别Drug sensitive tablets敏感(S)Sensitive中介(I)Intermediary耐药(R)Resistance耐药率(%)Resistant rate苯唑西林 Oxacillin041071.43(10/14)青霉素G Penicillin G011392.86(13/14)阿莫西林 Amoxicillin0014100.00(14/14)阿奇霉素 Azithromycin47321.43(3/14)氟苯尼考 Florfenicol9417.14(1/14)氨苄西林 Ampicillin021285.71(12/14)多西环素 Doxycyclinum031178.57(11/14)克林霉素 Clindamycin0014100.00(14/14)氯霉素 Chloramphenicol05964.29(9/14)四环素 Tetracycline011392.86(13/14)左氧氟沙星 Levofloxacin5817.14(1/14)诺氟沙星 Norfloxacin08642.86(6/14)恩诺沙星 Enrofloxacin57214.29(2/14)环丙沙星 Ciprofloxacin36535.71(5/14)多粘菌素B Polymyxin B56321.43(3/14)复方新诺明 Cotrimoxazole021285.71(12/14)哌拉西林 Piperacillin011392.86(13/14)头孢唑啉 Cefazolin65321.43(3/14)头孢噻吩 Cefalotin53642.86(6/14)头孢呋辛 Cefuroxime66214.29(2/14)头孢哌酮 Cefoperazone11300.00(0/14)头孢噻肟 Cefotaxime12200.00(0/14)头孢曲松 Ceftriaxone10400.00(0/14)头孢他啶 Ceftazidime13100.00(0/14)头孢吡肟 Cefepime11300.00(0/14)头孢西叮 Cefoxitin38321.43(3/14)氧氟沙星 Ofloxacin6717.14(1/14)链霉素 Streptomycin011392.86(13/14)卡那霉素 kanamycin14964.29(9/14)庆大霉素 Gentamicin031178.57(11/14)
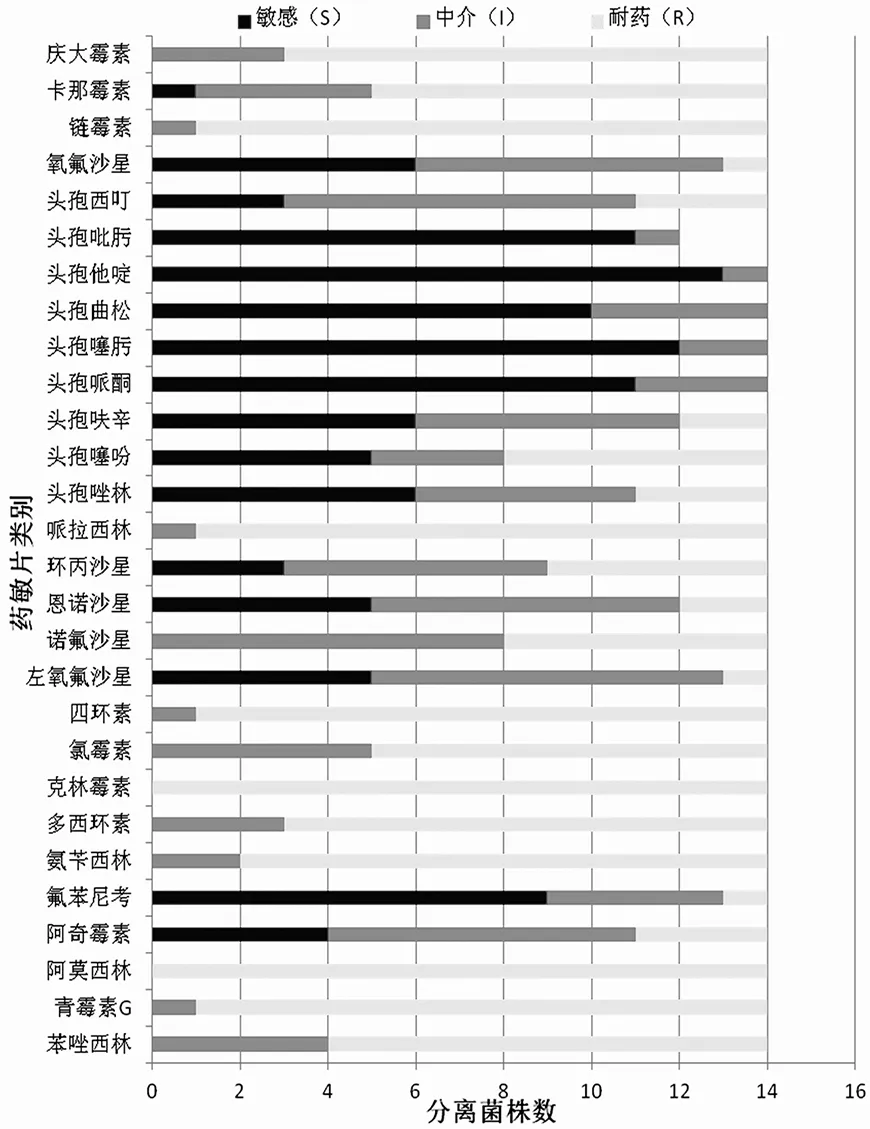
图1 14株兔源多杀性巴氏杆菌分离菌株的药敏试验
Fig.1 Susceptibility of 14 strains of Pasteurella multocida isolates
2.6 PCR鉴定及分型
以巴氏杆菌标准菌株CVCC393和实验室分离保存的牦牛巴氏杆菌PmXJ12104-x分离株为阳性对照,以实验室分离获得14株菌的DNA为模板,分别扩增Pm的Kmt-1基因,研究表明,除阴性对照外均扩增出大小约460 bp的目的条带与预期结果一致。将分离菌株的Kmt-1基因片段测序后运用BLAST与GenBank数据库中多杀性巴氏杆菌KMT-1基因序列比对同源性达99%以上。
根据发病场区、养殖品种、临床症状、生化鉴定,结合荚膜血清分型将分离的14株巴氏杆菌明确为PmXJ08145-xby、PmXJ08132-f、PmXJ08132-x、PmXJ08121-f、PmXJ08149-xby 5株菌,应用荚膜血清分型PCR鉴定为A型多杀性巴氏杆菌。 对扩增获得的血清特异性基因片段测序,运用BLAST搜索比对结果显示与Genbank 数据库中A型基因同源性介于97%~99%。图1

M:DNA分子质量标准;1.阴性对照;2.标准多杀性巴氏杆菌CVCC393;3.牦牛巴氏杆菌分离株PmXJ12104-x;4-17:兔源临床分离菌株
M:DL2000 Marker; 1.Negative control; 2.StandardPasteurellamultocidaCVCC393; 3.Pasteurellamultocidaisolate PmXJ12104-x of Yak; 4-17.Rabbits source clinical isolates
图2 多杀性巴氏杆菌PCR鉴定
Fig.2 PCR identification of Pasteurella multocida

M:DNA分子质量标准;1-5:兔源临床分离株
M:DL2000 Marker; 1-5:.Rabbits source clinical isolates
图3 分离菌株荚膜血清型PCR鉴定
Fig.3 Isolation Strains capsular serotype PCR identification
3 讨 论
随着兵团农业产业化结构调整步伐的逐步推进,兵团第八师石河子地区畜牧业结构呈现出多元化发展,在传统的以奶牛、细毛羊养殖为优势的基础上;为了更好的适应市场需求,拓宽农牧民多元化增收途径,以肉羊、肉牛、生猪、蛋鸡和肉兔养殖。家兔多杀性巴氏杆菌病是引起断奶到成年兔断奶到死亡最主要的细菌性传染病,不同国家的主要流行菌株不同,不同血清型巴氏杆菌之间没有或仅有较少的交叉保护性[20]。
多杀性巴氏杆菌是一种普遍存在于多种动物体内的革兰氏阴性短杆菌,能在部分健康动物的口腔、鼻腔、扁桃体和上呼吸道中定植,属于条件致病菌。根据荚膜抗原的不同分为5种血清型,分别是 A、B、D、E和F型[21],血清型的流行情况在不同宿主间有一定差异[22]。当前在我国猪群中主要流行的是A型、B型(引起猪肺疫)和D型(猪传染性萎缩性鼻炎)[23];牛群中主要流行A型(牛出血性败血症)[24];羊源巴氏杆菌病以病例报道居多,分型鉴定相对较少,新疆地区有分离到A型的相关报道[17];禽类以A型(禽霍乱)为主,B 、D和F型也有报道[23];兔源以A型为主,但也存在D型和F型[10,25]。2016年4月~2017年10月间对石河子地区132团首先出现4月龄左右仔兔突然发病死亡,随即周边团场或与其有来往的养殖合作社和养殖专业户发生了类似的疫情。经询问饲养员和兽医,结合发病情况、临床症状及剖解变化,类似于巴氏杆菌病;此次发病表现出发病率和死亡率均较高的特点,且剖解以肺部病变较为严重,部分呈现出大肠杆菌性腹泻混合感染;给处于上升期的石河子地区养兔业造成巨大的经济损失。研究团队利用现有的巴氏杆菌研究平台,对不同时期的发病样品经实验室细菌分离鉴定出14株巴氏杆菌,后进一步明确为5株,分离菌株生化鉴定结果与标准菌株生化特性基本一致,将分离菌株进行小鼠攻毒试验表现出高致病性,并分离出相同的细菌,初步鉴定为多杀性巴氏杆菌感染;分离菌株对临床常用的药物均具有不同程度的耐药性,对第三代头孢菌素和部分喹诺酮累药物表现出敏感性,且敏感趋势大致相同;在培养特性、生化特点、药物敏感性及毒力上存在一定的差异;利用PCR技术最终确认分离的菌株为荚膜血清A型多杀性巴氏杆菌,且具有较强的致病性,对第三代头孢菌素类、部分喹诺酮类药物和氟苯尼考敏感。
多杀性巴氏杆菌广泛存在于正常动物的上呼吸道、扁桃体等器官和组织中,因而动物群体中多杀性巴氏杆菌的带菌率与动物群体是否发生巴氏杆菌病并无直接关系。一般认为动物在发病前已经带菌,当各种诱因如气温变化、应激等使畜禽机体抵抗力降低时,病原菌得以快速繁殖,随即侵入体内,经淋巴液而入血液,继而发生内源性感染,促进动物机体表现出特定的临床症状,严重者导致死亡。研究采集病死兔的脏器组织,运用传统的生物学分析方法将纯化后的细菌依据染色形态、生化试验等特征进行分类,由于传统生物学细菌鉴定方法稳定性和可靠性受到培养条件的影响而存在差异;分子生物学方法不受细菌来源地环境及培养条件的影响[26]。研究采用传统细菌分离鉴定与分析生物学相结合的方法,应用全自动微生物鉴定系统与传统生化试验相作证;以实验室购买的标准菌株和分离菌株作为阳性对照,参考目前普遍认可的由Townsend等[19,27]建立的分子生物学方法对多杀性巴氏杆菌进行鉴定和分型,二者的符合率一致;相对于传统的表型鉴定方法,基因型鉴定提高了检测和分类的稳定性,同时提高了揭示其种间遗传关系的检测速率。
多杀性巴氏杆菌各血清型菌株的流行性存在较大差异,具有明显的地方性特征;致病性主要与宿主和细菌毒力相关,毒力基因在细菌致病过程中具有重要意义,很多被证实与病原菌致病密切相关的结合、转运、粘附、定殖、合成、入侵等过程均有不同基因编码的对应蛋白(酶)介导,机体发病是宿主与致病菌株之间相互作用的结果。多杀性巴氏杆菌毒力基因较多,与之密切相关的毒力基因在不同菌株中分布存在一定的差异。研究揭示了荚膜血清A型多杀性巴氏杆菌是引起石河子地区兔急性死亡的主要病原菌,对其毒力基因进行相关研究是本实验即将开展的工作。
兔多杀性巴氏杆菌对于任何品种兔子均具有相同的易感性,且无性别差异,但不同年龄兔只的易感性存在显著差异。兔多杀性巴氏杆菌属条件性致病菌,当外界条件发生突然改变如更换饲养和饲养员、寄生虫感染、温度骤变、圈舍通风不良、兔抵抗力降低时,该病原菌趁机侵入人体内,引发内源性感染或突然发病。因此应做好日常管理和预防工作,大量文献报道发现不同地区分离株药敏试验结果大相径庭,可能不同地区及人员与用药习惯和分离菌株的差异有关,首选药敏试验结果的药物进行治疗,同时选择不同敏感药物交替使用、联合用药方能起到较好的效果;兔巴氏杆菌商品疫苗为荚膜血清A型灭活疫苗,因此制定完善的免疫程序、应用市售商品化疫苗防控该病是首选方案;同时必须对本地流行的多杀性巴氏杆菌血清型加以监测,根据当地监测结果才能更好地指导该病的防治。
4 结 论
通过常规细菌分离获得14株病原菌,鉴定为巴氏杆菌;应用分子生物学方法鉴定为荚膜血清A型多杀性巴氏杆菌,结合考虑发病场(户)、是否分离自同一样品、生化试验、序列比对等明确为5株病原菌,分别命名为PmXJ08145-xby、PmXJ08132-f、PmXJ08132-x、PmXJ08121-f、PmXJ08149-xby5;按照CLSI标准测定其对30种临床常用新药敏纸片的敏感性,结果显示14株临床分离巴氏杆菌均表现出不同程度的多重耐药,对青霉素、阿莫西林、链霉素、四环素、阿莫西林、庆大霉素、克林霉素、恩诺沙星等临床常用抗生素严重耐药的抗生素是类如对头孢哌酮、头孢噻肟、头孢曲松、头孢他啶、头孢吡肟等第三代头孢菌素,部分喹诺酮类如氧氟沙星、左氧氟沙星以及氟苯尼考等较为敏感。
