胁迫条件及脂肪酸对巴氏醋杆菌生理特性的影响
2018-10-23张建才葛男
邹 静,孟 军,张建才,葛男,李 斌
(河北科技师范学院食品科技学院,河北昌黎 066600)
目前,工业用醋酸菌主要来源于醋杆菌属(Acetobacter)、葡糖杆菌属(Gluconobacter) 和葡糖醋杆菌属(Gluconoacetobacter) 3个菌属[1-2]。醋酸菌在实际生产过程中会面临多种胁迫因素,如发酵初期来自乙醇的高浓度胁迫、发酵后期醋酸自身的胁迫和夏季高温的胁迫等。这些胁迫会抑制醋酸菌的生长、代谢及生理功能,而醋酸菌应对胁迫环境的应答机制是提高醋酸菌生产能力的关键,也是目前醋酸菌的研究热点之一。
研究表明,醋酸菌的耐胁迫应答分子机制主要包括以下3个方面:①由多种脱氢酶参与的乙醇氧化机制。这些酶主要包括乙醛脱氢酶(由ALDH基因编码)、乙醇脱氢酶(由ADH基因编码)[3-4]。P Chinnawirotpisan等人[5]经过诱变得到1株ADH活性缺失菌株,与亲本相比,该菌株无法利用乙醇生产醋酸,同时醋酸耐受性缺失。②由乙酰辅酶A转移酶AarC参与的醋酸过氧化机制。通过该酶的作用,乙酸被氧化并最终通过乙醛酸代谢途径完成转变[6]。③乙酸泵出机制。该泵出机制是通过与ATP结合的转运蛋白ABC(ATP-binding cassette) 来实现的,而ABC转运机制是一种耗能的主动转运机制[7]。④通用抗逆机制包括抗逆蛋白及分子伴侣(GrpE,DnaJ,DnaK)[8]。除此之外,有报道称巴氏醋杆菌(A.pasteurianus)细胞膜的流动性与乙酸抗性有关,随着乙酸体积分数的升高,细胞膜的流动性增加[9]。有些巴氏醋杆菌巴氏醋杆菌还会通过改变荚膜多糖的含量来应对可逆环境。但是,上述这些报道都是独立的,而巴氏醋杆菌的耐性机理应是一个有机整体,因此在面对胁迫条件时,其生理变化也是其抗胁迫环境的方法之一。
微生物可以通过改变生理状态来应对逆性环境。Kanchanarach W等人[10]报道称细胞膜多糖形成能力可以直接体现巴氏醋杆菌耐性能力,而酵母菌会通过改变细胞膜流动性[11]、调整细胞膜脂肪酸的组成等手段来应对逆性环境[12]。以实验室保藏的生产用巴氏醋杆菌为出发菌株,通过改变胁迫条件,确定巴氏醋杆菌在应对胁迫环境时的生理变化。然后在含有2%乙醇条件下,添加不同外源脂肪酸,确定逆性条件下不同脂肪酸对巴氏醋杆菌的保护能力。
1 材料与方法
1.1 试验所用微生物
巴氏醋杆菌(A.pasteurianus) 7015,实验室保藏菌种。
1.2 试验所用的培养基
1.2.1 种子培养基
葡萄糖20 g/L,酵母粉10 g/L,蛋白胨20 g/L,自然pH值,于121℃条件下灭菌20 min。
1.2.2 不同胁迫条件培养基
不同胁迫物质,葡萄糖20 g/L,酵母粉10 g/L,蛋白胨20 g/L,MgSO41 g/L,自然pH值,于121℃条件下灭菌20 min。
培养基中胁迫成分和胁迫体积分数见表1。

表1 培养基中胁迫成分和胁迫体积分数
1.2.3 不同脂肪酸培养基
酵母粉10 g/L,蛋白胨20 g/L,MgSO41 g/L,外源脂肪酸0.2 g/L(分别为棕榈酸、硬脂酸、油酸、亚油酸),自然pH值,于121℃条件下灭菌20 min后,加入终体积分数为2%(V/V)的无水乙醇,对照为未加胁迫物质的培养基。
1.3 试验方法
1.3.1 细胞多糖的测定
采用苯酚-硫酸法测定细胞多糖含量[13]。用50 mmol/L磷酸缓冲溶液(pH值5.8) 洗涤菌体2次后得到菌体细胞悬液。将50 mL浓硫酸缓缓加入10 mL去离子水中,冷却至室温后加入0.6 g苯酚晶体,搅拌溶解配成显色液。取1.00 mL菌悬液于试管中,加入5.00 mL显色液振荡均匀,置于沸水浴中保温30 min后转入冷水浴中冷却至室温,取出于波长490 nm处测定其OD值。每个样品平行测定3次。
1.3.2 细胞膜流动性测定
细胞膜侧向扩散速率和微黏度的测定按照李宝坤等人的方法[14],利用荧光偏振法测定细胞膜流动性。荧光偏振(P) 和细胞的平均微黏度(η) 的计算公式如下:

式中:IVV和IVH——激发光为垂直方向的偏振光,而发射光分别为垂直和水平方向的偏振光时测得的荧光强度;
G——光栅矫正因子(G=IHV/IHH);
IHV和IHH——激发光为水平方向的偏振光,而发射光分别为垂直和水平方向的偏振光时测得的荧光强度。
P和η值越大表明细胞膜流动性越小。
1.3.3 细胞内膜透性的测定
细胞内膜透性的测定参照吴重德等人[15]的方法。离心(6 000×g,10 min,4℃)收获不同体积分数乙醇胁迫条件下对数生长末期的菌体,用10 mmol/L磷酸缓冲溶液(pH值7.0)离心洗涤2次后重悬于相同缓冲溶液中并调节菌体浓度为OD600=1.0,取1 mL菌悬液添加ONPG至终质量浓度为100 μg/mL,保持70 min后用分光光度计测定于波长420 nm处的吸光度。
1.3.4 H+-ATPase活性的测定
质膜的制备参照李中超[16]的方法。醋酸菌培养到对数中后期时,取100 mL菌悬液离心(10 000×g,10 min,),用0.9%NaCl溶液冲洗2次,去除杂质,将菌体重悬于2 mL的NaCl溶液中,转移至2 mL离心管中,离心(10 000×g,5 min,4℃) 1次,用移液枪冲洗除尽上层杂质,再次重悬于0.9%的NaCl溶液中,离心(12 000×g,2 min,4℃) 得到干净菌体。将离心收获的菌体,悬浮于Tris-HCl缓冲液(50 mmol/L Tris, 10 mmol/L MgCl2, 0.05%Triton X-100,pH值7.0) 中,得到OD600=2.0的菌悬液。将其置于-20℃条件下冷冻24 h,在测定质膜H+-ATPase活性之前,将冻结的样品于30℃条件下快速解冻。
H+-ATPase活性测定参照亓正良等人[17]的方法。0.1 mLATP(30 mmol/L) +0.4 mL反应液(3.75 mmol/L MgCl2,100 mmol/L KCl,100 mmol/L NaCl,50 mmol/L TIis-HCl,pH值7.2) 置于试管中,于30℃条件下保温5 min,加入透性细胞悬浮液0.5 mL,再保温30 min,加入0.2mL三氯乙酸(20%,W/V)终止反应,6 000×g离心10 min,取上清液0.5 mL加入2.5 mL硫酸亚铁-钼酸铵试剂。反应10 min,颜色变蓝后,于波长660 nm处测定吸光度。根据标准曲线求出Pi的含量。酶的活性单位为μmol(Pi)/g(protein)·min。
蛋白浓度的测定采用考马斯亮蓝法,用蛋白浓度定量试剂盒测定,以牛血清蛋白为标准蛋白。1.3.5 胞内ATP含量的测定
采用TCA法提取细胞中的ATP。将0.5 mL菌液与等体积预冷的0.03 g/mL的TCA混合,振摇3 min后加入20 mL的50 mmol/L Tris-HCl缓冲溶液(pH值7.4)加以稀释,以终止其反应。
胞内ATP含量采用ATP含量试剂盒进行测定。
2 结果与分析
2.1 胁迫条件对巴氏醋杆菌生理特性的影响
2.1.1 不同胁迫条件对细胞多糖含量的影响
有关细胞多糖与醋酸菌耐受性之间的关系目前有2种截然不同的观点。Kanchanarach W等人[10]研究发现巴氏醋杆菌在醋酸发酵后期和醋酸过氧化阶段,细胞多糖的含量逐渐增加,因此认为细胞多糖含量与细胞耐酸能力相关。而Andrés-Barrao C等人[18]发现,随着醋酸发酵的进行,巴氏醋杆菌LMG 1262T的多糖含量是逐渐减少的,这将有助于乙醇快速进入胞内代谢并将产物快速排出至胞外。而固态法生产食醋时,进行醋酸发酵时乙醇的初始体积分数为4%~5%,发酵终止时乙酸的体积分数也为4%~5%,因此通过添加乙醇、乙酸来模拟醋酸菌发酵前期和后期环境,并通过改变乙酸和乙醇的体积分数来确定不同胁迫条件和不同胁迫剂量对该巴氏醋杆菌的影响。
不同胁迫条件对巴氏醋杆菌7015细胞多糖含量的影响见图1。
从图1可以看出,在正常条件下该株巴氏醋杆菌荚膜多糖的合成量占细胞干质量的31.25%,而在乙醇和乙酸环境中,该株菌的细胞多糖含量是随着胁迫物质含量的增加而逐渐减少的。与相同体积分数的乙醇相比,该株巴氏醋杆菌在应对乙酸逆性条件时,细胞荚膜多糖含量减少幅度更大。例如,当乙醇体积分数达到5%时,细胞多糖含量为19.85%,而相同体积分数的乙酸胁迫条件下,细胞多糖仅为1.92%。因此,试验选用的巴氏醋杆菌7015是通过降低细胞多糖的含量来应对胁迫环境的,且乙酸对细胞多糖含量影响大于相同体积分数乙醇的影响。
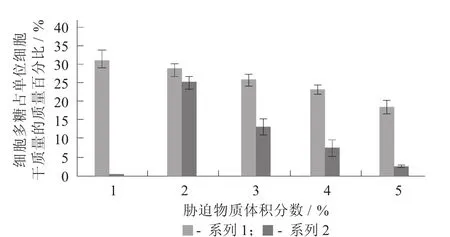
图1 不同胁迫条件对巴氏醋杆菌7015细胞多糖含量的影响
2.1.2 不同胁迫条件对细胞膜流动性的影响
除了调节荚膜多糖的合成以外,一些极端微生物会通过增加细胞膜的流动性来抵抗不利的生存环境。试验以嵌二萘为荧光探针测定其侧向扩散速率,根据嵌二萘单体和激发态二聚体的荧光强度的比值确定细胞膜的流动性。
不同碳源组成对巴氏醋杆菌7015膜流动性的影响见图2。

图2 不同碳源组成对巴氏醋杆菌7015膜流动性的影响
从图2可以看出,在以葡萄糖为碳源的正常条件下,细胞膜的荧光偏振度(P) 和微黏度(η) 的值越小,意味着此时细胞膜流动性越大。从图2(a)可以看出,随着乙醇剂量的增加,细胞膜的荧光偏振度和微黏度度逐渐减小,这就意味着细胞膜的流动性是逐渐增大的。在以乙酸为唯一碳源的培养基中,如图2(b),巴氏醋杆菌的细胞膜流动性也是随着乙酸体积分数的增加而增大。而且,相同体积分数条件下乙酸对细胞膜流动性的影响要略大于乙醇的影响。因此,巴氏醋杆菌7015除了通过减少荚膜多糖含量来应对不良环境外,也会通过增加细胞膜的流动性来应对胁迫环境。
2.1.3 不同胁迫物质对细胞膜透性的影响
ONPG是β-半乳糖苷酶的底物,当细胞内膜不完整时ONPG会很快进入细胞内,并被细胞内的β-半乳糖苷酶所降解,降解产物呈现黄色并在420 nm波长下具有最大吸收峰,因此可以用吸光度的大小来评价细胞膜透性的程度。
不同碳源组成对巴氏醋杆菌7015细胞膜透性的影响见图3。

图3 不同碳源组成对巴氏醋杆菌7015细胞膜透性的影响
从图3可看出,乙醇和乙酸对该菌细胞膜透性的影响是截然相反的。在乙醇环境中,随着乙醇体积分数的逐渐增加,细胞的吸光度逐渐增加,表明该株巴氏醋杆菌的细胞膜透性逐渐增加;而在乙酸环境中,随着乙酸体积分数的增加,细胞的吸光度逐渐下降,表明在乙酸环境中该株巴氏醋杆菌的细胞膜透性是逐渐降低的。对于醋酸生产而言,乙醇是属于初始的底物,因此醋酸菌会通过增加通透性的方法使底物迅速进入到细胞内进行转化,防止其对细胞造成伤害;而乙酸属于代谢产物,微生物会迅速将其排出胞外,并阻止其再次进入到胞内。因此在模拟的乙酸逆性环境中,该株微生物是采用减弱膜透性的方法抵御代谢产物再次进入到细胞内。
2.1.4 不同胁迫物质对细胞膜结合H+-ATPase活性及胞内ATP含量的影响
研究表明,H+-ATPase活性与微生物细胞中ATP的代谢密切相关,其活性高低可反映出微生物在当时所处阶段的能量需求。醋酸菌抵御外界不利环境的响应机制大多需要消耗ATP来维持细胞正常运行,因此推测乙醇的胁迫刺激可能会提高H+-ATPase活性,从而提高能量供应水平。
不同乙醇体积分数(a) 和乙酸体积分数(b)对巴氏醋杆菌7015细胞膜H+-ATPase活性及胞内ATP浓度的影响见图4。

图4 不同乙醇体积分数(a)和乙酸体积分数(b)对巴氏醋杆菌7015细胞膜H+-ATPase活性及胞内ATP浓度的影响
从图4可以看出,巴氏醋杆菌7015在面对乙酸、乙醇时,其ATP酶活性增加,而胞内ATP浓度却降低,这表明该株巴氏醋杆菌也是通过大量消耗ATP来应对逆性环境的,这与Andrés-Barrao C等人[18]的研究相符。在乙醇和乙酸各自的胁迫环境中,ATP酶活性和胞内ATP浓度改变的情况有较大差异。当乙醇体积分数为2%时,见图4(a),ATP酶活性为非应激状态下的2.36倍。随着乙醇体积分数的增加,ATP酶活性逐渐降低,当乙醇体积分数为5%时,ATPase活性为非应激状态下的1.99倍。而伴随着ATP酶活性增加,胞内ATP含量是逐渐下降的,乙醇体积分数越高,胞内ATP含量越低(如乙醇体积分数为5%时,胞内ATP含量为非应激状态下ATP含量的66.9%),表明该株巴氏醋杆菌在应对乙醇胁迫时是大量耗能的。而在乙酸环境中,见图4(b),随着乙酸体积分数的增加,ATP酶活性逐渐增加,而胞内ATP浓度却快速下降。当乙酸体积分数为5%时,ATP酶活性是非应激状态下的2.27倍,而胞内ATP浓度却为非应激状态时的9.74%。由此可以看出,该株巴氏醋杆菌在应急状态下会消耗ATP产生应激机制,而且不同的胁迫物质所消耗的能量是不同的。
2.2 外源脂肪酸对巴氏醋杆菌生理特性的影响
2.2.1 外源脂肪酸对细胞多糖含量的影响
研究表明,脂肪酸可以弱化胁迫环境对细胞膜的伤害,达到保护细胞内容物的作用。在以乙醇为胁迫条件的培养基中分别添加不同脂肪酸来确定脂肪酸对巴氏醋杆菌抗逆性的作用。
不同外源脂肪酸对巴氏醋杆菌7015细胞多糖含量的影响见图5。

图5 不同外源脂肪酸对巴氏醋杆菌7015细胞多糖含量的影响
从图5可以看出,在以乙醇为唯一碳源的培养基中添加外源脂肪酸可以增加细胞荚膜多糖含量,且棕榈酸、硬脂酸、油酸对增加细胞多糖的效果要优于亚油酸,但添加有机酸后细胞多糖的含量还是要低于没有胁迫条件时的多糖浓度(对照组)。这就表明,外源添加脂肪酸可以减弱乙醇对巴氏醋杆菌的应激作用,且饱和脂肪酸与非饱和脂肪酸都可以促进巴氏醋杆菌合成细胞多糖。
2.2.2 外源脂肪酸对细胞膜流动性的影响
研究表明,不同的脂肪酸类型对菌体耐胁迫能力的影响程度是不同的,且长链饱和脂肪酸对细胞膜的保护作用要强于不饱和脂肪酸[19]。棕榈酸、硬脂酸属于长链饱和脂肪酸,而油酸和亚油酸属于长链不饱和脂肪酸。
不同外源脂肪酸对巴氏醋杆菌7015膜流动性的影响见图6。

图6 不同外源脂肪酸对巴氏醋杆菌7015膜流动性的影响
从图6可以看出,与乙醇逆性相比,添加棕榈酸、硬脂酸后,微黏度和荧光偏振度均增加,表明细胞膜的流动性降低、稳定性增强,且棕榈酸的效果优于硬脂酸;而油酸和亚油酸属于不饱和脂肪酸,它们的添加会进一步使细胞膜的流动性增强,此结论与前人报道的一致。
2.2.3 外源脂肪酸对细胞膜透性的影响
分别测定了不同脂肪酸对细胞膜透性的影响,分析脂肪酸与细胞膜透性之间的关系。
外源脂肪酸对巴氏醋杆菌7015内膜透性的影响见图7。
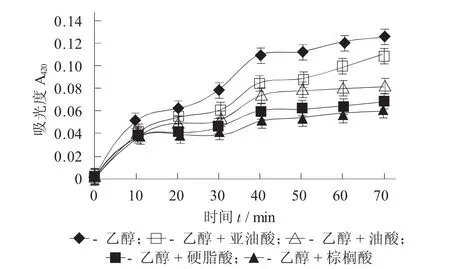
图7 外源脂肪酸对巴氏醋杆菌7015内膜透性的影响
从图7可以看出,在有胁迫物质存在的条件下,添加外源脂肪酸均可以减弱细胞膜的透过性,提高细胞膜的稳定性。其中饱和脂肪酸的效果要优于不饱和脂肪酸,且饱和度越高对细胞膜透性的影响越大。因此,可以看出饱和脂肪酸在减弱膜透性的同时增强膜的稳定性。
2.2.4 外源脂肪酸对膜结合H+-ATPase活力及胞内ATP含量的影响
因为微生物在对抗逆性环境时,需要消耗大量的能量,因此分别测定了逆性环境中添加不同脂肪酸时胞内对H+-ATPase活力及胞内ATP含量的影响。
不同外源脂肪酸对巴氏醋杆菌7015细胞膜H+-ATPase活性的影响见图8。

图8 不同外源脂肪酸对巴氏醋杆菌7015细胞膜H+-ATPase活性的影响
从图8可以看出,添加外源脂肪酸可以增加H+-ATPase酶活性,而且不饱和脂肪酸对酶活的影响要明显高于饱和脂肪酸。除硬脂酸外,添加外源脂肪酸可以增加胞内ATP浓度。在培养基中添加棕榈酸,使絮凝酵母质膜H+-ATPase活性提高1.6倍,而添加含亚油酸及亚麻酸H+-ATPase活性却减少。而添加脂肪酸后(除硬脂酸外),细胞内ATP含量均较单纯的乙醇对照组提高,说明该株巴氏醋杆菌细胞在有外源脂肪酸的情况下,面临相同的胁迫条件时可以减弱胞内ATP的消耗量,因此积累量增加;而添加不饱和脂肪酸也可以减弱胞内ATP的消耗含量,其减弱程度高于饱和脂肪酸的减弱程度;而且不饱和度越高,胞内ATP积累量越高。
3 结论
在面对不同胁迫条件时,巴氏醋杆菌会降低细胞荚膜多糖的合成量来增加细胞外运能力。同时巴氏醋杆菌还通过增强细胞膜透性和流动性来应对胁迫物质,同时会提高H+-ATPase酶活性来应对高耗能的抗胁迫运动。而外源脂肪酸的添加有助于巴氏醋杆菌应对乙醇的胁迫,首先添加脂肪酸可以提高细胞荚膜多糖的含量;其次添加脂肪酸可以提高细胞膜的稳定性(细胞膜流动性、细胞膜透性均降低),同时提高了H+-ATPase活性,使得细胞内ATP合成量增加,但是依然弱于以葡萄糖为碳源的环境。饱和脂肪酸在增加细胞膜稳定性方面要高于不饱和脂肪酸,而在提高H+-ATPase活性、增强ATP合成量和细胞膜稳定性方面不饱和脂肪酸要优于饱和脂肪酸,且不饱和度越高,增强能力越强。
