自然发酵甜面酱中芽孢杆菌的分离、筛选及鉴定
2018-10-22刘达玉刘阳邓静杨进军姜元华
刘达玉,刘阳,邓静,杨进军,姜元华*
(1.成都大学 生物工程学院,成都 610106;2.四川旅游学院,成都 610100)
甜面酱是以小麦粉或面粉为主要原料,经制曲和保温发酵制成的一种酱状调味品[1],其味甜中带咸,同时拥有酱香和酯香。甜面酱含有多种风味物质和丰富的营养物,在人们日常生活中是不可或缺的调味品,其在烹饪酱爆和酱烧菜中,具有上色、提鲜、增香的作用;此外,甜面酱还作为黄瓜、大葱、烤鸭等菜品的蘸料,其味道鲜甜可口,具有增加食欲的功效,深受广大消费者喜爱[2-4]。
甜面酱属于传统发酵酱类制品,其在形成过程中与微生物活动密不可分。目前,甜面酱研究中已研究报道的有霉菌、酵母菌、细菌等,其中霉菌主要包括米曲霉、黑曲霉、根霉等,酵母菌主要为假丝酵母、产酯酵母等,细菌则为芽孢杆菌、乳酸菌等[5-7]。霉菌主要是在甜面酱发酵的前期发挥作用,诸如米曲霉、毛霉、根霉和黑曲霉等是制曲阶段的主要菌种,其中米曲霉与酿造过程的快慢、颜色、滋味有直接关系[8,9];酵母菌主要是在甜面酱发酵的第二个阶段起作用,在无氧环境下酵母菌通过EMP途径将葡萄糖分解最终还原生成乙醇,对甜面酱的特有香气有一定的促进作用[10];细菌在甜面酱发酵过程中也至关重要,酱醅中的乳酸菌可发酵糖类,进行乳糖代谢,对酱制品风味有着重要的贡献[11];此外,一些芽孢杆菌在发酵过程中可利用淀粉酶、蛋白酶降解的小分子糖类和氨基酸等进行生长,并通过发酵产酸和氨基酸等物质,形成了酱类成品的风味成分和营养成分[12]。
可见,在甜面酱发酵形成过程中,各种微生物共同协作,才使得其营养丰富、风味香醇。现阶段在甜面酱的研究中,人们对霉菌和酵母菌进行了很多研究,对细菌的研究相对较少,特别是忽略了芽孢杆菌的重要性。芽孢杆菌是一类优秀的潜在益生菌,拥有繁殖速度快,产酶性能高,抵抗有害病原菌效果好等优点,工业生产中常用作动物微生态制剂的生产菌种[13-15]。目前,芽孢杆菌在甜面酱发酵中发挥的作用有待深度探讨,其对甜面酱形成的风味成分和营养物质有何种关系还是未知,因此非常有必要对甜面酱中的芽孢杆菌进行分离、筛选,并对其相关特性进一步研究。本实验从成熟的自然发酵甜面酱中,分离、筛选得到芽孢杆菌,并对其进行形态学观察和分子生物学鉴定,从而确定其种属,为进一步探究其在甜面酱发酵过程中的作用机理提供基础。
1 材料与方法
1.1 实验材料
1.1.1 材料来源
样品:成熟的自然发酵甜面酱,四川自贡仙味源酿造有限公司提供。
1.1.2 仪器与设备
SHP0201147047型电子分析天平 上海恒平科学仪器有限公司;SW-CJ-IF型超净工作台 苏州安泰空气技术有限公司;SM530C型立式压力蒸汽灭菌器 成都盛德先华科贸有限公司;BH200型微生物显微镜 宁波舜宇仪器有限公司;LRH-250型生化培养箱 上海齐欣科学仪器有限公司;QYC-2102C型摇床 上海福玛实验设备有限公司;TGL-16B型台式高速离心机 湖南星科科学仪器有限公司;S-3C型pH计 成都世纪方舟科技有限公司;S1000型PCR扩增仪、Gel Doc 2000型凝胶成像系统 美国BIO-RAD公司;DY-6C型电泳仪 北京市六一仪器厂。
1.1.3 主要试剂
蛋白胨、牛肉膏、氯化钠、琼脂、葡萄糖、肌酸、甲基红试剂、溴甲基酚紫、麦芽糖、乳糖、蔗糖、氢氧化钠、酵母浸膏、磷酸氢二钾、乙酸钠、柠檬酸钠、硫代硫酸钠、草酸铵、结晶紫、碘化钾、碘、盐酸、甘油、甲醛、苯酚、品红、异戊醇、乙醇、溴化乙锭(EB)、十六烷基三甲基溴化铵(CTAB):购于成都市科龙化工试剂厂。
1.1.4 培养基
牛肉膏蛋白胨固体培养基:蛋白胨10 g,氯化钠5 g,牛肉膏3 g,琼脂20 g,水1000 mL,pH 7.0~7.2,121 ℃灭菌20 min(液体培养基不加琼脂即可)。
PCA培养基:胰蛋白胨5 g,酵母浸膏2.5 g,葡萄糖1 g,琼脂15 g,蒸馏水1000 mL,pH 6.8~7.2,121 ℃灭菌20 min。
蛋白胨水培养基:蛋白胨 10 g,氯化钠 2.5 g,水1000 mL,pH 7.4~7.6。
葡萄糖蛋白胨培养基:蛋白胨5 g,葡萄糖5 g,磷酸氢二钾5 g,蒸馏水1000 mL,pH 7.2。
H2S培养基:葡萄糖20 g,氯化钠5 g,柠檬酸钠0.5 g,硫代硫酸钠0.5 g,琼脂5~8 g,水1000 mL,pH 7.2。
1.2 实验方法
1.2.1 菌株分离
三角瓶中加入99.0 mL牛肉膏蛋白胨液体培养基,再加入1.0 g自然发酵的甜面酱,置于37 ℃,140 r/min摇床富集培养24 h。将培养好的菌悬液于85 ℃水浴15 min,用移液枪取1.0 mL菌悬液,以无菌水按10倍系列梯度稀释成10-1,10-2,10-3,10-4,10-5,10-6。分别吸取不同梯度的菌悬液各0.1 mL,无菌环境下在牛肉膏蛋白胨平板上涂布分离,于37 ℃生化培养箱中培养48 h后,挑选单菌落纯化培养。
1.2.2 芽孢杆菌的筛选
选取单菌落进行芽孢染色,挑出产生芽孢的菌落,进一步在牛肉膏蛋白胨平板纯化培养,并多次于固体培养基中四区划线分离,37 ℃培养24 h后,仔细观察菌落形态并进行记录。确认为纯培养物后,取菌落的一部分转接到牛肉膏蛋白胨斜面培养基中同条件培养24 h,待生长旺盛后,置于4 ℃冰箱中保藏,每月移种1次,另取生长旺盛的菌体用甘油悬液保藏法保藏,以备用于后续实验。
1.2.3 形态学鉴定
1.2.3.1 菌落形态观察
按无菌操作将各个菌株接种于牛肉膏蛋白胨固体培养基,37 ℃培养48 h,观察菌落大小、形态、颜色、光泽度、透明度等,做好记录。
1.2.3.2 个体形态观察
芽孢染色:取洁净的小试管加入0.2 mL无菌水,加入1~2接种环的芽孢杆菌的菌苔充分混合得到菌悬液;在菌悬液中加入0.2 mL苯酚品红溶液,沸水浴加热3~5 min;接种环挑取少量菌悬液,在载玻片上涂薄,风干,用95%乙醇冲洗载玻片至无红色液流出;再用自来水冲洗,滤纸吸干;吸取少量黑色素溶液于涂片处,均匀涂薄,自然干燥,进行油镜观察。
按革兰氏染色法对各菌株染色,辨别其为阳性菌或是阴性菌;并在100倍油镜下观察其菌体形态、大小、有无芽孢及着生位置等,严谨观察、描述、拍照、记录。
1.2.4 生理生化实验鉴定
对芽孢杆菌进行了酶触反应、糖发酵实验、甲基红实验、VP实验、H2S实验、吲哚实验、明胶液化、柠檬酸盐的利用实验,对已经分离出的芽孢杆菌进行鉴定,从而确定其生理生化特性。
1.2.5 16S rDNA菌种鉴定
分子鉴定的主要依据是细菌的16S rDNA片段,其具有高度的保守性、稳定性,可作为分子指标,快速、准确、简便地对微生物进行分类鉴定。本研究中DNA的提取参考吉志伟等[16]的方法;PCR扩增采用引物27F/1492r对醋酸菌和乳酸菌的16S rDNA区进行特异性扩增,其PCR扩增体系参考文献[17],将结果送至上海杰李生物技术有限公司测序,将所测定菌株的16S rDNA序列同GenBank中已提交的序列进行B1ast N分析和同源比对,寻找与目的基因序列同源性最高的已知分类地位的菌种,进一步确定菌株的种属性质。
2 结果与分析
2.1 芽孢杆菌的筛选
通过1.2.2的实验步骤,用标准枯草芽孢杆菌作对照菌,获得纯种芽孢杆菌共计13株,分别标明为B1,B2,B3,B4,B5,B6,B7,B8,B9,B10,B11,B12,B13。进行芽孢染色之后,将各菌株置于微生物显微镜下油镜观察,在淡紫灰色背景的衬托下,菌体呈现白色,菌体内的芽孢呈现红色。部分染色照片见图1(a~c),由此可初步判断该13株菌株均为芽孢杆菌(图片均能清晰观察,考虑到全部显示凸显多余,则以少许图片为代表表明结果)。
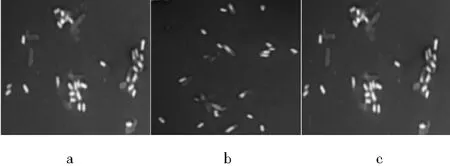
图1 芽孢染色(10×100)Fig.1 Spore staining (10×100)
2.2 形态学鉴定
对分离出的13株细菌的菌落形态进行观察鉴定,其形态表征结果见表1。通过各菌株革兰氏染色结果可知,13株菌株均为阳性菌。菌落形态、个体形态图片详见图2和图3。由于本实验菌株图片太多,选取3种菌株作为代表。

表1 芽孢杆菌形态描述Table 1 The description of morphology of Bacillus

续 表
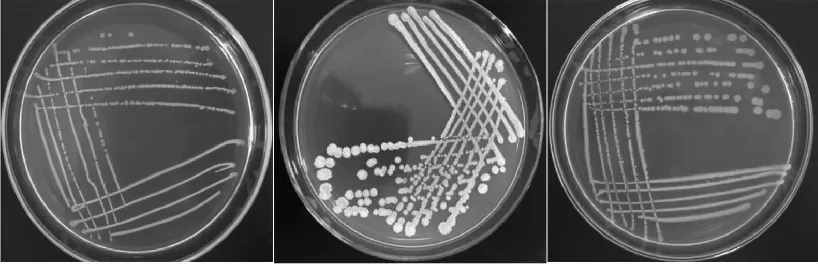
图2 芽孢杆菌菌落形态Fig.2 The colony morphology of Bacillus
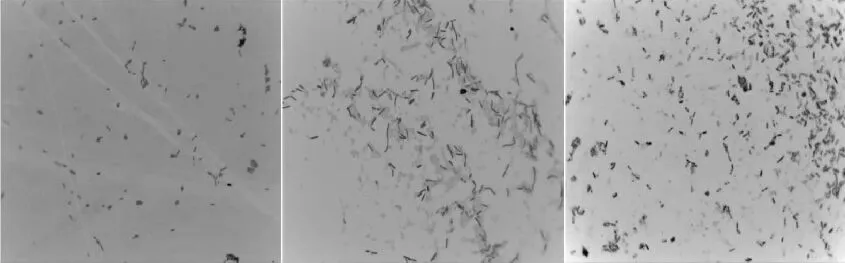
图3 芽孢杆菌菌体形态(10×100)Fig.3 The cell morphology of Bacillus(10×100)
2.3 生理生化鉴定结果
按照1.2.4的生理生化实验方法步骤,对已筛选得到的13株芽孢杆菌进行鉴定,各个实验鉴定菌株结果见表2。通过不同芽孢杆菌对每个实验结果的不同,确定生理特性,从而得出菌株的种类。
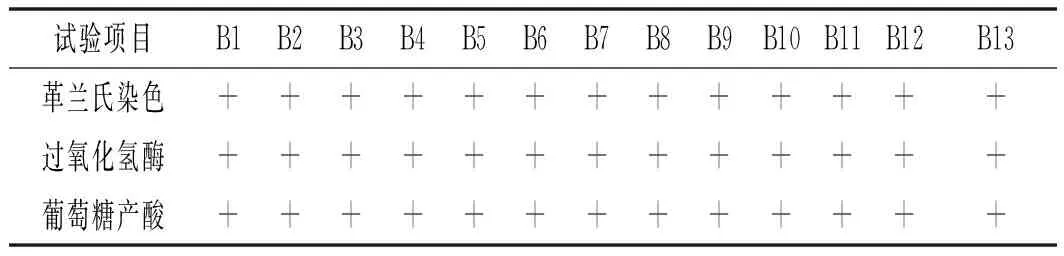
表2 生理生化试验结果Table 2 The results of physiological and biochemical test

续 表
注:“+”表示实验结果为阳性,“-”表示实验结果为阴性。
2.4 16S rDNA菌种鉴定
根据1.2.5的方法步骤,筛选到13株芽孢杆菌,并得到各个菌株的16S rDNA序列,具体各菌株测序结果见表3。由于本实验菌株较多,故选取3种菌株作为代表。将各个菌株的16S rDNA序列在CNBI基因库中进行同源性比较,获得和各菌株序列相似度最高的菌株,即初步认定该菌株种类,具体结果见表4。

表3 16S rDNA基因序列Table 3 The genetic sequence of 16S rDNA

续 表
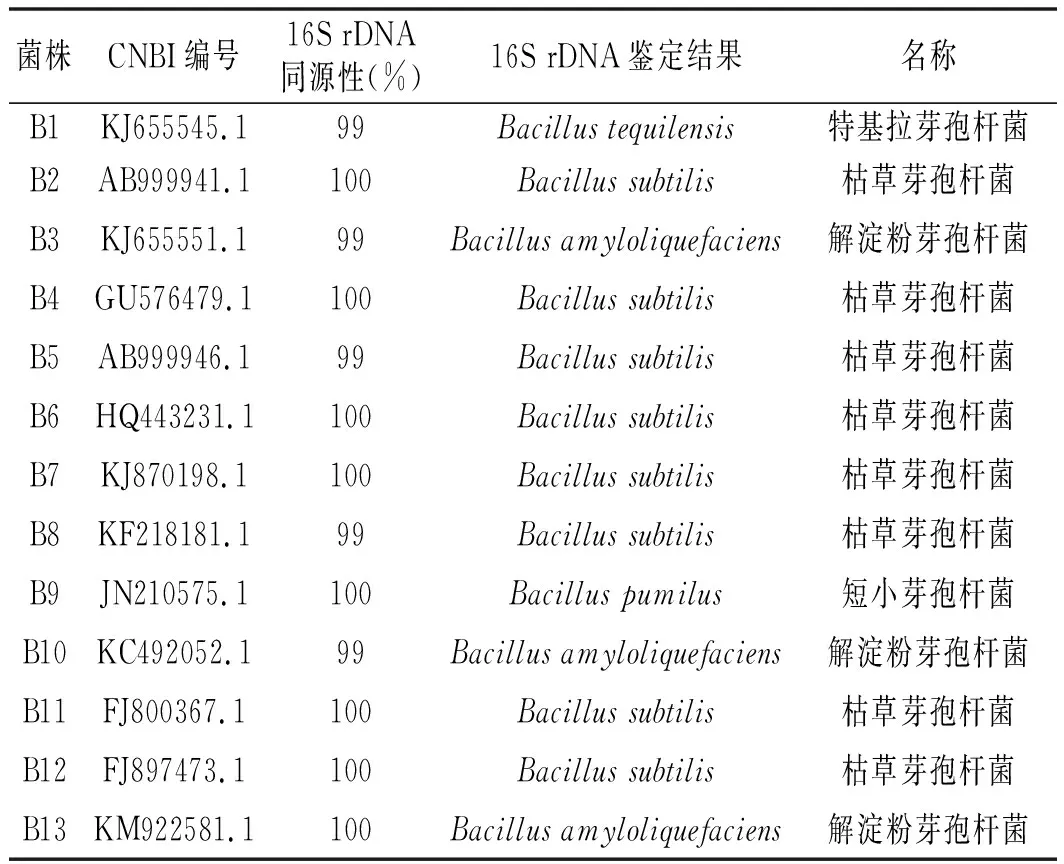
表4 16S rDNA菌种鉴定Table 4 The identification of 16S rDNA strain
3 结论
本实验利用10倍梯度稀释法涂布平板,从自然发酵的甜面酱中筛选芽孢杆菌,共计得到13株菌株,其革兰氏结果均为阳性。各菌株的单菌落形态呈圆形,白色,直径1~5 mm,不透明,边缘整齐,菌体的显微形态多为椭圆或柱状,芽孢基本分布在细胞体的中心。通过对其进行菌落、显微形态观察和16S rDNA片段扩增及序列分析技术分析,最终确定13株菌株中:菌株B2,B4,B5,B6,B7,B8,B11,B12为枯草芽孢杆菌,菌株B3,B10,B13为解淀粉芽孢杆菌,菌株B1为特基拉芽孢杆菌,菌株B9为短小芽孢杆菌。
现阶段,芽孢杆菌在甜面酱发酵中发挥的作用有待深度探讨,其对甜面酱形成的风味成分和营养物质有何种关系还是未知,因此本研究所得菌株可为进一步探究其在甜面酱发酵过程中的作用机理奠定重要基础。
