高脂饲料联合结扎冠状动脉左前降支探讨冠心病痰瘀互结证大鼠模型的建立与评价*
2018-10-22许慧愚王鹏伟高树明于春泉
王 朔,梁 如,许慧愚,冯 曼,王鹏伟,高树明,李 琳,高 杉,潘 晔,于春泉
(天津中医药大学,天津 300193)
近年来,冠心病稳定型心绞痛发病率及病死率逐年上升,成为威胁人类健康的主要疾病之一。研究表明,冠心病中医证候要素已发生变化,其中以痰浊、血瘀居多,痰瘀互结的证候类型比例也呈现出逐步增高的趋势[1-2]。目前尚无公认的冠心病痰瘀互结证大鼠模型制备方法。中医药治疗冠心病痰瘀互结证的作用机制尚未明确。本研究根据中医对于冠心病痰瘀互结证的认识,在高脂饲料喂养的基础上联合冠状动脉左前降支结扎的方法模拟冠心病痰瘀互结证的病机演变过程,建立冠心病痰瘀互结证大鼠模型,对于中药疗效评价和中药作用机制研究有重要价值。
1 材料
健康SPF级Wistar雄性大鼠115只,体质量(200±20)g,购于北京维通利华动物实验中心[动物合格证编号:SCXK(京)2016-001]。高脂饲料由江苏美迪森生物医药有限公司提供(MD12017)。
小动物超声影像系统vevo2100(加拿大),全自动生化分析仪(7020型)、日本数码拍摄系统(Olympus DP71)、血小板分析仪(PL-11)、全自动血流变仪(SA-6000),水合氯醛(北京索莱宝科技有限公司)、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)检测试剂盒(南京建成生物工程研究所)、肌酸激酶(CK)、肌酸激酶-MB型同工酶(CK-MB)、乳酸脱氢酶(LDH)检测试剂盒(中生北控生物科技股份有限公司)、2,3,5-氯化三苯基四氮唑(TTC)检测试剂盒(美国Sigma公司)。
2 方法
2.1 实验分组及造模 实验大鼠饲养于南开医院实验动物中心,饲养条件:温度(24±1)℃,湿度(55%±5%)。实验前适应性喂养1周,实验期间保持自由饮水和进食。参照随机数字表将115只大鼠随机分为5组,分别为:空白组(15只)、假手术组(20只)、痰浊组(20只)、血瘀组(30只)、痰瘀互结组(30只)。空白组、假手术组及血瘀组采用普通饲料喂养8周,痰浊组及痰瘀互结组采用高脂饲料喂养8周。于第49天目内眦取血检测血脂,剔除血脂水平未升高的大鼠。于第54天,对血瘀组和痰瘀互结组行冠状动脉左前降支结扎术,假手术组行只穿线不结扎术。术后24 h,采用超高分辨率小动物超声检测大鼠心功能。其中,假手术组术中死亡2只,痰浊组饲养期间死亡2只,血瘀组术中死亡25只,痰瘀互结组术中死亡18只。剔除死亡及未符合标准的大鼠。术后保持原饲养条件至8周末进行取材。
2.2 检测方法
2.2.1 一般状态观察 观察并记录各组大鼠舌色、活动情况、毛发光泽、饮食情况、小便颜色、大便性状等情况。
2.2.2 超声心动检测方法 采用异氟烷麻醉,剃去胸部毛发,选用高频矩阵探头,探头垂直于左胸壁,探查心脏沿二尖瓣口至心尖方向的左心室长轴像及短轴像。超声检测主要指标:左心室射血分数(EF)、左心室短轴缩短率(FS)、收缩末期室间隔厚度(IVSs)、收缩末期左心室后壁厚度(LVPWs)、收缩末期左心室内径(LVIDs)、收缩末期左心室容积(LV Vols)、左心室质量(LV M)。
2.2.3 血脂变化检测 第49天各组大鼠目内眦采血 1 mL,离心机离心(3 500 r/min,10 min),取血清,第56天各组大鼠腹主动脉取血(3 500 r/min,10 min),测定 TC、TG、LDL、HDL,具体操作参见试剂盒说明书。
2.2.4 心肌组织苏木精-伊红(HE)染色 将心脏组织置于10%中性缓冲福尔马林固定,依次脱水,包埋,切片(5 μm),并进行HE染色。显微镜下对病理切片进行观察。
2.2.5 心肌酶检测 采用全自动生化分析仪对各组大鼠血清中心肌酶学指标(LDH、CK、CK-MB)进行检测。
2.2.6 血液流变学检测 采用肝素抗凝管取血5 mL,将血样送往天津中医药大学第一附属医院检验科检测全血黏度、血浆黏度、血小板聚集率和最大血小板聚集率。
2.2.7 TTC染色 将心脏切片在1%的TTC染液中37℃孵育15 min,然后置于10%福尔马林中固定,观察TTC染色情况。
2.3 统计学方法 采用SPSS 20软件进行统计分析,实验数据以均数±标准差(±s)表示,进行正态分布检验和方差齐性检验后,多组间比较使用单因素方差分析法(One-Way ANOVA),以 P<0.05为差异有统计学意义。
3 结果
3.1 一般状态观察 空白组、假手术组和血瘀组大鼠少有脱毛,皮下无异常,饮食规律。空白组和假手术组大鼠活动一般,精神较好。血瘀组大鼠结扎后活动度降低精神萎靡。痰浊组和痰瘀互结组大鼠出现明显的厌食,精神状态萎靡,毛发油腻、发黄,活动度降低。
空白组和假手术组大鼠唇色和舌色呈淡红色,痰浊组大鼠唇色和舌色呈淡紫色,舌体胖大,血瘀组和痰瘀互结组大鼠唇色和舌色呈暗紫色,部分痰瘀互结组大鼠有明显齿痕,见图1。
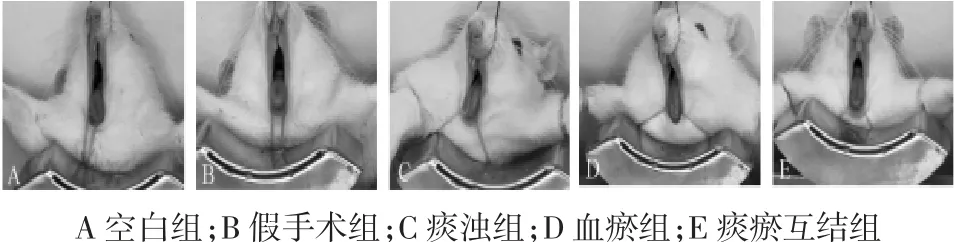
图1 各组大鼠舌色变化Fig.1 Changes in tongue color of rats in each group
3.2 心脏超声检测
3.2.1 心脏功能变化 与假手术组比较,痰浊组、血瘀组和痰瘀互结组 EF、FS显著降低(P<0.01);与痰浊组比较,血瘀组和痰瘀互结组EF、FS显著降低(P<0.01),见表 1。
表1 各组大鼠心功能变化(±s)Tab.1 Changes in heart function of rats in each group(±s)%
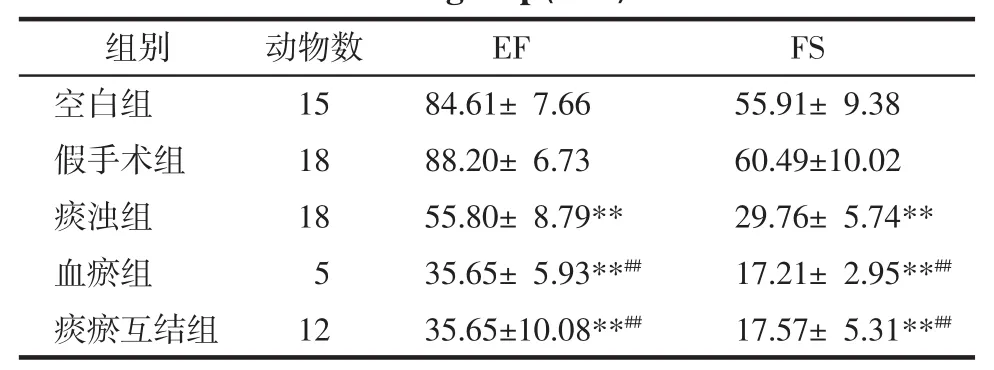
表1 各组大鼠心功能变化(±s)Tab.1 Changes in heart function of rats in each group(±s)%
注:与假手术组比较,**P<0.01;与痰浊组比较,##P<0.01。
组别 动物数 EF FS空白组 15 84.61± 7.66 55.91± 9.38假手术组 18 88.20± 6.73 60.49±10.02痰浊组 18 55.80± 8.79** 29.76± 5.74**血瘀组 5 35.65± 5.93**## 17.21± 2.95**##痰瘀互结组 12 35.65±10.08**## 17.57± 5.31**##
3.2.2 左心室结构变化 与假手术组比较,痰浊组和痰瘀互结组舒张末期的室间隔厚度明显降低(P<0.01),痰浊组、血瘀组和痰瘀互结组收缩末期室间隔厚度、收缩末期后壁厚度显著降低(P<0.05,P<0.01),收缩末期内径显著增加(P<0.01),见表 2。
表2 各组大鼠左心室结构变化(±s)Tab.2 Changes of left ventricle structure of rats in each group mm
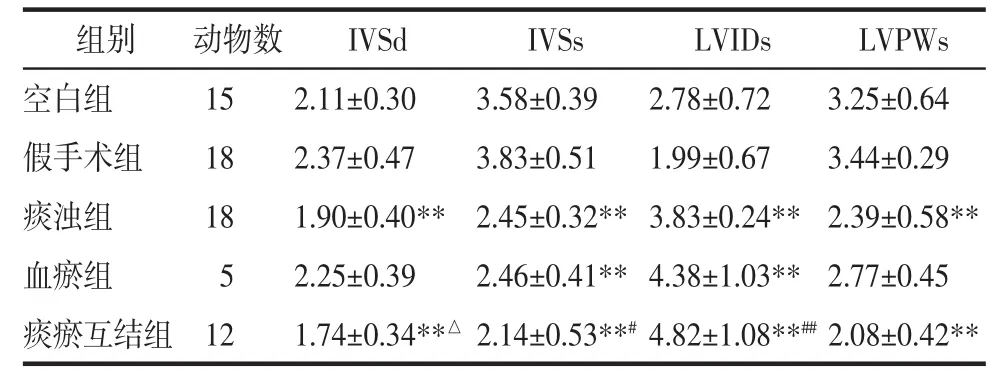
表2 各组大鼠左心室结构变化(±s)Tab.2 Changes of left ventricle structure of rats in each group mm
注:与假手术组比较,**P<0.01;与痰浊组比较,#P<0.05,##P<0.01;与血瘀组比较,△P<0.05。
组别 动物数 IVSd IVSs LVIDs LVPWs空白组 15 2.11±0.30 3.58±0.39 2.78±0.72 3.25±0.64假手术组 18 2.37±0.47 3.83±0.51 1.99±0.67 3.44±0.29痰浊组 18 1.90±0.40** 2.45±0.32**3.83±0.24** 2.39±0.58**血瘀组 5 2.25±0.39 2.46±0.41**4.38±1.03** 2.77±0.45痰瘀互结组 12 1.74±0.34**△ 2.14±0.53**#4.82±1.08**##2.08±0.42**
3.2.3 左心室容积和质量的变化 与假手术组比较,痰浊组、血瘀组和痰瘀互结组收缩末期容积明显增加(P<0.01),痰浊组和痰瘀互结组左心室质量明显降低(P<0.05,P<0.01)。与痰浊组比较,痰瘀互结组收缩末期容积明显增加(P<0.01),见表3。
表3 各组大鼠左心室容积和质量的变化(±s)Tab.3 Changes in left ventricular volume and mass of rats in each group(±s)
表3 各组大鼠左心室容积和质量的变化(±s)Tab.3 Changes in left ventricular volume and mass of rats in each group(±s)
注:与假手术组比较,*P<0.05,**P<0.01;与痰浊组比较,#P<0.05,##P<0.01。
组别 动物数 LV Vols(μL) LV M(mg)空白组 15 32.05±18.24 712.35±152.97假手术组 18 11.79± 8.00 719.43±176.60痰浊组 18 70.82±23.68** 550.18±135.19**血瘀组 5 92.17±49.09** 678.96±206.46痰瘀互结组 12 115.63±54.69**## 566.73±131.12*
3.3 血脂变化 与假手术组比较,痰浊组和痰瘀互结组大鼠 TC、LDL 均显著增高(P<0.01),HDL 显著性降低(P<0.01)。与痰浊组比较,血瘀组大鼠TC、LDL均显著降低(P<0.01),HDL显著性升高(P<0.01)。与血瘀组比较,痰瘀互结组大鼠TC、LDL均显著增高(P<0.01),HDL 显著性降低(P<0.01),见表 4。
3.4 心肌酶变化 与假手术组比较,血瘀组和痰瘀互结组 CK、CK-MB、LDH 显著升高(P<0.01)。与痰浊组比较,血瘀组和痰瘀互结组大鼠CK、CK-MB、LDH 显著升高(P<0.01),见表 5。
表4 各组大鼠血脂变化(±s)Tab.4 Changes of blood lipid of rats in each group(±s)mmol/L

表4 各组大鼠血脂变化(±s)Tab.4 Changes of blood lipid of rats in each group(±s)mmol/L
注:与假手术组比较,**P<0.01;与痰浊组比较,##P<0.01;与血瘀组比较,△△P<0.01。
组别 动物数 TC TG LDL HDL空白组 15 3.20± 0.91 0.72±0.13 2.06±0.50 0.73±0.18假手术组 18 3.42± 1.23 0.84±0.27 2.26±0.43 0.79±0.12痰浊组 18 25.68±10.29** 0.83±0.29 11.54±5.62** 0.47±0.26**血瘀组 5 3.40± 0.69## 0.76±0.19 1.98±0.28## 0.72±0.15##痰瘀互结组 12 21.15± 6.83**△△ 0.87±0.32 8.42±2.41**△△ 0.41±0.22**△△
表5 各组大鼠心肌酶变化(±s)Tab.5 Changes of myocardial enzymes of rats in each group(±s)U/L

表5 各组大鼠心肌酶变化(±s)Tab.5 Changes of myocardial enzymes of rats in each group(±s)U/L
注:与假手术组比较,**P<0.01;与痰浊组比较,##P<0.01。
组别 动物数 CK CK-MB LDH空白组 15 775.70±131.17 1 023.00±155.50 1 150.90±315.46假手术组 18 798.15±152.11 1 031.00±206.36 1 182.33±321.19痰浊组 18 964.77±168.33 965.00±223.86 1 138.92±323.91血瘀组 5 1 912.80±323.29**##2 037.00±255.42**##2 597.20±511.39**##痰瘀互结组 12 1 821.55±529.69**##1 943.64±351.93**##2 306.36±481.17**##
3.5 血液流变学变化 与假手术组比较,痰浊组和痰瘀互结组大鼠 BV1/s、BV5/s、BV30/s、BV200/s 和PV 显著增高(P<0.05或 P<0.01),血瘀组大鼠 BV1/s、BV5/s和 BV30/s显著增高(P<0.05或 P<0.01)。与痰浊 组 相 比 , 血 瘀 组 大 鼠 BV1/s、BV5/s、BV30/s、BV200/s和 PV 明显降低(P<0.05或 P<0.01),痰瘀互结组大鼠BV200/s和PV明显下降(P<0.05或P<0.01)。与血瘀组相比,痰瘀互结组BV1/s和BV30/s明显升高(P<0.05或 P<0.01),见表 6。
3.6 血小板聚集率和最大血小板聚集率变化 与假手术组比较,痰浊组和痰瘀互结组血小板聚集率和最大血小板聚集率明显升高(P<0.01)。与痰浊组比较,血瘀组和痰瘀互结组血小板聚集率和最大血小板聚集率明显降低(P<0.01)。与血瘀组比较,痰瘀互结组血小板聚集率和最大血小板聚集率明显升高(P<0.01),见表 7。
表6 各组大鼠血液流变学变化(±s)Tab.6 Changes in hemorheology of rats in each group(±s)mPa·s

表6 各组大鼠血液流变学变化(±s)Tab.6 Changes in hemorheology of rats in each group(±s)mPa·s
注:与假手术组比较,*P<0.05,**P<0.01;与痰浊组比较,#P<0.05,##P<0.01;与血瘀组比较△P<0.05,△△P<0.01。
组别 动物数 BV 1/s BV 5/s BV 30/s BV 200/s PV空白组 15 52.38±7.49 19.43±2.58 9.36±1.12 6.24±0.69 1.20±0.04假手术组 18 50.96±6.55 20.19±2.23 10.26±1.48 7.23±1.43 1.27±0.06痰浊组 18 78.34±7.97** 26.60±2.98** 13.41±1.05** 10.32±2.39** 1.67±0.20**血瘀组 5 64.25±3.95**## 23.64±2.19**# 11.67±0.98*## 8.02±0.66## 1.32±0.02##痰瘀互结组 12 78.31±9.43**△△ 25.87±1.63** 13.04±0.72**△ 8.67±0.62*# 1.45±0.11**##
表7 各组大鼠血小板聚集率和最大血小板聚集率变化(±s)Tab.7 Changes in platelet aggregation and maximal platelet aggregation of ratsin each group(±s)%
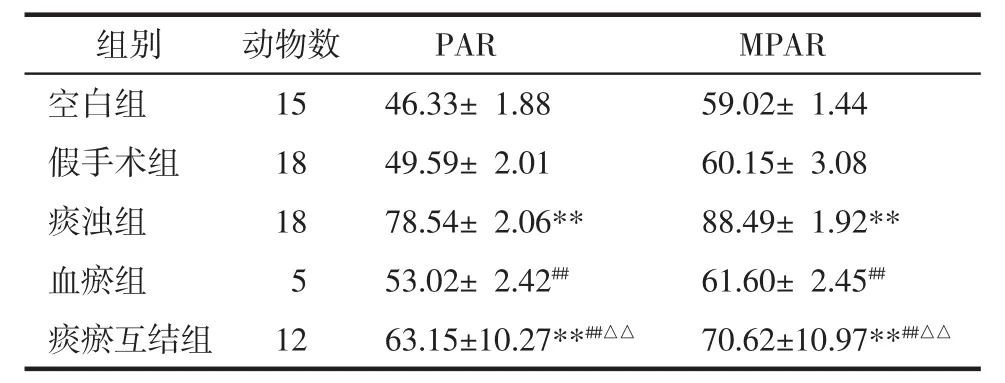
表7 各组大鼠血小板聚集率和最大血小板聚集率变化(±s)Tab.7 Changes in platelet aggregation and maximal platelet aggregation of ratsin each group(±s)%
注:与假手术组比较,**P<0.01;与痰浊组比较,##P<0.01;与血瘀组比较,△△P<0.01。
组别 动物数 PAR MPAR空白组 15 46.33± 1.88 59.02± 1.44假手术组 18 49.59±2.01 60.15±3.08痰浊组 18 78.54± 2.06** 88.49± 1.92**血瘀组 5 53.02± 2.42## 61.60± 2.45##痰瘀互结组 12 63.15±10.27**##△△ 70.62±10.97**##△△
3.7 心肌组织HE染色观察 空白组大鼠心肌细胞完整,心肌纤维排列整齐、紧密,无明显炎性细胞浸润和水肿,无明显病理异常。假手术组大鼠可见局部区域心肌细胞轻度水肿,痰浊组大鼠可见局部区域心肌细胞水肿及轻度脂肪样变,未见明显的炎细胞浸润及坏死的心肌细胞。血瘀组大鼠心肌排列不规则,结构紊乱,间质水肿,大量炎性浸润。痰瘀互结组大鼠心肌纤维断裂,心肌纤维排列不规则,结构紊乱,肌纤维空隙较宽,间质水肿,大量炎性浸润、坏死,见图2。

图2 各组大鼠心脏病理结构变化的影响(HE,×400)Fig.2 Effects of pathological changes of rats heart in each group(HE,×400)
3.8 TTC染色结果 空白组和假手术组心脏组织呈砖红色,无明显梗死,痰浊组、血瘀组和痰瘀互结组可见明显白色梗死区域,见图3。
4 小结
冠心病痰瘀互结证病机复杂,主要经历由痰致瘀,痰瘀兼化,终致痰瘀互结的病理演变过程[3]。中医学多认为“肥人多痰湿”,即恣食肥甘厚腻容易造成体内脂肪堆积,形成“痰湿”体质[4]。明代虞抟也认为:“津液黏稠,以痰为饮,积久渗入脉中,血之为浊(瘀)”,体内脂肪堆积,久之血脂升高,痰浊行于血脉,血液黏稠度增加,导致血流速度减缓,与冠心病痰瘀互结病机演变一致。

图3 各组大鼠心脏组织TTC染色结果Fig.3 TTC staining results of rats heart tissue in each group
冠心病痰瘀互结证动物模型通过先建立高脂血症模型,然后再予以冠状动脉左前降支结扎术的方法,模拟“由痰致瘀,痰瘀兼化”的病理状态,使动物同时具有“痰”和“瘀”的症状。血脂水平的异常与冠心病的发生发展密切相关[5]。胆固醇、甘油三酯、低密度脂蛋白及高密度脂蛋白是血浆脂质的主要组成部分,也是临床检测血脂水平的常用指标。在进行高脂饲料喂养后,大鼠出现血脂异常,心脏HE切片可见细胞水肿及脂肪样变等脂质沉积改变,可看作是“痰”的表现;心脏超声、HE切片可见炎细胞浸润、坏死及心肌纤维形态改变,可反映“瘀”的病理状态。此外,心肌酶变化、TTC染色反映心脏缺血性损伤[6],血流速度[7]改变、血小板聚集[8]反映血液的高凝状态,是血栓形成,血管损伤的重要检测指标,也是诊断冠心病的重要指征,故也可作为“瘀”的参考指标。
本次实验研究的结果显示,与假手术组大鼠比较,血瘀组和痰瘀互结组大鼠出现舌色紫暗,口唇颜色变深的症状,超声结果显示,两组大鼠心功能均有明显损伤,同时,两组大鼠全血黏度和血浆黏度明显升高,该类指标与冠心病血瘀证[9]的临床表现一致,提示“血瘀”模型成功;痰浊组和痰瘀互结组大鼠出现舌体胖大,两组大鼠活动度降低、嗜睡并伴有纳呆表现,符合痰湿证的表现[10],且检测血脂发现两组大鼠TC和LDL明显升高,HDL明显下降,出现血脂异常的脂代谢障碍表现,提示“痰浊”模型成功。痰瘀互结组大鼠心功能损伤明显,同时伴有脂代谢异常表现,兼具“痰浊”及“血瘀”症状,且检测指标多重于痰浊组及血瘀组,综上,采用高脂饲料喂养联合冠状动脉左前降支结扎的方法可建立冠心病痰瘀互结证大鼠模型。
然而本研究亦存在一定不足,虽然以高脂饲料喂养联合冠状动脉左前降支结扎方法在证候方面表现出“痰浊”与“血瘀”的相关特征,但是相较于临床上中医证候特定的诊断标准仍无法完全对等,如中医诊断冠心病[11](胸痹、心痛)主要依据“胸脘痞满”等患者的主观症状,该症状在大鼠身上无法直接进行观测;根据《痰湿证的临床诊断标准》[12],需具有“苔厚腻,脉滑”的表现,而大鼠舌苔,脉象还未能实现客观化的定量与采集。这些客观存在的问题还需在以后的研究中,借助多学科领域合作不断改进与完善,并从多维度多层次对证候模型建立全面完整的评价体系。
