动物来源的药用辅料质量应基于全过程的质量控制
2018-10-20洪小栩
文/洪小栩
一、药用辅料的概念
《中国药典》规定,药用辅料生产药品和调配处方时使用的赋形剂和附加剂作为非活性物质。药用辅料除了充当载体、提高稳定性外,还具有增溶、缓控释等重要功能。《美国药典》《欧洲药典》以及国际药用辅料协会(IPEC)则将药物活性成分制备成药物制剂的非药物活性成分,除活性成分以外的所有成分均纳入药用辅料范畴。
国际上药用辅料概念上涵盖了除活性成分以外的所有成分,在一定程度上,相对弱化了药用辅料的界限,扩大了辅料的范畴。意味着无论在制剂过程中使用,还是其他生产加工阶段使用的制剂或物质成分,制剂生产企业都应根据其风险程度,遵循相应的管理制度和技术规范。我国当前实施的关联审评审批制度,取消药用辅料单独注册,是逐步向基于风险管理理念,以制剂企业为责任主体的管理体制转变。
二、药用辅料的分类
药用辅料可按来源、用途、用于制备的剂型、给药途径分类。常用的分类方式是按其用途分类,包括助溶剂、乳化剂、着色剂、崩解剂、填充剂、稳定剂等。按来源性质分类分为天然物、半合成和全合成物,天然物按其来源分为动物来源、植物来源和矿物质来源的药用辅料。2015年版《中国药典》收载药用辅料标准270个,动物来源辅料14个,约占总量的5 %(见表1)。尽管动物来源辅料占比不高,但对于制剂的安全性和有效性至关重要。
三、动物来源药用辅料面临的问题
动物来源的辅料不同于化工合成辅料,由于其来源和制备工艺复杂性,给质量控制带来很大挑战,主要体现在:一是来源多样。不同地域、不同种属,甚至不同种群的同一物种,制备材料的来源存在一定差异;二是成分复杂。动物来源药用辅料通常为多组分制品,成分复杂,稳定性差,组分分离、批件控制难度较大;三是动物影响因素较多。动物的种群、饲养条件,卫生状况,动物的健康状况以及地域性疾病的因素都应重点考虑;四是生产工艺控制难度大。无论是动物组织、提取物,动物来源对药用辅料,生产工艺对产品的质量和稳定性至关重要;五是外源因子污染的潜在风险。无论是动物组织器官、生产工艺过程以及终端产品,存在污染外源因子的潜在风险;六是质量控制难度大。对多组分产品成分的评估及活性成分的控制,相关组分结构的差异和评估都极具挑战性。
四、动物来源材料的国内外法规和技术要求
各国药品监管机构对动物来源的用于药品制备的材料均有相应的法规要求和严格的技术规定,以最大程度控制这些材料的风险,保障使用安全(见表2)。

表2 各国关于动物来源药用材料的技术法规

续表
《中国药典》2015年版凡例规定,来源于动物组织提取的药品,其所用动物种属要明确,所用脏器均应来自经检疫的健康动物,涉及牛源的应取自无牛海绵状脑病地区的健康牛群;来源于人尿提取的药品,均应取自健康人群。《中国药典》2015年版三部增订了《生物制品生产用原辅材料及辅料质量控制规程》,并在凡例规定:生产及检定用动物规定,培养细胞用牛血清应来源于无牛海绵状脑病地区的健康牛群,其质量应符合本版药典的有关规定。消化细胞用的胰蛋白酶应证明无外源性或内源性病毒污染。《欧洲药典》9.0在细胞产品和基因治疗产品生物来源的原材料技术要求中,对血清和血清替代品、重组蛋白制品(包括生长素、细胞素类、激素、酶类、单抗制品)、生物材料提取蛋白(酶、多克隆抗体)的来源、生产工艺(包括外源因子去除灭活工艺、工艺验证、外源因子检查)、鉴别、检查做出了相应的规定。
四、全面加强动物来源辅料的质量控制
2008年发生在美国的“肝素”事件;2010年,口服轮状病毒疫苗(Rotarix和RotaTeq)检测出猪环状病毒(porcine circovirus)DNA;2015年, 我国药品监管部门查处了违法生产小牛血去蛋白提取物注射液等问题,暴露出药品生产用动物来源的辅料和原料存在潜在的风险,加强对动物来源的药用辅料的控制不容忽视。
(一)关于动物来源药用辅料质量控制的考虑
1. 生产起始材料的控制
一是明确动物来源。对于不同来源制备的药用辅料,应明确其制备用动物的种类,如生产胶囊用的明胶,应明确其来源是牛源还是猪源,或者猪、牛混合来源或含有其他批准使用的动物来源的成分;二是规范动物材料提取的过程控制要求,包括动物脏器提取的操作过程、脏器筛选、收集、保存运输等过程;三是加强外源因子的控制,根据不同工艺阶段样品的特性,选择和建立灵敏度适宜的检测方法完善检测结果的评估;四是对供应商的审计。加强对动物原料来源的供应商进行常规审计,特别是对动物的饲养设施和环境、动物的健康状况、动物免疫接种情况、日常病原体的监测、相关机构出具的动物检疫检验合格证明等。国家药品监督管理局药品审评中心“关于公开征求《药用辅料登记需求》(征求意见稿)”中,对申报药用空心胶囊、胶囊用明胶、药用明胶等牛源性药用辅料进口的,须提供制备胶囊的主要原料——明胶的制备原料的来源、种类等相关资料和证明,并提供设备原料来源于没有发生疯牛病疫情的国家政府证明文件。
2. 工艺过程控制
动物来源材料间存在较大差异,生产工艺必须经过严格的验证,强化过程质控,才能保证质量的稳定性和批间一致性。基于完善的工艺验证,确定关键工艺质控点,确定相应的工艺参数;建立相应的理化特性质控项目和指标,以保证工艺处理的效果;生产过程中对外源因子污染的控制和检查,比成品控制更加有效;同时建立符合药用辅料的生产管理规范(GMP),控制生产过程中可能引入的内源和外源性污染,并实现生产全过程可追溯。
3. 建立可靠的病毒灭活工艺
对于动物来源的药用辅料,最大限度地杀灭或去除已知或未知的外源因子,建立可靠度病毒灭活工艺,是保障产品安全性的重要工艺步骤,尤其是针对采用动物组织、多组分提取物制成的产品。当然,对于单一成分的提取成分加工产物,其生产工艺中的病毒灭活/去除的程度也应充分了解,应为产品生产过程中,也存在交叉污染的风险。
我国颁布的《血液制品去除/灭活病毒技术方法及验证指导原则》(国药监注〔2002〕160号)中就去除/灭活病毒方法的选择、常用的去除/灭活病毒方法评价。特定的去除/灭活病毒方法验证、生产工艺去除/灭活病毒能力的验证、去除/灭活病毒方法的再验证等做出明确的规定。
(1) 病毒灭活验证的目的
对病毒灭活工艺去除/灭活外源因子的有效性进行充分评估;针对已知和未知外源因子加入指示病毒,应对每一步生产工艺的去除和灭活病毒的效果和能力进行评估,并应选择适当的检测方法。由于动物来源材料的不同,人血、动物血清、动物组织,可能感染不同类型的病毒以及外源因子,因此,病毒灭活工艺应能够去除各种类型的病毒;通常情况下,动物来源起始材料外源因子污染的程度很低,应选择更为灵敏的检测方法,或者对检测样品仅处理扩增后进行检测。病毒灭活/去除工艺应根据产品的种类(包括动物来源种类、起始材料使用的器官或部位、原材料的差异以及材料的稳定性和活性)以及生产工艺的不同而不同。

(2)病毒灭活验证设计
病毒灭活验证设计要考虑指示针对病毒灭活或去除工艺的能力(并不需要对每一个无关的生产工艺的能力进行评估)、验证的环境要求(GMP或GLP),生产规模、相关工艺参数以及可能出现的偏差;建立工艺的病毒灭活/去除的曲线,生产工艺步骤、工艺偏差、生产规模工艺的转化对病毒灭活/去除效果的影响;一个工艺不能满足病毒灭活、去除的需要,可以采用多个工艺联合方式;加入指示病毒量应满足工艺评价的需要,考虑指示病毒模型在评价过程中复制的问题,检测样品的影响,毒性物质的干扰;定量检验检测方法的可靠以及检测结果的评估,如PCR检测,如何评估其是否具有感染性等。
(3)验证病毒的选择
首先是应选择容易污染材料的病毒,理化特性明确,有利于检测评估,同时应慎重选择评价用的毒株,不同来源检测用的毒株存在特性的差别;建立相应的病毒模型,病毒选择上,对于人血浆制品,如HIV病毒;感染或不感染啮齿类动物内源性反转录病毒;通常选择的病毒,如SV40,副流感病毒有包膜RNA,鼠逆转录病毒,疱疹病毒(DNA病毒),病毒选择上应包括脂包膜病毒和非脂包膜,核算类型应包括单链RNA病毒和双联DNA病毒对于羊\牛来源材料还应关注BSE的风险。选择评价方法的有效性、灵敏度、可靠性进行评估。
(4)病毒灭活方法
基于产品的类型选择相应可靠的病毒灭活方法。在选择病毒灭活方法时,应考虑病毒灭活工艺可能对组织成分或组织提取成分及其活性产生的影响。目前病毒灭活常用酸碱处理、有机溶剂表面活性剂(S/D),热灭活、γ射线照射等方法。对于提取含有酶类、脂类或蛋白质等具有生物活性成分的工艺,应采用比较温和的病毒灭活工艺,如S/D法、低pH孵放法、γ射线照射、紫外线照射等方法减少对活性成分的破坏。在生产工艺中,针对材料引入外源因子的风险程度、种类、工艺步骤以及提取成分的耐受性,如果一种病毒灭活工艺不够充分,可以采用两种或两种以上的方式,达到病毒灭活的效果。
4. 外源病毒因子的检查
生产的全过程,应对外源因子进行监测。外源因子包括污染的细菌、真菌、支原体、病毒。其中,难度最大的是外源病毒的检测。根据来源动物的种类、组织器官、生产方式建立完善的外源病毒检测方法和评价动物模型,是对动物健康状况、组织器官筛选、病毒灭活验证工艺的验证和防止终端产品污染外源病毒的重要手段。
传统的外源病毒外源因子检查方法通常包括透射电镜法、体外感染法、生化法、体内法(动物法);随着现代检测技术和分子生物学检测技术的发展,一些成熟的现代检测技术应用于外源因子的监测,如逆转录酶活性(PERT法)、聚合酶链式反应法(polymerase chain reaction,PCR)、DNA 测序 方 法、DNA微 阵 列(DNA Microarrays) 以 及PCR与 质谱连用技术(PCR paired with mass spectrometry)。 新 型 检验检测技术的应用,大大提升了外源因子监测的灵敏度,提高检测效率,能够捕捉到样品中极微小的信号。与此同时,这些检测信号的确证以及是否具有感染性,也给检测结果判定带来一定挑战。2013年,世界卫生组织(WHO)发布了《上市疫苗产品中检测出外源因子的评估原则和考虑要点》,指导对检测结果进行科学合理的评估,在防范风险的同时,避免结果误判所带来不必要的损失。
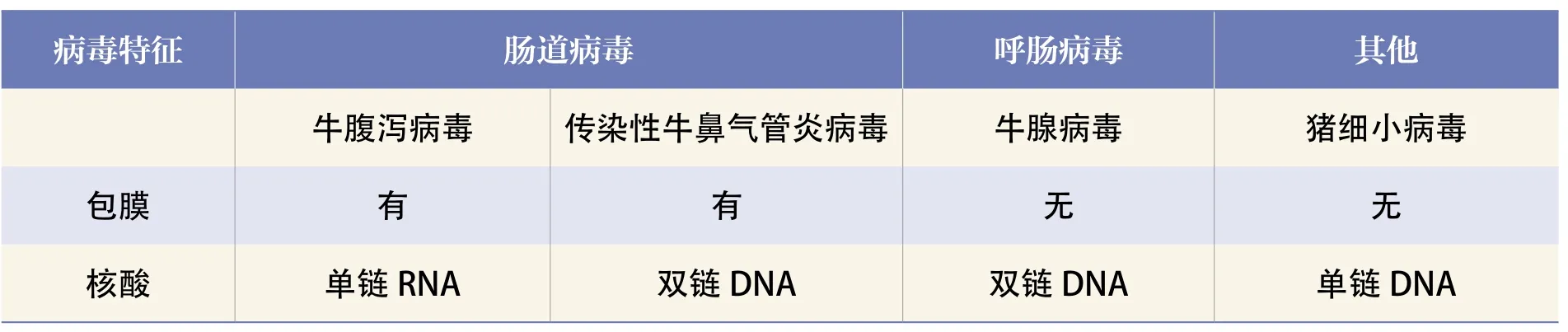
表3 牛源材料病毒灭活验证采用的病毒的选择

5. 质量控制
对于动物来源的材料,特别是多组分或复杂成分的产品,应建立相应活性成分或指征成分的控制,保证产品的稳定性和批间一致性。同时对动物组织中的残留物质以及动物组织中有害物质或在生产工艺总使用的化学试剂或残留溶剂进行相应的控制。
6. 包装、保存和运输
动物来源药用辅料特别是对具有生物活性的材料特定的温度下保存,如牛血清在2~8℃ ,蛋黄卵磷脂在-20℃保存,整个运输过程中都必须在严格的冷链运输。动物来源的材料一般容易引起细菌滋生,因此,必须有严格的包装,避免外界微生物污染。因此对于动物来源的材料,通常应根据产品的特性采用相应的包装、保存和运输方式。
五、结束语
动物来源的药用辅料仅凭终产品的鉴定远不能达到的质量控制。我国对动物来源的材料规定无论在法规层面和技术层面与国际上相关要求相比存在一定差距,有待系统化完善。目前,国家药典委员会正在积极开展动物来源的药用辅料标准的制定,以加强对此类药用辅料生产用原料的来源、生产工艺、外源因子检测、病毒灭活以及方法验证、生产管理体系,以及包装、保存和运输等全过程控制要求,最大程度控制此类材料在生产源头和过程可能引入的风险,保证产品成分的均一性和稳定性,提升产品的质量。
