原辅包关联审评审批制度对制剂研发的影响
2018-10-20中国化学制药工业协会
文/中国化学制药工业协会

随着中国正式加入国际人用药品注册技术要求协调会(ICH),我国的药品审评机制也在逐渐和国际接轨,为贯彻落实国务院“简化药品审批程序,完善药品再注册制度”的意见精神,近年来原国家食品药品监督管理总局颁布了一系列的政策法规,以推进审评审批制度的改革,而其中对于原辅包审评审批的重大变化,也成了整个药品行业关注的热点,药品监管部门发布了系列关联审评审批相关法规。(见表1)

表1 近年来发布的关联审评审批相关法规
原辅包审评审批制度的变化
长期以来,我国对原辅包采取单独注册审批制度,随着时代的发展与科技的进步,该制度的弊端不断显现。原辅包的审评审批与药品的审评审批割裂开来,原辅包单独审批政策只关注原辅包自身的质量,而与制剂产品质量之间的关联较弱,缺乏对药品的有效性、安全性及质量的综合评价。此前我国药用辅料的审评采用国家局和省局二级审评的管理模式,没有国家标准的新辅料由国家局审批,已有国家标准的辅料则由各省局审批。然而在审批的尺度方面,存在一定的地域差异,致使国内辅料质量差异较大。另外,在单独注册审批制度下,药包材和药用辅料企业难免存在“一证在手,万事无忧”的情况,可能对于药用辅料和药包材的生产管理还停留在早期注册时的状态,容易引发质量问题,过去的“齐二药”和“毒胶囊”事件就是例证。
为了进一步完善我国的原辅包的审评审批制度,对药用辅料和药包材进行规范科学的监管,提高国产药品的安全性和有效性,改善国内医药产业发展模式并增强国际竞争力,2016年8月原国家食品药品监督管理总局先后发布了《关于药包材药用辅料与药品关联审评审批有关事项的公告》和《关于发布药包材药用辅料申报资料要求(试行)的通告》,我国药用原辅包的注册管理正式改革为关联审评审批管理模式。
关联审评审批的影响
在146号文之后,国家药品监管部门于2017年12月4日又发布了《原料药、药用辅料及药包材与药品制剂共同审评审批管理办法》的征求意见稿,联合“上市许可持有人”制度,明确建立了以“药品上市许可持有人”为责任主体的药品质量管理体系,以药品制剂质量为核心,原辅包为质量基础,原辅包与制剂共同审评审批的管理模式。
上市许可持有人是制剂文号的所有者,目前,基本还是以制剂生产企业(或集团)为主。制剂企业对所选用的原辅包质量负责,与原辅包企业建立授权使用和监督的质量保障体系。原辅包企业和制剂(上市许可持有人)企业在新药审评审批时所涉及的因素有所不同。(见表2)

表2 原辅包企业和制剂(上市许可持有人)企业在新药审评审批中所涉及的因素
该制度将对药品有效性、安全性具有重要影响作用的药用辅料和包装材料与药品作为一个整体进行审评审批,使药品生产企业与辅料、包材供应商共同对药品质量负责,而药品生产企业作为药品上市许可持有人,需要更多承担药用辅料和药包材对制剂的质量责任,在药品整个生命周期中对制剂安全、有效性的所有环节更加关注。
新的关联审评审批制度是以制剂产品的风险控制为关键控制因素,更加关注药用辅料和药包材对制剂的影响并根据相关联制剂的风险程度划分了不同的风险级别并相应地加以控制,可以有效保证相关联制剂的质量。新的关联审评审批制度对药用辅料和药包材供应商及制剂产品的研发均会产生深远的影响。
从药物本质上看,原辅包只是药物存在的基础,所以将原辅包纳入药物全生命周期管理,更科学更合理,使得药品质量从源头上得到有效控制,并集中到上市许可持有人这个责任主体,从而可以降低因质量问题造成的药品安全风险。这势必惠及广大患者。
医药行业中,制剂企业的质量体系可能相对更完善,管理水平更高。正如人们常说的那句话,能力越大责任越大。关联审评审批制度使上市许可持有人承担原辅包企业不合规而造成的风险,使其肩负推进、监督、审计原辅包合规化的责任,也就是变相的通过制剂企业提升原辅包企业的质量体系水平,最终提高我国医药行业的整体水平。
关联审评审批政策的颁布,势必对相关的原料药、药用辅料和药包材企业造成巨大的影响。原辅包行业的竞争将日趋激烈,其中又不乏机遇和挑战,如何提高研发实力、建立合理的质量体系、规范生产,从而脱颖而出,获得更大的市场,将成为每个相关企业不得不面对的问题。药品研发过程中,原料药、药用辅料、药包材三者需要视作一个整体来进行考察,并最终呈现在患者的面前。原料药作为药品的有效活性成分,其重要程度自不必说,而药用辅料和药包材同样肩负着如何将有效活性成分成功作用于患者的重要责任。
1.制剂与原辅包企业开启深度合作
在《总局关于药包材药用辅料与药品关联审评审批有关事项的公告》文件中,用于吸入制剂、注射剂、眼用制剂的药用辅料和药包材均属于高风险,需要从源头开始对质量进行严格控制。对于注射剂品种,之前有些项目在研发过程中选用药用级的原料,在制剂开发过程中按照注射级原料的要求检测合格后即可用于注射级品种的生产。由于没有从供应的源头对原料药质量进行严格的控制,这种制剂开发虽然最终产品质量没有问题,但原料药质量的可控方面存在较大的风险,可能会发生多批次药用级原料不符合注射级标准而导致生产延迟的情况发生。根据新的审评审批制度,制剂企业需要与原料供应商深度合作,从源头开始对原料质量进行严格控制,降低由于原料质量问题引起的制剂风险,更加有利于制剂产品质量的保证及生产的可持续性和稳定性。
根据关联审评审批申报资料要求,药用辅料供应商需要结合辅料的特征和制备工艺对可能存在或引入的杂质进行评估和总结,此要求对于制剂的研发具有积极的促进作用,通过制剂开发企业与辅料供应商深度交流合作,可在研发早期对可能引起原料降解的风险进行充分的评估和控制,从而降低制剂研发失败的风险。
制剂研发过程中原料药的降解通常源自原料药与制剂中使用的辅料的反应。药物与辅料之间的反应涉及水解,氧化或特异性相互作用。例如,制剂中常用的黏合剂“聚乙烯吡咯烷酮”以及常用的崩解剂“交联聚维酮”中含有的过氧化物杂质,容易引起易氧化的原料与过氧化物发生反应,从而导致杂质的产生。据文献报道,在盐酸雷洛昔芬片剂中,由于辅料中过氧化物杂质的存在,易使原料药反应产生N-氧化物杂质。因此,需要对辅料中过氧化物含量进行控制,也就是对辅料中杂质限度提出了更高的要求。
例如在研发的某项目中,我们发现原料药中的羧基易与制剂产品崩解剂中所含有的乙醇发生反应,产生新的杂质。崩解剂中的乙醇来源于辅料生产过程中的析晶步骤所用溶剂,通过与辅料厂商沟通,选用对乙醇含量控制更加严格的辅料厂商,可有效控制制剂开发风险。由此可见,在关联审评审批政策影响下,制剂企业可以与原辅料定制专属质量标准的辅料来进行处方工艺的开发,从而提高药品的稳定性和安全性。
2.促进新制剂的开发
随着关联审评审批政策的颁布,结合新注册分类管理办法,今后新2类改良型新药将会引领新一轮的研发热潮。同美国FDA的505(b)(2)申请类似,改良型新药同“新药”相比具有得天独厚的优势,无须开展大量的临床前及临床试验来验证其安全性,减少了研发投入;同时可以获得较丰厚的市场回报,“新药监测期”特殊的待遇对企业极具吸引力;与筛选新化学分子相比,改变原有药物的技术难度要低得多,因此改良型新药就理所当然成为一条廉价又相对简单的通路。以美国为例,近年来申报505(b)(2)的药品数量已超过505(b)(1),不难看出,改良型新药的研发已成为全球药物研发的一大重要途径。
改良型新药具有较好的市场前景和相对较低的研发投入,但也存在一定的技术壁垒。新剂型、新处方工艺和新给药途径制剂的开发,与药物自身性质、辅料包材、制剂工艺等都密切相关。尤其是新辅料新包材的应用,是很多改良制剂能够成功上市的关键因素。以治疗儿童多动症的药物安非他命为例,该药普通片剂需要4~6小时给药一次,患者顺应性差。为了解决这一问题,Trispharama公司于2015年10月,上市了一天服用一次的安非他命缓释混悬液(Dyanavel XR)。而另一家公司Neos pharma公司,也开发出了一天一次的缓释口崩片(Adzenys XRODT)和 缓 释 混 悬 液(Adzenys ER),并分别于2016年1月和2017年9月,被美国FDA批准上市。
这两家公司的安非他命改良型制剂的成功上市,都离不开新型辅料的应用。Trispharma的产品使用了一种名为AmberliteTM离子交换树脂,而Neospharma的产品则使用的是名为聚磺苯乙烯钠的离子交换树脂。
由于国内辅料行业整体水平,落后于欧美日等发达国家。在很长一段时间内,国产新型辅料研发能力低下,国际上的新型辅料,又因国内原有审评审批制度的问题,迟迟不能进入国内市场。致使新型辅料在国内因其合法来源问题,得不到及时的应用,限制了改良型制剂的开发。
随着国家药品监管部门关于原辅包备案和关联审评审批改革一系列措施的出台,这一现状将彻底改变。一些前沿的新型辅料和新型包材给药装置(药包材),将不再受限于没有注册证的状况,加速应用;制剂研发也不再困足于选“证”不选“材”的境地。制剂企业甚至可以针对不同药品的不同质量属性、处方工艺、剂型、给药途径等因素,定制化的选择辅料包材(见表3)。这将极大促进企业对产品处方、工艺、质量的提升,也将促进真正有明显技术或临床优势的新制剂的研发。

表3 新型辅料的上市及其用途
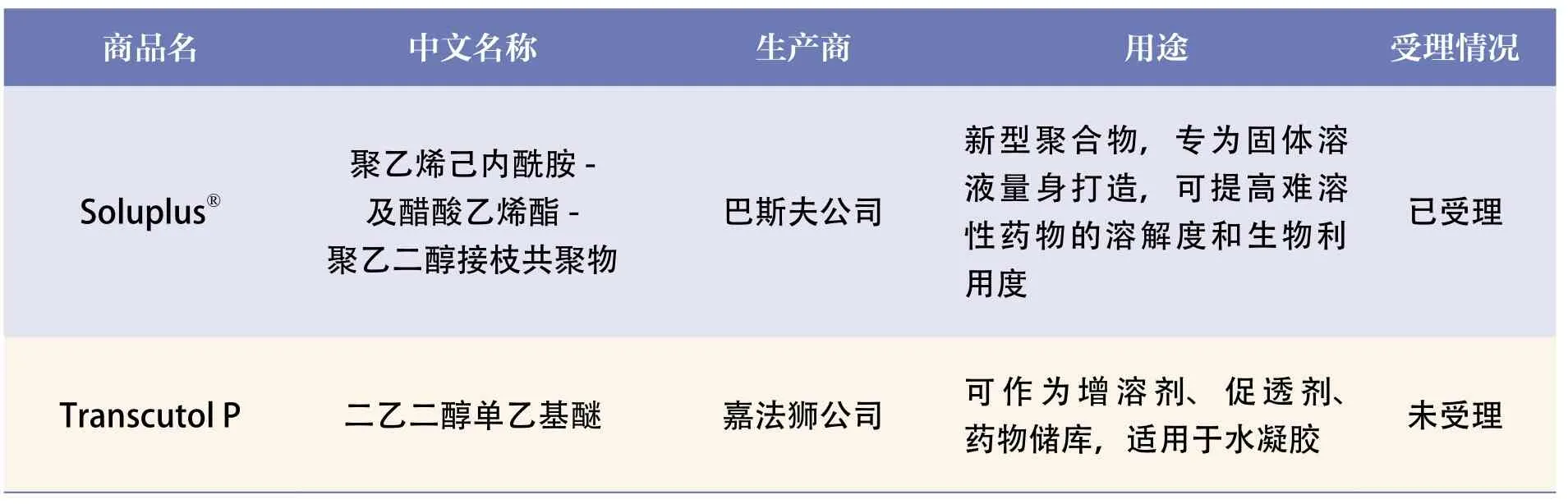
续表
药包材在制剂研发过程中,也同样承担着重要的角色,直接接触药品的包装系统伴随着药品生产、流通、使用的全过程,是药品不可或缺的一部分。随着科技发展进步,药包材的理念也不再局限于传统意义上的包装,而是跃升为给药装置。总局也根据风险评估,对不同的药包材和辅料制定了差异化的审评审批程序。如吸入剂一类的药品,其本身就是依附包材存在;另如一些植入性的缓释给药装置,极大地方便了患者。药品研发结合新型给药装置,可能会颠覆药品使用的固有认知,能更好地保证药品的稳定性和安全性,改善患者的使用体验,以期获得显著的临床优势。
上述这些情况将进一步激起制剂和原辅包企业的研发热情并不断创新,加强相互之间的沟通协作,达到共赢的局面,最终造福广大患者。国家药品监管部门也通过时间限定等手段加快备案制度的实施,借鉴欧美国家多年的实践经验,建立起中国版的原辅包DMF资料申报管理体系,更好地保护申请人的知识产权,更进一步发挥原料药、药包材、药用辅料对制剂研发的支持作用。
3.制剂研发面临的挑战
然而关联审评审批政策在鼓励研发创新的同时,也加重了制剂企业所承担的责任。制剂生产企业作为药品质量的第一责任人,在整个药品周期中对原料药、包材和药用辅料的重视也不可同日而语。药品企业在进行制剂研发的同时,还要对原料药、药包材、药用辅料进行相应的考察,对原料药、药包材、药用辅料生产企业进行审计,需要企业的生产和管理水平上升到一个新的高度,整体保障药品的安全性和有效性,对制剂企业研发是机遇也是考验。
国内原辅包和制剂的关联审评实施后,国内制剂企业(上市许可持有人)在新药(及新仿制药)研发过程中,必须效仿美国制剂商,主动对所涉及的原辅包开展风险评估,防止因原辅包问题而影响制剂的审批。即使制剂获得批文后,制剂企业也必须加强对原辅包企业的日常监督管理与定期审计,防止因原辅包企业的懈怠与疏忽,而最终影响制剂。制剂企业必须建立自己的团队去审查原辅包的质量体系和相应品种的技术资料,或将这部分工作外包给水平更高更专业的第三方机构去做。目前看来制剂企业在实施关联审评的过程中还存在一些问题。

鉴于目前形势政策的思考与建议
关联审评审批制度简化了药用辅料审批流程,但如何真正建立符合我国国情的备案管理制度,提高审评效率,确保药品质量监管,还需多方面的尝试和探索。
建议国家药监局接下来能基于实际情况,参考国外DMF制度,设定不同类别给出相应的要求,并分时段阶段性(过渡)推进原辅包的关联审评审批工作。目前,药品审评中心已经发布《药用辅料登记资料要求(征求意见稿)》和《药包材登记资料要求(征求意见稿)》,根据该征求意见稿对不同类别辅料基于风险级别明确或简化了相关资料要求。国家药品监督管理局也发布了《关于药品制剂所用原料药、药用辅料和药包材登记和关联审评审批有关事宜的公告(征求意见稿)》。作为药品研发生产企业,希望相关的资料要求和简化关联审评审批的政策意见能在充分征求原辅包、药品研发生产企业意见并达成监管共识的基础上尽快颁布执行,进一步明确引导企业进行关联申报。
结语
原辅包关联审评审批制度旨在药品监管同国际接轨,减少政策引起的对行业发展的限制,强调原辅包企业和制剂企业承担起各自的责任,鼓励创新,共同推动行业的发展。随着政策改革所带来的一系列变化,制剂研发的理念和方向也应进行调整和变化,充分利用这些变化带来的机遇,提高研发综合实力,不断创新,原辅包环环相扣,推陈出新,为广大患者用药的安全有效共同努力。
