对进口制剂开展关联审评的建议
2018-10-20RDPAC药用原辅包审评审批工作组
文/ RDPAC药用原辅包审评审批工作组
李流兵(优时比)、吴正宇(诺和诺德)、吴丽(罗氏)、杨凯亮(AZ)、左珺(诺华)、马涛(吉利德)参与本文撰写
原料药、药用辅料和药包材与药物制剂“关联审评”是国际惯例,也是实施“药品上市许可持有人”制度的关键支持政策。原辅包主要用作最终制剂的生产和保护,其监管理念与制剂并不相同。在ICH CTD文件中原辅包申报资料主要体现在其质量部分(模块3),其中原料药关注生产工艺、结构特性、杂质、质量控制、稳定性等方面;药用辅料关注其与原料药的相容性、功能性、质量标准、有无人源或动物源、分析方法等方面;药包材主要关注其是否适用于其预期目的适用性、质量控制和稳定性等方面;而制剂在关注质量的同时,更关注其安全性和有效性,并且最终实现药品预防、诊断、缓解、治疗作用的是制剂,因此,国际上并不单独对原辅包进行上市批准。
DMF(Drug Master File, 药 品 主文件)制度是FDA进行药用原辅包管理的一种制度。美国对药品的监管是一个循序渐进的过程。在著名的“磺胺酏剂事件”后,1938年美国国会通过了《联邦食品、药品和化妆品法案》,该法案规定制剂厂商在上市前需要递交临床研究申请、新药申请、简略新药申请(IND / NDA/ ANDA)等,申请中需要包含所使用的药用辅料/药包材产品的化学、生产、控 制 信 息(chemistry,manufacture,control,CMC),但是药用辅料 /药包材的厂商不愿意将自己产品的核心信息交给制剂厂家。因此,为了保护药包材生产厂商的权益,同时可以审查制剂所使用的包材信息,美国法典314.420部分规定:“申请人根据美国法典312部分的规定递交试验用新药、新药、仿制药申请或修改、补充申请时,可以通过参考DMF文件持有人上报的信息以支持其申请,而该文件持有人不用将信息披露”。FDA从实施DMF制度至今已经70多年。
为贯彻落实《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)(以下简称“44号文”)和《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号文)(以下简称“42号文”),我国的原辅包关联审评制度相关法规/指南经历了从无到有的过程,目前我国的DMF制度尚处于初期阶段。中国加入ICH标志着原辅包的管理也将会与国际接轨。随着改革的深入,该项制度将逐步完善和成熟。
2018年国家药品监管部门发布了《关于公开征求〈药用辅料登记资料要求(征求意见稿)〉和〈药包材登记资料要求(征求意见稿)〉意见的通知》,时隔1个月,国家药监局办公室又发布了《公开征求〈关于药品制剂所用原料药、药用辅料和药包材登记和关联审评审批有关事宜的公告(征求意见稿)〉意见》,这些文件的发布标志着关联审评制度相关政策理念趋于成熟,形成了“基于风险和产品成熟度”对药用辅料和药包材予以分类并简化登记资料的理念。
关联审评制度对进口制剂以及行业的影响
关联审评制度的实施无疑会加快国际协调的步伐,特别是原辅包质量标准的国际协调,对于促进我国医药产业包括原辅包产品的升级起到了至关重要的作用,关联审评制度对进口制剂及行业的主要影响归纳如下:1.有助于明确药品上市许可持有人主体责任,药品上市许可持有人对原辅包的质量负责,对原辅包的生产和质量系统开展定期审计。2.履行知识产权保护的责任,原辅包企业可选择将登记资料并入制剂申请资料一并提交,也可选择自行递交登记资料;DMF登记制度也有利于进口原辅包产品开拓中国市场。3.建立了原辅包登记平台,提高药用辅料、药包材的可追溯性,为未来建立药用辅料、药包材在药物制剂中的使用历史、用量、给药途径的数据库提供基础。4.实施原辅包关联审评后,制剂企业不再受限于有注册证的原辅包,为制剂的开发提供了更大的灵活性和更多选择。5.促进了原辅包行业的国际交流,有助于提升国内医药产业链的整体水平。
关联审评审批制度的实施建议
我国的关联审评制度刚刚起步,而欧美日等其他ICH成员国已积累了数十年的经验,为了使关联审评制度更加有效地落实,作为行业协会,我们提出以下建议供监管机构参考酌情借鉴:
一是由于药用辅料的分类管理应基于其本身的特性、用途、用量、药典收载情况等结合考虑,不应将用于高风险剂型中的药用辅料笼统地归为高风险辅料。美国DMF以及EMA制剂申报辅料资料要求指南(EMEA/CHMP/QWP/396951,2006)对于收录到国际主流药典中且已有使用历史,并在已批准制剂中广泛使用的药用辅料,在制剂上市申请中可只提供简化的信息。制剂上市申请中药用辅料的信息详细程度主要取决于其是否能够支持制剂上市申请以及制剂在生命周期内的质量稳定可控、安全和有效性。对于上述药用辅料,可由供应商自主选择是否登记,而不要求强制登记。在审评过程中,审评员有权根据制剂审评需要要求制剂企业或药用辅料供应商补充额外资料。因此,建议根据药典收载情况、在已批准制剂中是否有使用历史等区分药用辅料的风险并简化其资料要求。将非高风险药用辅料定义为已纳入《中国药典》《美国药典》《欧洲药典》《日本药局方》或《英国药典》的,且药用辅料用量未超过已有相同给药途径药品的最大使用量的药用辅料。此类药用辅料提交资料包括:药用辅料基本信息、生产企业信息、质量标准、检验报告书、非动物源性证明等。此类药用辅料,其生产企业或供应商可自主选择是否按照146号公告要求进行登记。
二是由于药包材的风险等级与制剂剂型有关,同时也与药包材与药物制剂发生相互作用的风险有关,对于用于其他制剂的新材料、新结构和新用途的药包材不建议和用于吸入制剂、注射剂和眼用制剂时同等作为高风险药包材对待,因为不存在等同的风险。因此,建议科学制定非高风险药包材的范围。对于药包材的分类可参考《化学药品与弹性体密封件相容性研究技术指导原则(试行)》指导原则,结合不同给药途径的风险分级和与药物发生相互作用的可能性两个因素(见表1)来确定药包材的风险等级。
三是由于原国家食品药品监督管理总局2017年11月发布的《调整原料药、药用辅料和药包材审评审批事项的公告》(2017年第146号)中要求“药品注册申请人在中华人民共和国境内提出的注册分类2.2、2.3、2.4、3、4、5类药品制剂申请所使用的原料药,以及各类药品注册申请所使用的药用辅料、药包材适用于本公告要求”。因境外生产的制剂所用的药用辅料和药包材供应商的相关业务部门几乎都在国外开设,且多数未在中国设立能够处理登记事务的办事机构,需要额外时间寻求洽谈、审查并委托合适的登记代理机构进行主卷档案的准备、撰写、翻译和登记,以及建立一整套后续的维持体系。因此应充分理解和考虑境外生产的制剂所用药用辅料和药包材供应商登记的实际困难情况,予以过渡期。因此,建议境外生产的制剂所用药用辅料和药包材登记允许适当的过渡期(如2~3年)。在过渡期内,对于无登记号的药用辅料和药包材,具体建议如下:1.制剂上市许可人提供药用辅料/药包材适用性声明(主要信息包括:在上市产品中的使用情况,符合国际主流药典;其他支持信息由各公司根据产品情况自行提供)。2.供应商的来源证明(供参考信息:提供XX给制剂企业,非动物源性,符合国际主流药典,美国DMF号如有)。3.药用辅料/药包材基本信息,包括质量标准、检验报告书。4.旧的辅料或包材注册证(如有)。
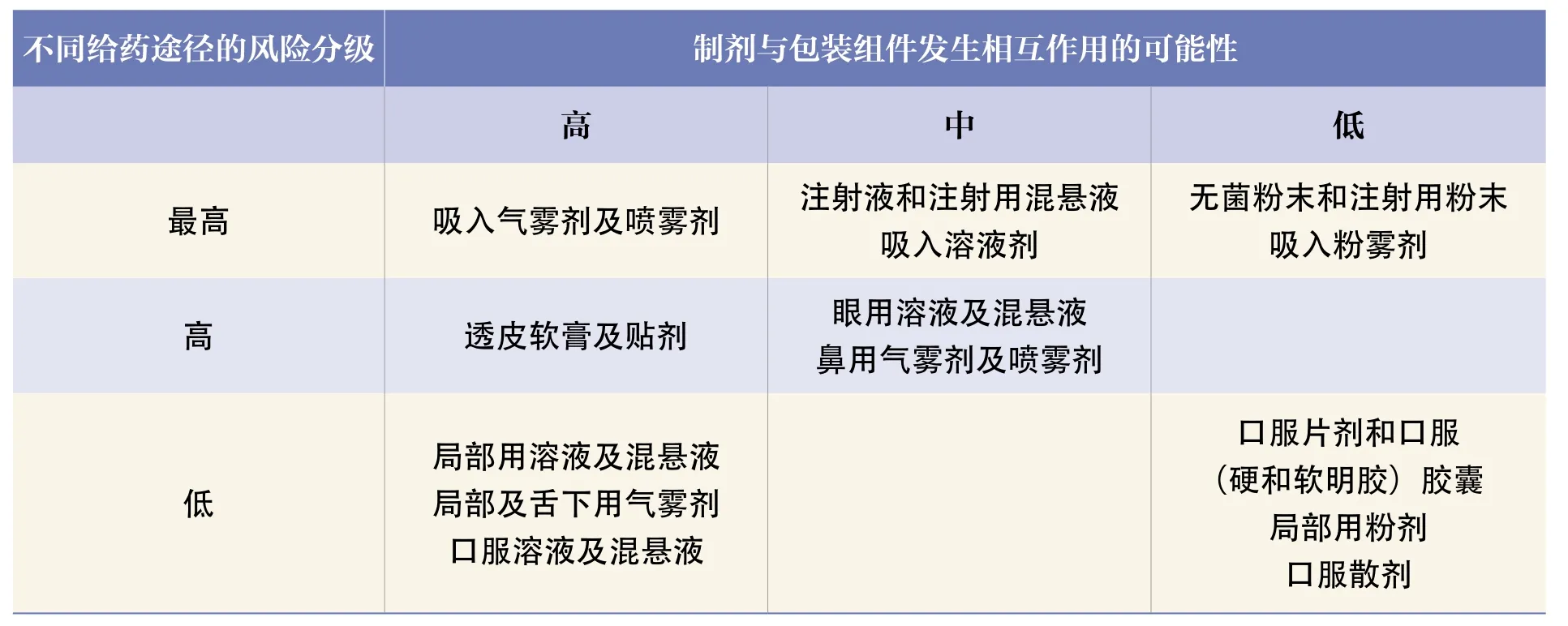
表1 不同给药途径药品的风险分级及其与包装组件发生相互作用的可能性
四是建议允许纸质资料和电子资料递交同时并存,加快登记平台建设,规范电子文件递交格式。电子DMF登记对于监管机构来说是一个不小的挑战。FDA所实施的DMF登记制,从20世纪30年代发展至今仍然接受递交纸质版的文件,电子版DMF文件的递交不是强制性的。虽然要求2017年5月5日起不再接受纸质版的文件,但是留下了充分的过渡时间,并在这之前一直鼓励大家递交电子版的DMF文件。而我国对于DMF制度的实施本身没有太多经验,直接跨到电子版文件递交,其实施有一定难度。DMF备案综合信息平台可以说是整个DMF登记制度以及关联审评制度实施的核心和基础,平台的功能及作用需要通盘考虑,平台使用便捷性、高效性至关重要。
另外,目前递交的电子DMF资料要求是Word格式,这对于资料保密及信息的准确性带来不小的挑战,应考虑更加安全又能保证资料可追溯性的文件格式,如pdf文件。
五是建议进一步明确制剂关联审评审批仅适用于上市申请以及后续涉及原辅包变更的申请。除新药用辅料、新药包材以外,临床试验申请和国际多中心临床试验申请均免于药用辅料和药包材关联审评;建议明确药品制剂上市后变更提交补充申请时,若该变更与原辅包无关,免于原辅包的关联审评;建议药品制剂再注册申请时,若未合并所用辅料或药包材的变更,不应触发关联审评。
最后,考虑到近期关于原辅包所发布的法规和指南文件较多,部分前期发布的文件中有关规定在后续发布的文件发布后已失效。为避免给行业和监管机构带来困惑,建议国家局可综合考虑原辅包登记的适用范围、程序和要求、变更管理、制剂关联审评、各方责任等,在一份法规文件或系统化的文件包中呈现这些要求,以便行业和监管机构有效执行。
