紫苏叶提取物乳膏剂的处方研究
2018-10-20祁金玉李娜坤刘黎瑶通信作者王庆奎张岩
祁金玉,李娜坤,刘黎瑶 ,,通信作者,王庆奎,张岩
紫苏叶提取物乳膏剂的处方研究
祁金玉1,李娜坤1,刘黎瑶1,2,通信作者,王庆奎2,张岩3
(1. 天津农学院 基础科学学院,天津 300384;2. 天津农学院 天津市水产生态及养殖重点实验室,天津 300384;3. 内蒙古通辽市科尔沁区农业技术推广中心,内蒙古 通辽 028000)
中药紫苏叶中富含黄酮类有效成分,外用之后具有抗氧化以及促进表皮细胞生长等生理活性。本研究采用“新生皂法”将紫苏叶醇提物制备成水包油(O/W)型乳膏剂,并通过正交设计对处方中影响乳膏成型性的因素进行了筛选,得到性质稳定、肤感良好的制剂。利用超声提取法对紫苏叶中的黄酮类组分进行提取,以外观均一性、涂布延展性、离心稳定性及耐寒耐热性的综合评分作为考察指标,对油相/水相质量比例、三乙醇胺用量以及辅助乳化剂单硬脂酸甘油酯用量进行正交设计,以筛选出乳膏剂的最优处方。优选处方下,油相/水相比例为35∶65,三乙醇胺和单硬脂酸甘油酯的质量百分比分别为0.6%和3%。制备得到的水包油(O/W)型乳膏剂稳定性良好,为后期进一步应用奠定了基础。
紫苏叶提取物;正交设计;乳膏剂;处方筛选
中药紫苏是唇形科1年生草本植物,常以其干燥茎叶入药[1]。现代药理学研究表明,紫苏叶乙醇提取物中富含黄酮、二氢黄酮类等多种黄酮类有效物质,外用具有清除自由基、抗氧化以及消炎抗菌等作用,有利于皮肤损伤性疾病的防治与预防[2-3]。但是,通过传统水煎剂的方法对紫苏叶提取物进行外用给药极为不便,因此有必要寻找适宜的经皮递送载体来实现紫苏叶提取物有效递送的目的。乳膏剂是外用制剂中的常见剂型,直接将中药提取物以乳膏剂的形式进行经皮给药之后,便于涂布用药,并且有利于提高用药顺应性[4]。目前,尚未见到与紫苏叶提取物相关的制剂学研究。本研究拟采用“新生皂法”将紫苏叶醇提物制备成易于外用给药的水包油(O/W)型乳膏剂,以外观均一性、涂抹延展性、离心稳定性以及耐寒耐热性的综合评价结果作为考察指标[5],并且通过正交筛选考察处方中油相/水相比例、三乙醇胺用量以及辅助乳化剂单硬脂酸甘油酯用量对于乳膏剂成型性的影响,以确定制备紫苏叶提取物乳膏剂的最优处方。
1 仪器与试剂
1.1 仪器
电子天平(Sartorius,BSA 223S);超声波清洗仪(昆山禾创仪器有限公司,KH5200B型);紫外可见分光光度计(北京普析通用仪器有限公司);磁力搅拌器(常州国华电器有限公司);低速离心机(长沙湘仪仪器有限公司,L550);高速粉碎机、恒温水浴锅等。
1.2 试药
中药紫苏饮片(购于北京同仁堂大药房,产地:中国湖北);芦丁标准品(中国药品生物制品检定院,HPLC≥98%);白凡士林(天津奥淇洛谱商贸有限公司,分析纯);三乙醇胺、甲基硅油、硬脂酸、单硬脂酸甘油酯(天津市风船化学试剂有限公司,分析纯);其他试剂均为分析纯。
2 试验方法
2.1 紫苏叶提取物的提取方法
称取适量紫苏叶饮片,洗净并干燥至恒重,使用剪刀尽量剪碎。参照文献[6]中的方法,在辅助加热的条件下对紫苏叶进行超声提取。具体提取方法为:称取15 g紫苏叶碎叶置于250 mL三角瓶中,向其中加入100 mL 70%乙醇,在60 ℃水浴条件下进行超声提取40 min,放凉至室温后用滤纸过滤,取滤液,于4 000 r/min条件下离心20 min,对上清液进行水浴加热浓缩,至提取物浓度约为1 g/mL,作为紫苏叶提取物浸膏液,密封置于4 ℃条件下,备用。
2.2 紫苏叶醇提物中总黄酮含量测定[7]
2.2.1 绘制芦丁标准曲线
准确称量10 mg芦丁标准品置于容量瓶中,加入70%乙醇超声溶解并定容至50 mL,配制浓度为200 μg/mL的储备液。精密移取适量储备液,并用70%乙醇稀释得到1、5、10、15、20 μg/mL梯度浓度的标准溶液。利用紫外分光光度法,在260 nm波长条件下,测定上述系列标准溶液的吸光度。以标准溶液的质量浓度为横坐标,以吸光度为纵坐标,绘制标准曲线,并通过最小二乘法拟合出线性回归方程。
2.2.2 精密度测定
取2.2.1部分的低、中、高浓度的线性样品连续进样5次,测定其在260 nm波长下的吸光度,记录吸光度值并计算相对标准偏差(RSD,%)。
2.2.3 加样回收试验
准确量取已知总黄酮含量的紫苏叶醇提物浸膏,向其中加入适量芦丁标准品储备液,并使用70%乙醇稀释定容,使芦丁标准品的浓度分别为1、10、20 μg/mL。经微孔滤膜过滤之后,通过紫外分光光度法,测定续滤液在260 nm波长下的吸光度,计算标准品的加样回收率。
2.2.4 提取物中总黄酮含量测定
准确量取适量紫苏叶醇提物浸膏至容量瓶中,用70%乙醇稀释定容。经微孔滤膜过滤之后,取续滤液作为供试品溶液,通过紫外分光光度法测定其在260 nm波长下的吸光度,使用标准曲线的回归方程,计算紫苏叶醇提物中总黄酮成分的含量。
2.3 紫苏叶醇提物乳膏剂的处方研究
2.3.1 处方筛选
根据文献调研[8]和前期试验结果,在本项研究中,以特定比例的甲基硅油-凡士林-硬脂酸(4∶3∶1)作为复合油相,通过加入三乙醇胺与油相中的硬脂酸发生皂化反应而发挥乳化作用,并选择单硬脂酸甘油酯作为辅助乳化剂,发挥稳定乳膏剂的作用。前期单因素研究发现,油相/水相比例、三乙醇胺以及单硬脂酸甘油酯的加入量对于乳膏剂的成型性影响较大。因此,通过三因素三水平(L9,34)的正交设计,对上述三大因素进行筛选,因素水平设计表如表1所示。

表1 正交设计因素水平表
2.3.2 考察指标及评价方法
在筛选处方过程中,通过外观均一性、涂抹延展性、离心稳定性以及耐寒耐热性作为评价指标[5],各项考察指标的评价方法如下。
(1)外观均一性评价:取适量样品,目检外观色泽是否均匀、静置是否发生自然分层,记录目检结果并评分。
(2)涂布延展性评价:取适量样品,在滤纸上小心涂布,观察其均匀涂布过程中是否产生颗粒,记录结果并评分。
(3)离心稳定性评价:分别取各处方下的乳膏剂样品1 g,置于离心管中,于6 000 r/min条件下离心30 min,观察是否发生分层、变色等油水分离现象,记录结果并评分。
(4)耐寒性评价:分别称取各处方下的乳膏剂样品1 g,置于离心管中,于-20 ℃条件下静置24 h,观察试验样品是否发生分层、变色等油水分离现象,记录结果并评分。
(5)耐热性评价:取各处方下样品1 g置于离心管中,于60 ℃恒温箱中静置24 h,观察上述试验样品是否发生分层、变色等油水分离现象,记录结果并评分。
考察指标评分方法如表2所示。对上述5项试验的得分进行加和,作为最终综合评分结果。

表2 处方筛选各项考察指标评分表
2.4 制备工艺
根据正交设计得到的各处方,通过“新生皂法”来制备紫苏叶醇提物乳膏剂。为便于平行比较,在制备过程中,设计各处方的制备总量相同,提取物浸膏液的加入量也保持一致。首先取处方量的油相,置于80 ℃水浴,油相受热呈液体状态后,加入处方量的单硬脂酸甘油酯,继续于80 ℃水浴,待用。另取适量浸膏液加于适量蒸馏水中,并加入处方量的三乙醇胺,搅拌至分散均匀,作为水相。80 ℃水浴下,将水相滴加至油相中,全程保持匀速搅拌。滴加结束后,于室温条件下继续保持匀速搅拌15 min,放凉。
2.5 优化处方下乳膏剂稳定性考察
在优选处方设计下,制备3批紫苏叶提取物乳膏剂,分别对其外观均一性、涂布延展性、离心稳定性以及耐寒耐热性进行评价。并于4 ℃条件下密封放置0、1、2个月,对该优选处方下放置稳定性进行初步评价。
3 结果与分析
3.1 紫苏叶醇提物中总黄酮含量测定
3.1.1 标准曲线绘制
按照既定试验方法,配制不同浓度芦丁标准品系列溶液,用紫外分光光度法进行测定。结果表明:以吸光度(纵坐标,)对浓度(μg/mL,横坐标,)进行线性回归,拟合得出回归方程为:=0.044+0.018(2=0.999 0),芦丁标准品系列溶液在1.0~20.0 μg/mL浓度范围内线性关系良好。

图1 芦丁标准品系列溶液标准曲线
3.1.2 精密度测定
按照既定试验方法,低、中、高浓度的芦丁标准品溶液精密度测定结果如表3所示。
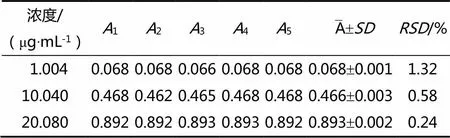
表3 精密度试验结果
注:为待测溶液在260 nm处吸光度值;:标准偏差;:相对标准偏差
测定结果表明,对低、中、高浓度对照品溶液分别连续重复5次,测定的值均小于2%,表明该方法精密度良好。
3.1.3 加样回收率试验
依法对芦丁对照品回收率进行测定,测定结果如表4所示。
结果表明:在既定测定方法下,低、中、高浓度样品回收率均大于95%,且平均回收率的值均小于2%,表明既定测定方法的回收率测定结果合格。
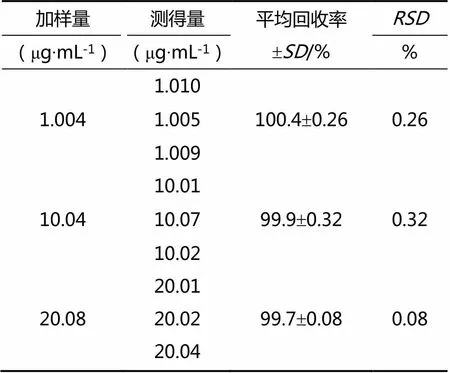
表4 加样回收率测定结果
3.1.4 提取物中总黄酮含量测定
依法对紫苏叶醇提物中总黄酮含量进行测定,测定结果表明,在辅助加热条件下对紫苏叶碎粉进行超声提取,醇提物浸膏中总黄酮含量为50.92 mg/mL。
3.2 紫苏叶提取物乳膏剂的处方研究
通过三因素三水平(L9,34)正交设计,以外观均一性、延展性、离心稳定性以及耐寒耐热性评价的综合评分作为评价指标,对油相/水相比例、三乙醇胺以及单硬脂酸甘油酯用量进行了正交筛选,得出制备紫苏叶提取物乳膏剂的最佳处方,正交分析结果如表5所示。

表5 乳膏剂处方筛选的正交试验结果
分析结果表明,在影响该乳膏剂成型性的三大因素中,油相/水相比例对成型性的影响较大,其次是单硬脂酸甘油酯,再次是三乙醇胺。通过正交极差分析得出最优的处方为A2B3C1,即油相/水相比例为35∶65、三乙醇胺用量为0.6%(/)、辅助乳化剂单硬脂酸甘油酯加入量为3%(/)。
3.3 优化处方下乳膏剂的稳定性评价
按照最优处方条件制备了3批紫苏叶提取物乳膏剂,并对其放置稳定性进行了初步评价表征,结果如表6所示。考察结果表明,优选处方下,制备的3批紫苏叶提取物乳膏剂中总黄酮含量为(0.51±0.09)%(/),目检呈淡绿色,外观完全均匀;涂抹细腻无颗粒,耐寒耐热性评价结果中均未见油水分离的现象;离心稳定性良好,于6 000 r/min条件下离心30 min,均未发生发生分层、变色等油水分离等现象。
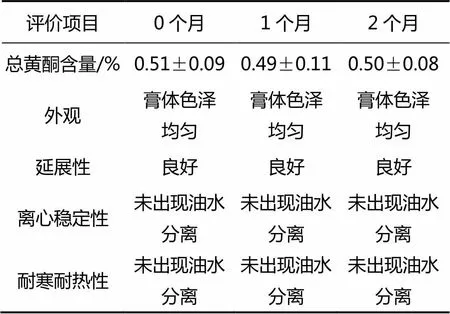
表6 紫苏叶提取物乳膏剂的放置稳定性评价(4 ℃)
将上述3批紫苏叶提取物乳膏剂置于4 ℃条件下进行放置稳定性评价,结果表明:优选处方下紫苏叶提取物乳膏剂放置2个月以内的稳定性良好,总黄酮含量、外观、涂抹延展性、耐寒耐热性以及离心稳定性均未发生显著变化。
4 讨论
乳膏剂是由油相与水相经过乳化作用形成的,通过“新生皂法”来制备乳膏剂时,由于油相中含有少量硬脂酸、油酸等有机酸,同时,水相中含有碱性成分,如三乙醇胺或者氢氧化钠等,在适当温度下混合时,上述油相与水相中的成分会发生皂化反应,在两相界面上生成皂类物质来发挥乳化作用。通过“新生皂法”来制备乳膏剂,可以在无需外加乳化剂的条件下形成稳定的乳膏剂,制备方法更加简便[9-11]。
本研究中,通过系统的处方筛选将紫苏叶醇提物制备成水包油型乳膏剂,外层连续相为水相,内部非连续相为油相。以水包油的形式对有效成分进行递送时,对皮肤的亲和力更好,肤感更加清爽,大大改善了药物的经皮吸收情况[12-14]。
根据前期预试验的基础以及文献调研,发现使用目前常用的油脂性基质来制备乳膏剂时,稳定性差并且过于油腻。因此,根据预试验结果,在本研究中,选择使用特定比例的甲基硅油-凡士林-硬脂酸(4∶3∶1)作为复合油相。在该比例下的复合油相中,黏度与硬度适中,利于乳膏剂成型与涂布。同时,甲基硅油对于皮肤具有较强的亲和力和优良的保湿效果,利于皮肤角质层的水化作用,从而促进有效成分的经皮递送。此外,为进一步完善本乳膏剂对于皮肤水分的保湿能力,考虑在后期研究中向水相加入丙三醇来实现该作用。
在本研究中,通过正交设计进行了相关处方研究,将紫苏叶醇提物制备成稳定的乳膏剂。相对于中药水煎剂直接外敷给药,以乳膏剂的形式进行经皮给药大大提高了用药便利性与顺应性[15],而且更有利于有效成分经皮递送,具有很大的发展空间以及实际应用价值。
[1] 刘浏. 紫苏叶的研究进展[J]. 中国医学创新,2012,9(6):162-164.
[2] Yang S Y,Hong C O,Lee H,et al. Protective effect of extracts oftreated with sucrose on tert-butyl hydroperoxide-induced oxidative hepatotoxicityand[J]. Food Chemistry,2012,133(2):337-343.
[3] 郭雪红. 中药紫苏药理及临床研究新进展[J]. 天津药学,2016,28(2):70-73.
[4] 陈金锋,姜蕾,王坤,等. 中药乳膏剂质量控制及稳定性评价方法浅析[J]. 云南中医学院学报, 2017,40(1):66-69.
[5] 王红茜,凡苗振,邹琴,等. 黄芩总黄酮提取物乳膏剂的处方工艺研究[J]. 天津农学院学报,2017,24(4):33-37.
[6] 胡晓丹,孙爱东,张德权. 超声波提取紫苏叶黄酮的工艺研究[J]. 安徽农业科学,2009,37(5):2046-2048.
[7] 付起凤,康毅华,林万里,等. 正交法优化山楂总黄酮的提取工艺研究[J]. 中医药信息,2010,27(3):65-67.
[8] 赵宁,程玉钏,李伟泽,等. 以白芨多糖为骨架材料的沙棘油凝胶乳的制备及性质研究[J]. 中国油脂,2016,41(6):79-82.
[9] 聂继红,王萍,高晓黎. 中药乳膏剂制备方法研究进展[J].新疆医科大学学报,2005,28(6):598-600.
[10] 华玉铃,贺祝英,张建玲,等. 中药软膏剂制备方法的研究进展[J]. 贵阳中医学院学报,2008,30(2):66-69.
[11] 陈文诚,林建新. 氯地霜的制备与临床应用[J]. 医药导报,2002,21(9): 577-577.
[12] 张少华,任丽琴,包永占,等. 复方中药乳膏剂的透皮效果研究[J]. 动物医学进展,2010,31(1):58-62.
[13] 龙正海,韦登明,杜纪斌. 雷公藤内酯醇复方乳膏剂皮肤毒理及其透皮吸收性能研究[J]. 中成药,2010,32(2):213-218.
[14] 侯豹,陈婷,张治宣,等. 王不留行黄酮苷软膏剂体外透皮吸收研究[J]. 天然产物研究与开发,2016(12):1978-1982.
[15] 王福玲,雷欣. 苦豆子生物碱乳膏剂的制备工艺[J]. 化学与生物工程,2018(1):46-49.
责任编辑:宗淑萍
Ointment formulation optimization of extracts from
QI Jin-yu1, LI Na-kun1, LIU Li-yaoCorresponding Author, WANG Qing-kui2, ZHANG Yan3
(1. College of Basic Science, Tianjin Agricultural University, Tianjin 300384, China; 2. Tianjin Key Lab of Aquatic Ecology and Aquaculture, Tianjin Agricultural University, Tianjin 300384, China; 3. Inner Mongolia Tongliao Horqin District Agricultural Technology Extension Center, Tongliao 028000, Inner Mongolia Autonomous Region, China)
Flavonoids and other effective components are abundant in extracts from leaves ofwith bioactivities of anti-oxidant and promoting epidermal cell growth through transdermal administration. Aiming at these characteristics, ointment was prepared for extracts from leaves ofwith oil-in-water(O/W)type through nascent soap method. Meanwhile, orthogonal screening was used in formulation selection in order to obtain stable ointment formulation with preferred skin-feeling. In this investigation, flavonoid ingredients were acquired through ultrasonic extraction firstly. Afterwards, comprehensive scoring of homogeneity, extensibility, centrifugal stability and cold/heat resistance was set as the evaluation indicator to obtain the optimal ratio of oil phase/water phase, triethanolamine and coemulsifier-glycerin monostearate. After prepared under the optimal formulation, in which the ratio of oil phase/water phase was 35:65, and the mass percentage of triethanolamine and glycerin monostearate was 0.6% and 3%(/)respectively, stable ointment was acquired in oil-in-water type. This study provided the basis for further application ofextracts ointment.
extracts; orthogonal screening; ointment; formulation optimization
1008-5394(2018)03-0065-05
10.19640/j.cnki.jtau.2018.03.014
P641.131;S152.72
A
2018-05-15
天津市教委科研计划项目(2017KJ181);天津市水产产业技术体系创新团队项目(ITTFRS2017004);国家自然科学基金面上项目(31170442)
祁金玉(1996- ),女,本科在读,主要从事生物制菌剂研究。E-mail: 1244645273@qq.com。
刘黎瑶(1988- ),女,讲师,博士,主要从事药物制剂方面的研究。E-mail: llymeilin@163.com。
